课题2 原子的结构(课件精讲)
图片预览








文档简介
(共34张PPT)
课题2 原子的结构
人教版 化学(初中)
重点难 点
2
预习检测
4
学习目标
3
1
新课引入
3
3
合作探究
3
5
典例精讲
6
归纳小结
3
8
课堂内容
达标检测
3
7
学习目标:
重点难点:
1.通过学习,知道并能说出原子的构成。
2.能说出原子核外电子分层排布的规律,学会原子结构的表示方法。
3.能说出离子的形成过程,知道离子也是构成物质的一种粒子。
4.知道相对原子质量的含义,并理解相对原子质量表。
1.原子的内部结构。
2.原子核外电子分层排布的规律。
3.离子形成的过程。
【新课引入】
左图是原子弹爆炸时的蘑菇云的图片。1964年10月16日下午3时,在我国西部地区新疆罗布泊上空,一个巨大火球和蘑菇云升上了戈壁荒漠,中国第一颗原子弹爆炸成功了。为什么原子弹有那么大的威力呢?1897年,在英国科学家汤姆生发现电子以后,人们开始揭示了原子内部的秘密。
道尔顿
汤姆生
卢瑟福
道尔顿实心球型
汤姆生枣糕模型
卢瑟福有核原子模型
学习过程:
【预习检测】
1.原子由居于_________中心的带正电荷的_________和核外带_________的电子构成,原子核由__ _______和________构成。每个质子带____________________,每个电子带
,_________不带电。由于核电荷数和核外电子数_________,但电性_________,因此,原子不显电性。
2. 在原子里,_________=_________数=___________数。
原子
原子核
负电荷
质子
中子
1个单位的正电荷
1个单位的负电荷
中子
相等
相反
质子
核电荷
核外电子
3. 质子和中子的质量很相近,它们的相对质量都约等于1。相对于质子和中子来说,电子的质量很______(填“大”或“小”),所以原子的质量主要集中在_________上,因此,相对原子质量≈_________数+_________数。
小
原子核
质子
中子
【交流与讨论】结合原子结构的探索历程,阅读书P53讨论:
+
+
+
原子不是实心球体,它的体积很小。
原子由原子核和核外电子构成。
原子核由质子和中子构成。
每个质子带一个单位正电荷,每个电子带一个单位负电荷,中子不带电。
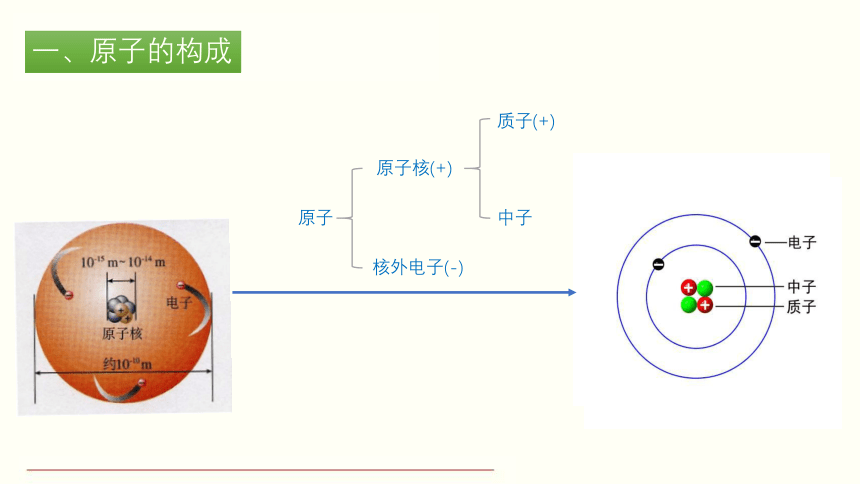
一、原子的构成
1. 原子是实心球体吗?原子的体积大小怎样?
2. 原子是由哪几个部分构成的?
3. 原子核由哪几种粒子构成?
4. 原子中各种粒子带电情况如何?
质子(+)
中子
原子
核外电子(-)
原子核(+)
一、原子的构成
归纳与总结
由于原子核和核外电子所带的电量相等、电性相反,所以整个原子不显电性。
2.中子不带电
1.1个电子带一个单位负电荷
3.1个质子带一个单位正电荷
思考与交流
根据表3-1,思考并回答下列问题:
中子数
质子数
氢
碳
氧
钠
氯
原子种类
核外电子
1
0
1
6
6
6
8
8
8
11
12
11
17
18
17
思考与交流
归纳与总结
1.是否所有原子的原子核内都有中子
2.同种原子的原子核内的质子数和中子数有何特点
3.原子中有带电的粒子,那么整个原子是否带电 为什么
4.不同种类的原子内部结构有何不同
1.不是所有的原子都有中子,氢原子中没有中子
2.在原子中,质子数不一定等于中子数
3.原子不带电,因为质子数等于核外电子数
4.不同种的原子内质子数不同
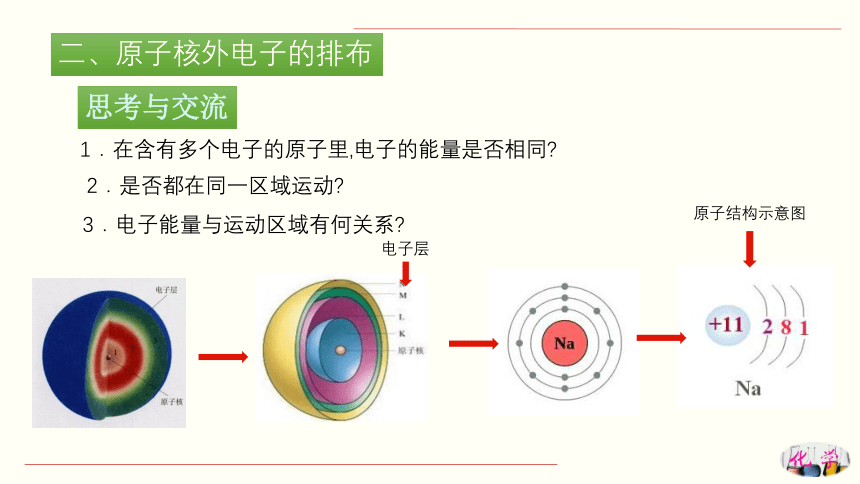
二、原子核外电子的排布
电子层
原子结构示意图
1.在含有多个电子的原子里,电子的能量是否相同
2.是否都在同一区域运动
3.电子能量与运动区域有何关系
思考与交流
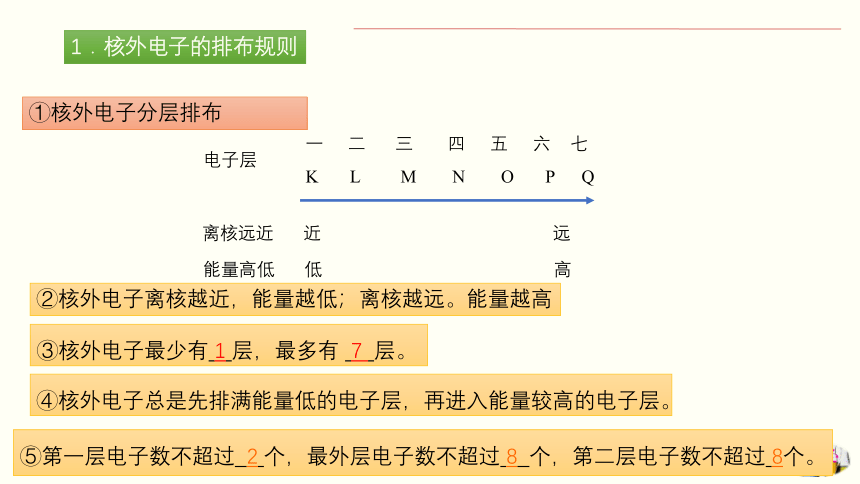
1.核外电子的排布规则
①核外电子分层排布
二 三 四 五 六 七
K L M N O P Q
电子层
离核远近 近 远
能量高低 低 高
②核外电子离核越近,能量越低;离核越远。能量越高
⑤第一层电子数不超过 2 个,最外层电子数不超过 8 个,第二层电子数不超过 8个。
④核外电子总是先排满能量低的电子层,再进入能量较高的电子层。
③核外电子最少有 1 层,最多有 7 层。
原子核
该层的电子数
核内质子数
2.原子结构示意图
电子层
①根据原子序数得出核电荷数(质子数),写在圆圈中,并在数字前标上正号。
3.原子结构示意图书写步骤
②从左往右依次用短弧线表示电子层,并标出每层所排电子数。
③排满一层后,再排下一层。第一层电子数不超过2个,第二层电子数不超过8个,最外层电子数不超过8个。
活动探究
1-18元素原子结构示意图
找出其中的金属元素,非金属元素,稀有气体元素。
并分析它们各自的最外层电子数有什么特点。
4.元素的种类以及化学性质与原子最外层电子数关系:
③稀有气体的原子最外层都有 电子(氦为____个电子),不易_____
也不易_____电子,是一种相对稳定结构。
①金属的原子最外层电子一般_____4个,在化 学反应中易 电子;
②非金属的原子最外层电子一般 4个,在化学反应中易______电子;
少于
失去
多于
得到
8
2
失去
得到
结论:
元素的化学性质主要由原子的最外层电子数决定的。
元素的种类由原子的核电荷数(或质子数)决定。
5.离子的形成
下面是钠原子和氯原子,这两种原子的结构稳定吗?这两种原子该如何变化才能达到稳定呢?
8
2
1
+11
Na
8
2
+11
Na+
失去电子
8
2
8
+17
Cl-
8
2
7
+17
Cl
得到电子
Na+
Cl-
Na+
Cl-
钠离子
原子
失电子
阳离子( + )
氯离子
阴离子( - )
得电子
原子
离子:带有电荷的原子或原子团。
离子带的电荷数等于该原子(或原子团)失去或得到电子的数目。
6.离子的表示方法
如:Na+ (钠离子) 、 Mg2+ (镁离子) 、 Cl- (氯离子) 、 O2- (氧离子)
在元素符号的右上角标出所带的电荷数,数值在前,符号在后,1可以省略不写。
离子结构示意图
8
2
+11
8
+17
8
2
钠离子:
氯离子:
离子符号
Cl-
Na+
离子表示的意义
2Mg
表示2个镁离子
2+
表示每个镁离子带2个单位的正电荷
7.离子与原子的区别
粒子种类 原子 离子
阳离子 阴离子
区 别 粒子结构
化学性质
电 性
符 号
联 系
核内质子=
核外电子数
核内电子数>
核外电数
核内电子数<
核外电子数
不一定稳定
较稳定
较稳定
不显电性
带正电
带负电
用元素符号表示:
如:S、Na……
用阳离子符号表示:
如:Na+Mg2+……
用阴离子符号表示:
如:Cl-、O2-……
原子
阳离子
失电子
得电子
失电子
得电子
阴离子
三、相对原子质量
一个碳原子的质量是:1.993×10-26千克;一个氧原子的质量是:2.657×10-26千克
一个铁原子的质量是:9.288×10-26千克
由于原子质量的数值太小,书写和使用都很不方便,怎么办?
相对原子质量就是以一种碳原子质量的1/12(1.66×10-27Kg)为标准,其他原子的质量跟它相比较所得到的比。
某原子的相对原子质量(Ar)=
碳原子质量的1/12
该原子(A)的质量
(4)相对原子质量≈质子数+中子数
归纳与总结
(1) “一种碳原子”指质子数和中子数都为6的碳原子
(2) “相对原子质量”是一个比值;
(3) “相对原子质量”单位为“ 1 ”,可省略。
【典例精讲】
例1.(2021山东聊城二模)下列关于微观粒子说法不正确的是( )
A.分子的质量一定比原子的质量大
B.同种原子可以构成不同种分子
C.所有原子都由原子核和核外电子构成
D.原子得到或失去电子变成离子
A
【答案】C
【解析】A、核内质子数决定元素的种类,故上述五种微粒只涉及四种元素,此选项表述正确;B、最外层电子数决定元素的化学性质,当最外层是8电子时,化学性质比较稳定,此选项表述正确;C、原子不带电,核内质子数等于核外电子数,阴离子带负电,核内质子数小于核外电子数,阳离子带正电,核内质子数大于核外电子数,故①②④属于原子,③属于阳离子,⑤属于阴离子,此选项表述不正确;D、①对应的元素是F,④对应的元素是Na,两种元素组成化合物的化学式为NaF,此选项表述正确。故选C。
【典例精讲】
C
例2. (2021湖南常德)如图是五种微粒的结构示意图,下列说法不正确的是( )
A.上述五种微粒只涉及四种元素
B.②③⑤表示的微粒性质较稳定
C.①②④属于原子,③⑤属于阴离子
D.①④对应元素组成化合物的化学式为NaF
-
【答案】C
【解析】A、核内质子数决定元素的种类,故上述五种微粒只涉及四种元素,此选项表述正确;B、最外层电子数决定元素的化学性质,当最外层是8电子时,化学性质比较稳定,此选项表述正确;C、原子不带电,核内质子数等于核外电子数,阴离子带负电,核内质子数小于核外电子数,阳离子带正电,核内质子数大于核外电子数,故①②④属于原子,③属于阳离子,⑤属于阴离子,此选项表述不正确;D、①对应的元素是F,④对应的元素是Na,两种元素组成化合物的化学式为NaF,此选项表述正确。故选C。
【达标训练】
1.(2021崇州市崇庆中学实验学校erm ) 下列对分子、原子、离子的认识正确的是( )
A.同种分子排列方式不同,化学性质不同
B.在干冰中,分子因相互作用而静止不动
C.同种原子按不同方式结合,可以构成不同的物质
D.原子得失电子形成离子后,原子核发生了变化
C
2.(2021金堂县福兴镇初级中学二模)在下列示意图表示的粒子中,属于原
子的有 (填序号,下同),属于阳离子的有 ,属于阴离子的
有 ,属于同种元素的为 。
②⑤⑥
①④
③
④⑤
3.(2021山东杜郎口中学二模)如图,A、B、C是三种粒子的结构示意图。
请回答下列问题:
(1)在A、B、C三种粒子中属于阳离子的是 ,属于阴离子的是 ,
属于原子的是 。
(2)用化学符号表示:A ,C 。
(3)A、B、C三种粒子中,不具备稳定结构的是 (填序号)。
A
C
B
Mg2+
Cl-
B
3.下列说法中,错误的是( )
A.作为相对原子质量标准的碳原子是由6个中子和6个质子构
成的
B.相对原子质量是以碳原子质量的1/12作为标准
C.相对原子质量和原子的实际质量是一个概念
D.一种原子的相对原子质量近似等于原子核内质子数和中子
数之和
C
4.化学变化中的最小粒子是( )
A.分子 B.原子
C.质子 D.电子
5.原子的质量主要集中在( )
A.质子 B.中子
C.电子 D.原子核
A
D
6.(2021金堂县赵镇云绣初级中学校二模)据报道,上海某医院正在研究
用放射性碘治疗肿瘤。 这种碘原子的核电荷数为53,相对原子质量为125。
下列关于这种原子的说法中,错误的是( )
A.中子数为72 B.质子数为72
C.电子数为53 D.质子数和中子数之和为125
7.用其质量的1/12作为相对原子质量的标准的碳原子
相对原子的质量是( )
A.12g B.12
C.1/12g D.1/12
B
B
【归纳小结】
通过本节课的学习,同学们谈谈有哪些收获?
1.完成配套练习册;
2.预习课题3 元素;
3.书面作业:课后习题2、3。
【作业布置】
谢 谢!
课题2 原子的结构
人教版 化学(初中)
重点难 点
2
预习检测
4
学习目标
3
1
新课引入
3
3
合作探究
3
5
典例精讲
6
归纳小结
3
8
课堂内容
达标检测
3
7
学习目标:
重点难点:
1.通过学习,知道并能说出原子的构成。
2.能说出原子核外电子分层排布的规律,学会原子结构的表示方法。
3.能说出离子的形成过程,知道离子也是构成物质的一种粒子。
4.知道相对原子质量的含义,并理解相对原子质量表。
1.原子的内部结构。
2.原子核外电子分层排布的规律。
3.离子形成的过程。
【新课引入】
左图是原子弹爆炸时的蘑菇云的图片。1964年10月16日下午3时,在我国西部地区新疆罗布泊上空,一个巨大火球和蘑菇云升上了戈壁荒漠,中国第一颗原子弹爆炸成功了。为什么原子弹有那么大的威力呢?1897年,在英国科学家汤姆生发现电子以后,人们开始揭示了原子内部的秘密。
道尔顿
汤姆生
卢瑟福
道尔顿实心球型
汤姆生枣糕模型
卢瑟福有核原子模型
学习过程:
【预习检测】
1.原子由居于_________中心的带正电荷的_________和核外带_________的电子构成,原子核由__ _______和________构成。每个质子带____________________,每个电子带
,_________不带电。由于核电荷数和核外电子数_________,但电性_________,因此,原子不显电性。
2. 在原子里,_________=_________数=___________数。
原子
原子核
负电荷
质子
中子
1个单位的正电荷
1个单位的负电荷
中子
相等
相反
质子
核电荷
核外电子
3. 质子和中子的质量很相近,它们的相对质量都约等于1。相对于质子和中子来说,电子的质量很______(填“大”或“小”),所以原子的质量主要集中在_________上,因此,相对原子质量≈_________数+_________数。
小
原子核
质子
中子
【交流与讨论】结合原子结构的探索历程,阅读书P53讨论:
+
+
+
原子不是实心球体,它的体积很小。
原子由原子核和核外电子构成。
原子核由质子和中子构成。
每个质子带一个单位正电荷,每个电子带一个单位负电荷,中子不带电。
一、原子的构成
1. 原子是实心球体吗?原子的体积大小怎样?
2. 原子是由哪几个部分构成的?
3. 原子核由哪几种粒子构成?
4. 原子中各种粒子带电情况如何?
质子(+)
中子
原子
核外电子(-)
原子核(+)
一、原子的构成
归纳与总结
由于原子核和核外电子所带的电量相等、电性相反,所以整个原子不显电性。
2.中子不带电
1.1个电子带一个单位负电荷
3.1个质子带一个单位正电荷
思考与交流
根据表3-1,思考并回答下列问题:
中子数
质子数
氢
碳
氧
钠
氯
原子种类
核外电子
1
0
1
6
6
6
8
8
8
11
12
11
17
18
17
思考与交流
归纳与总结
1.是否所有原子的原子核内都有中子
2.同种原子的原子核内的质子数和中子数有何特点
3.原子中有带电的粒子,那么整个原子是否带电 为什么
4.不同种类的原子内部结构有何不同
1.不是所有的原子都有中子,氢原子中没有中子
2.在原子中,质子数不一定等于中子数
3.原子不带电,因为质子数等于核外电子数
4.不同种的原子内质子数不同
二、原子核外电子的排布
电子层
原子结构示意图
1.在含有多个电子的原子里,电子的能量是否相同
2.是否都在同一区域运动
3.电子能量与运动区域有何关系
思考与交流
1.核外电子的排布规则
①核外电子分层排布
二 三 四 五 六 七
K L M N O P Q
电子层
离核远近 近 远
能量高低 低 高
②核外电子离核越近,能量越低;离核越远。能量越高
⑤第一层电子数不超过 2 个,最外层电子数不超过 8 个,第二层电子数不超过 8个。
④核外电子总是先排满能量低的电子层,再进入能量较高的电子层。
③核外电子最少有 1 层,最多有 7 层。
原子核
该层的电子数
核内质子数
2.原子结构示意图
电子层
①根据原子序数得出核电荷数(质子数),写在圆圈中,并在数字前标上正号。
3.原子结构示意图书写步骤
②从左往右依次用短弧线表示电子层,并标出每层所排电子数。
③排满一层后,再排下一层。第一层电子数不超过2个,第二层电子数不超过8个,最外层电子数不超过8个。
活动探究
1-18元素原子结构示意图
找出其中的金属元素,非金属元素,稀有气体元素。
并分析它们各自的最外层电子数有什么特点。
4.元素的种类以及化学性质与原子最外层电子数关系:
③稀有气体的原子最外层都有 电子(氦为____个电子),不易_____
也不易_____电子,是一种相对稳定结构。
①金属的原子最外层电子一般_____4个,在化 学反应中易 电子;
②非金属的原子最外层电子一般 4个,在化学反应中易______电子;
少于
失去
多于
得到
8
2
失去
得到
结论:
元素的化学性质主要由原子的最外层电子数决定的。
元素的种类由原子的核电荷数(或质子数)决定。
5.离子的形成
下面是钠原子和氯原子,这两种原子的结构稳定吗?这两种原子该如何变化才能达到稳定呢?
8
2
1
+11
Na
8
2
+11
Na+
失去电子
8
2
8
+17
Cl-
8
2
7
+17
Cl
得到电子
Na+
Cl-
Na+
Cl-
钠离子
原子
失电子
阳离子( + )
氯离子
阴离子( - )
得电子
原子
离子:带有电荷的原子或原子团。
离子带的电荷数等于该原子(或原子团)失去或得到电子的数目。
6.离子的表示方法
如:Na+ (钠离子) 、 Mg2+ (镁离子) 、 Cl- (氯离子) 、 O2- (氧离子)
在元素符号的右上角标出所带的电荷数,数值在前,符号在后,1可以省略不写。
离子结构示意图
8
2
+11
8
+17
8
2
钠离子:
氯离子:
离子符号
Cl-
Na+
离子表示的意义
2Mg
表示2个镁离子
2+
表示每个镁离子带2个单位的正电荷
7.离子与原子的区别
粒子种类 原子 离子
阳离子 阴离子
区 别 粒子结构
化学性质
电 性
符 号
联 系
核内质子=
核外电子数
核内电子数>
核外电数
核内电子数<
核外电子数
不一定稳定
较稳定
较稳定
不显电性
带正电
带负电
用元素符号表示:
如:S、Na……
用阳离子符号表示:
如:Na+Mg2+……
用阴离子符号表示:
如:Cl-、O2-……
原子
阳离子
失电子
得电子
失电子
得电子
阴离子
三、相对原子质量
一个碳原子的质量是:1.993×10-26千克;一个氧原子的质量是:2.657×10-26千克
一个铁原子的质量是:9.288×10-26千克
由于原子质量的数值太小,书写和使用都很不方便,怎么办?
相对原子质量就是以一种碳原子质量的1/12(1.66×10-27Kg)为标准,其他原子的质量跟它相比较所得到的比。
某原子的相对原子质量(Ar)=
碳原子质量的1/12
该原子(A)的质量
(4)相对原子质量≈质子数+中子数
归纳与总结
(1) “一种碳原子”指质子数和中子数都为6的碳原子
(2) “相对原子质量”是一个比值;
(3) “相对原子质量”单位为“ 1 ”,可省略。
【典例精讲】
例1.(2021山东聊城二模)下列关于微观粒子说法不正确的是( )
A.分子的质量一定比原子的质量大
B.同种原子可以构成不同种分子
C.所有原子都由原子核和核外电子构成
D.原子得到或失去电子变成离子
A
【答案】C
【解析】A、核内质子数决定元素的种类,故上述五种微粒只涉及四种元素,此选项表述正确;B、最外层电子数决定元素的化学性质,当最外层是8电子时,化学性质比较稳定,此选项表述正确;C、原子不带电,核内质子数等于核外电子数,阴离子带负电,核内质子数小于核外电子数,阳离子带正电,核内质子数大于核外电子数,故①②④属于原子,③属于阳离子,⑤属于阴离子,此选项表述不正确;D、①对应的元素是F,④对应的元素是Na,两种元素组成化合物的化学式为NaF,此选项表述正确。故选C。
【典例精讲】
C
例2. (2021湖南常德)如图是五种微粒的结构示意图,下列说法不正确的是( )
A.上述五种微粒只涉及四种元素
B.②③⑤表示的微粒性质较稳定
C.①②④属于原子,③⑤属于阴离子
D.①④对应元素组成化合物的化学式为NaF
-
【答案】C
【解析】A、核内质子数决定元素的种类,故上述五种微粒只涉及四种元素,此选项表述正确;B、最外层电子数决定元素的化学性质,当最外层是8电子时,化学性质比较稳定,此选项表述正确;C、原子不带电,核内质子数等于核外电子数,阴离子带负电,核内质子数小于核外电子数,阳离子带正电,核内质子数大于核外电子数,故①②④属于原子,③属于阳离子,⑤属于阴离子,此选项表述不正确;D、①对应的元素是F,④对应的元素是Na,两种元素组成化合物的化学式为NaF,此选项表述正确。故选C。
【达标训练】
1.(2021崇州市崇庆中学实验学校erm ) 下列对分子、原子、离子的认识正确的是( )
A.同种分子排列方式不同,化学性质不同
B.在干冰中,分子因相互作用而静止不动
C.同种原子按不同方式结合,可以构成不同的物质
D.原子得失电子形成离子后,原子核发生了变化
C
2.(2021金堂县福兴镇初级中学二模)在下列示意图表示的粒子中,属于原
子的有 (填序号,下同),属于阳离子的有 ,属于阴离子的
有 ,属于同种元素的为 。
②⑤⑥
①④
③
④⑤
3.(2021山东杜郎口中学二模)如图,A、B、C是三种粒子的结构示意图。
请回答下列问题:
(1)在A、B、C三种粒子中属于阳离子的是 ,属于阴离子的是 ,
属于原子的是 。
(2)用化学符号表示:A ,C 。
(3)A、B、C三种粒子中,不具备稳定结构的是 (填序号)。
A
C
B
Mg2+
Cl-
B
3.下列说法中,错误的是( )
A.作为相对原子质量标准的碳原子是由6个中子和6个质子构
成的
B.相对原子质量是以碳原子质量的1/12作为标准
C.相对原子质量和原子的实际质量是一个概念
D.一种原子的相对原子质量近似等于原子核内质子数和中子
数之和
C
4.化学变化中的最小粒子是( )
A.分子 B.原子
C.质子 D.电子
5.原子的质量主要集中在( )
A.质子 B.中子
C.电子 D.原子核
A
D
6.(2021金堂县赵镇云绣初级中学校二模)据报道,上海某医院正在研究
用放射性碘治疗肿瘤。 这种碘原子的核电荷数为53,相对原子质量为125。
下列关于这种原子的说法中,错误的是( )
A.中子数为72 B.质子数为72
C.电子数为53 D.质子数和中子数之和为125
7.用其质量的1/12作为相对原子质量的标准的碳原子
相对原子的质量是( )
A.12g B.12
C.1/12g D.1/12
B
B
【归纳小结】
通过本节课的学习,同学们谈谈有哪些收获?
1.完成配套练习册;
2.预习课题3 元素;
3.书面作业:课后习题2、3。
【作业布置】
谢 谢!
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
