课题3 制取氧气(1)(课件)
图片预览




文档简介
(共18张PPT)
课题3 制取氧气
温故知新
1.如何检验一种气体是氧气?
2.氧气有哪些用途?
学习目标
1.了解实验室中制取氧气的方法和原理
认识分解反应、催化剂及催化作用。
3 掌握实验室制取氧气的实验操作。
分解过氧化氢(H2O2)
加热氯酸钾(KClO3)
加热高锰酸钾(KMnO4)
实验室制取氧气的方法:
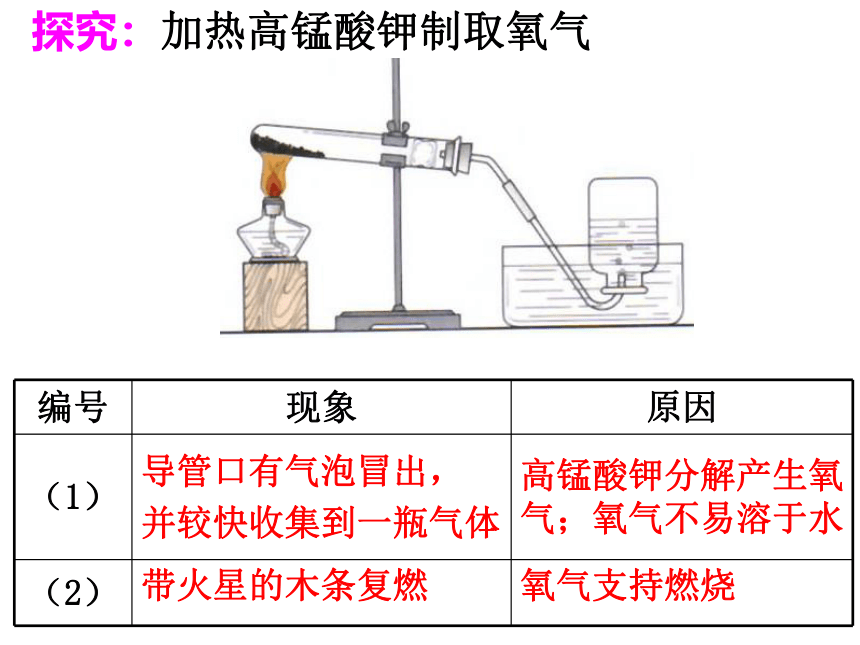
探究:加热高锰酸钾制取氧气
编号 现象 原因
(1) 导管口有气泡冒出,
并较快收集到一瓶气体 高锰酸钾分解产生氧气;氧气不易溶于水
(2) 带火星的木条复燃 氧气支持燃烧
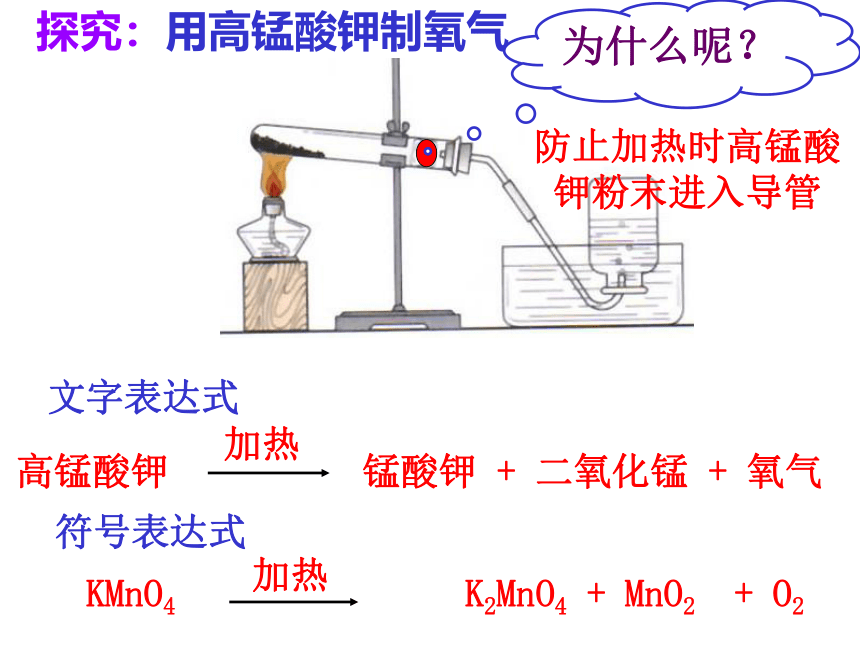
探究:用高锰酸钾制氧气
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
KMnO4 K2MnO4 + MnO2 + O2
加热
文字表达式
符号表达式
为什么呢?
防止加热时高锰酸钾粉末进入导管
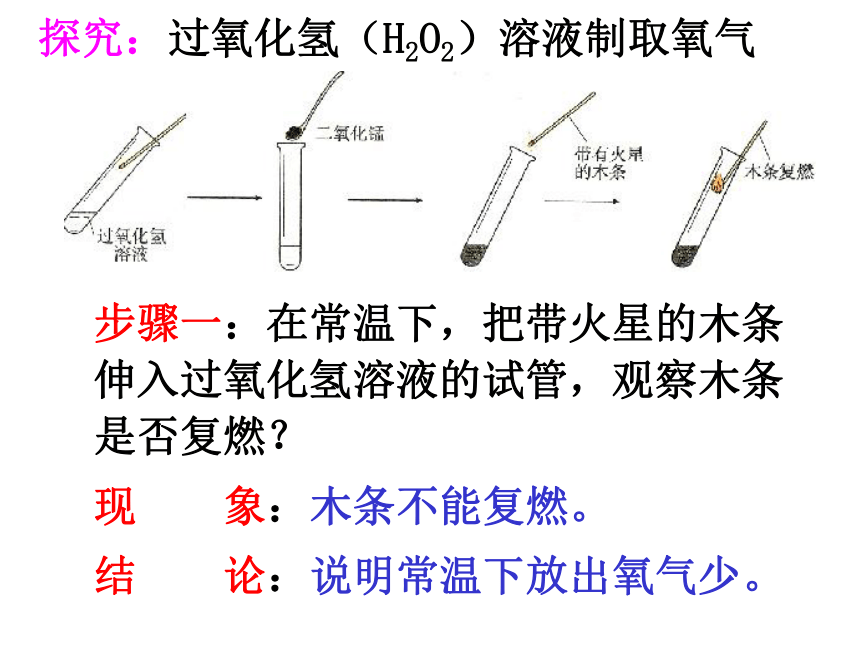
步骤一:在常温下,把带火星的木条伸入过氧化氢溶液的试管,观察木条是否复燃?
现 象:木条不能复燃。
结 论:说明常温下放出氧气少。
探究:过氧化氢(H2O2)溶液制取氧气
步骤二:向上述试管中,加入少量二氧化锰,把带火星的木条伸入试管。观察发生的现象。
现 象:木条复燃了
结 论:说明在常温下过氧化氢溶液遇到二氧化锰(MnO2)时迅速产生氧气。
步骤三:反应停止后,重新加入过氧化氢溶液,把带火星的木条伸入试管。观察发生的现象。
现 象:木条复燃了
结 论:说明二氧化锰(MnO2)仍然起作用时产生氧气。
催化剂:在化学反应里能改变其他物质的化学反应速率,而本身质量和化学性质在化学反应前后都没有发生变化的物质。催化剂的特点
一 变:改变化学反应速率
二不变:质量不变、化学性质不变
过氧化氢 水 + 氧气
二氧化锰
H2O2 H2O + O2
MnO2
文字表达式:
符号表达式:
氯酸钾 氯化钾 + 氧气
二氧化锰
加热
KClO3 KCl + O2
MnO2
加热
文字表达式
符号表达式
过氧化氢 水 + 氧气
二氧化锰
氯酸钾 氯化钾 + 氧气
二氧化锰
加热
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
由一种反应物生成两种或两种以上其他物质的反应。“一变多”
A → B + C + ···
分解反应:
工业方法制氧气
——分离液态空气方法
原理:利用液态空气的沸点不同,
属于物理变化。
随堂检测
1.催化剂在化学反应中所起的作用是( )
(A)加快化学反应速率
(B)使生成物质量增加
(C)改变化学反应速率
(D)减慢化学反应速率
C
2、某同学设计了4种制氧气的方案:①用氯酸钾和二氧化锰共热;②使高锰酸钾受热; ③用高锰酸钾和氯酸钾共热;④使二氧化锰受热.判断这四种方法: ( )
A.全正确 B. 全不正确
C. ①②③正确 D.只有①②正确
3、实验室用氯酸钾和二氧化锰混合加热制氧气,反应前后二氧化锰在固体混合物中质量分数是: A、由大到小 B、由小到大 ( ) C、不变 D、无法判断
C
B
4、下列反应属于分解反应的是( )
A.
B.
C.
D.
硫
+
氧气
二氧化硫
点燃
铁 + 氧气 四氧化三铁
点燃
石蜡 + 氧气 二氧化碳 + 水
点燃
氧化汞 汞 + 氧气
加热
D
5、在高锰酸钾分解制氧气的反应中,二氧化锰是________物。在氯酸钾与二氧化锰混合加热制氧气时,氯酸钾是________物,二氧化锰是_____,若将高锰酸钾加入氯酸钾,则反应______,
这是因为________________________。
6、三份质量相等的氯酸钾固体。第一份中加入少量二氧化锰,第二份中加入少量高锰酸钾,第三份不加任何物质。给它们分别加热完全分解,放出氧气的 量: ( ) A、第一份最多 B、第二份最多 C、第三份最多 D、一样多
B
生成
反应
催化剂
速率加快
高锰酸钾分解生成了二氧化锰
课题3 制取氧气
温故知新
1.如何检验一种气体是氧气?
2.氧气有哪些用途?
学习目标
1.了解实验室中制取氧气的方法和原理
认识分解反应、催化剂及催化作用。
3 掌握实验室制取氧气的实验操作。
分解过氧化氢(H2O2)
加热氯酸钾(KClO3)
加热高锰酸钾(KMnO4)
实验室制取氧气的方法:
探究:加热高锰酸钾制取氧气
编号 现象 原因
(1) 导管口有气泡冒出,
并较快收集到一瓶气体 高锰酸钾分解产生氧气;氧气不易溶于水
(2) 带火星的木条复燃 氧气支持燃烧
探究:用高锰酸钾制氧气
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
KMnO4 K2MnO4 + MnO2 + O2
加热
文字表达式
符号表达式
为什么呢?
防止加热时高锰酸钾粉末进入导管
步骤一:在常温下,把带火星的木条伸入过氧化氢溶液的试管,观察木条是否复燃?
现 象:木条不能复燃。
结 论:说明常温下放出氧气少。
探究:过氧化氢(H2O2)溶液制取氧气
步骤二:向上述试管中,加入少量二氧化锰,把带火星的木条伸入试管。观察发生的现象。
现 象:木条复燃了
结 论:说明在常温下过氧化氢溶液遇到二氧化锰(MnO2)时迅速产生氧气。
步骤三:反应停止后,重新加入过氧化氢溶液,把带火星的木条伸入试管。观察发生的现象。
现 象:木条复燃了
结 论:说明二氧化锰(MnO2)仍然起作用时产生氧气。
催化剂:在化学反应里能改变其他物质的化学反应速率,而本身质量和化学性质在化学反应前后都没有发生变化的物质。催化剂的特点
一 变:改变化学反应速率
二不变:质量不变、化学性质不变
过氧化氢 水 + 氧气
二氧化锰
H2O2 H2O + O2
MnO2
文字表达式:
符号表达式:
氯酸钾 氯化钾 + 氧气
二氧化锰
加热
KClO3 KCl + O2
MnO2
加热
文字表达式
符号表达式
过氧化氢 水 + 氧气
二氧化锰
氯酸钾 氯化钾 + 氧气
二氧化锰
加热
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
由一种反应物生成两种或两种以上其他物质的反应。“一变多”
A → B + C + ···
分解反应:
工业方法制氧气
——分离液态空气方法
原理:利用液态空气的沸点不同,
属于物理变化。
随堂检测
1.催化剂在化学反应中所起的作用是( )
(A)加快化学反应速率
(B)使生成物质量增加
(C)改变化学反应速率
(D)减慢化学反应速率
C
2、某同学设计了4种制氧气的方案:①用氯酸钾和二氧化锰共热;②使高锰酸钾受热; ③用高锰酸钾和氯酸钾共热;④使二氧化锰受热.判断这四种方法: ( )
A.全正确 B. 全不正确
C. ①②③正确 D.只有①②正确
3、实验室用氯酸钾和二氧化锰混合加热制氧气,反应前后二氧化锰在固体混合物中质量分数是: A、由大到小 B、由小到大 ( ) C、不变 D、无法判断
C
B
4、下列反应属于分解反应的是( )
A.
B.
C.
D.
硫
+
氧气
二氧化硫
点燃
铁 + 氧气 四氧化三铁
点燃
石蜡 + 氧气 二氧化碳 + 水
点燃
氧化汞 汞 + 氧气
加热
D
5、在高锰酸钾分解制氧气的反应中,二氧化锰是________物。在氯酸钾与二氧化锰混合加热制氧气时,氯酸钾是________物,二氧化锰是_____,若将高锰酸钾加入氯酸钾,则反应______,
这是因为________________________。
6、三份质量相等的氯酸钾固体。第一份中加入少量二氧化锰,第二份中加入少量高锰酸钾,第三份不加任何物质。给它们分别加热完全分解,放出氧气的 量: ( ) A、第一份最多 B、第二份最多 C、第三份最多 D、一样多
B
生成
反应
催化剂
速率加快
高锰酸钾分解生成了二氧化锰
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
