课题3 制取氧气(3)(课件)
图片预览




文档简介
(共17张PPT)
课题3 制取氧气
第二单元 我们周围的空气
观察与思考
潜水员在潜水时总是在身后背着一个氧气瓶。你知道氧气瓶中的氧气是怎样制取的吗?
1.初步学习在实验室制取氧气的原理和方法
3.知道什么是分解反应
2.了解催化剂的概念和催化剂的作用
学习目标
认知与了解
实验室制取氧气
一
观察与思考
实验室制取氧气的常用方法:
1.分解过氧化氢(H2O2)溶液
2.加热氯酸钾(KClO3)和二氧化锰(MnO2)的混合物
3.加热高锰酸钾(KMnO4)
思考:用哪一种方法制取氧气最好?
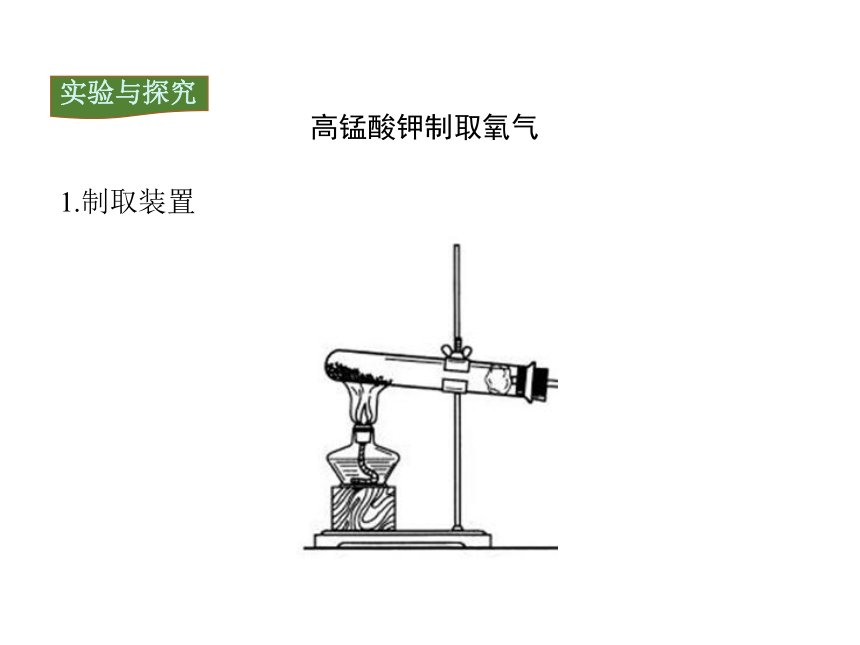
1.制取装置
高锰酸钾制取氧气
实验与探究
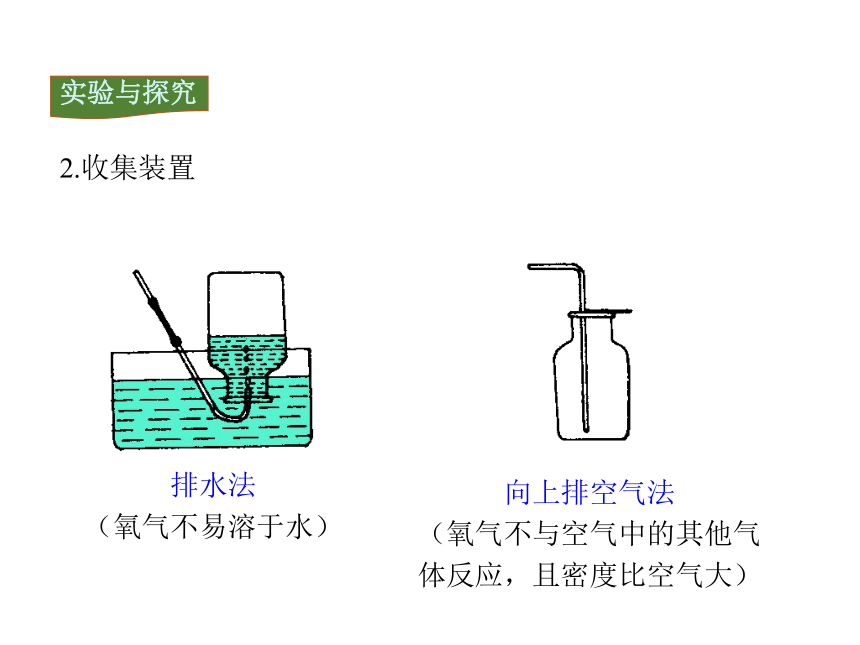
排水法
(氧气不易溶于水)
向上排空气法
(氧气不与空气中的其他气体反应,且密度比空气大)
实验与探究
2.收集装置
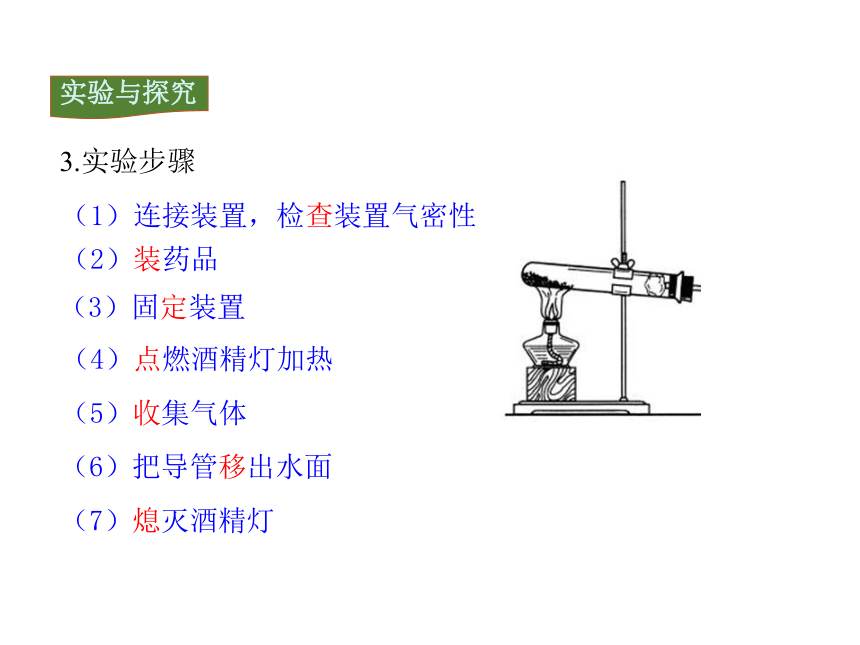
(2)装药品
(4)点燃酒精灯加热
(5)收集气体
(6)把导管移出水面
(3)固定装置
(7)熄灭酒精灯
(1)连接装置,检查装置气密性
实验与探究
3.实验步骤
(1)用排水法收集:当集气瓶的一侧有气泡放出时,证
明已收集满。
(2)用向上排空气法收集:将带火星的木条放在集气瓶
口,若木条复燃,证明已收集满。
实验与探究
4.验满方法
实验与探究
分解反应
二
观察与思考
实验室制取氧气的反应原理:
上述三个反应的共同点有哪些?它们属于哪种反应类型?
(2)
加热
高锰酸钾
KMnO4
锰酸钾
K2MnO4
O2
氧气
+
+
二氧化锰
MnO2
二氧化锰
(3)
过氧化氢
H2O2
O2
氧气
+
水
H2O
(1)
氯酸钾
KClO3
氯化钾
KCl
+
氧气
O2
二氧化锰
加热
化合反应与分解反应的特点可以表示如下:
化合反应:A + B → AB
分解反应:AB → A + B
分解反应
由一种反应物生成两种或两种以上其他物质的反应。
归纳与小结
氧气的工业制法
三
观察与思考
思考:工业制取氧气与实验室制取氧气在反应类型上是否相同?
催化剂在化工生产中的重要作用
使化学反应加快的催化剂,叫作正催化剂;使化学反应减慢的催化剂,叫作负催化剂。催化剂在化工生产中有重要的作用,如汽车尾气处理中用催化剂促进有害气体的转化,酿造工业和制药工业用酶作催化剂等。
知识与拓展
一、实验室制取氧气
过氧化氢制氧气
二、分解反应
由一种反应物生成两种或两种以上其他物质的反应。
三、工业制法
过氧化氢 氧气+水
二氧化锰
归纳与小结
1.实验室用过氧化氢制取氧气,若实验中忘记加入二氧化锰,其结果是( )
A.不产生氧气 B.产生氧气的速度慢
C.产生氧气的总量少 D.没有影响
B
知识与拓展
巩固与提高
2.下列反应属于分解反应的是:
(1)(3)
(1)碳酸 二氧化碳+水
(2)铁 + 氧气 四氧化三铁
(3)氧化汞 汞 + 氧气
(4)石蜡 + 氧气 水 +二氧化碳
加热
点燃
点燃
知识与拓展
巩固与提高
3.下图是实验室制备、收集、验满、验证氧气性质的操作,其中正确的是( )
A
知识与拓展
巩固与提高
课题3 制取氧气
第二单元 我们周围的空气
观察与思考
潜水员在潜水时总是在身后背着一个氧气瓶。你知道氧气瓶中的氧气是怎样制取的吗?
1.初步学习在实验室制取氧气的原理和方法
3.知道什么是分解反应
2.了解催化剂的概念和催化剂的作用
学习目标
认知与了解
实验室制取氧气
一
观察与思考
实验室制取氧气的常用方法:
1.分解过氧化氢(H2O2)溶液
2.加热氯酸钾(KClO3)和二氧化锰(MnO2)的混合物
3.加热高锰酸钾(KMnO4)
思考:用哪一种方法制取氧气最好?
1.制取装置
高锰酸钾制取氧气
实验与探究
排水法
(氧气不易溶于水)
向上排空气法
(氧气不与空气中的其他气体反应,且密度比空气大)
实验与探究
2.收集装置
(2)装药品
(4)点燃酒精灯加热
(5)收集气体
(6)把导管移出水面
(3)固定装置
(7)熄灭酒精灯
(1)连接装置,检查装置气密性
实验与探究
3.实验步骤
(1)用排水法收集:当集气瓶的一侧有气泡放出时,证
明已收集满。
(2)用向上排空气法收集:将带火星的木条放在集气瓶
口,若木条复燃,证明已收集满。
实验与探究
4.验满方法
实验与探究
分解反应
二
观察与思考
实验室制取氧气的反应原理:
上述三个反应的共同点有哪些?它们属于哪种反应类型?
(2)
加热
高锰酸钾
KMnO4
锰酸钾
K2MnO4
O2
氧气
+
+
二氧化锰
MnO2
二氧化锰
(3)
过氧化氢
H2O2
O2
氧气
+
水
H2O
(1)
氯酸钾
KClO3
氯化钾
KCl
+
氧气
O2
二氧化锰
加热
化合反应与分解反应的特点可以表示如下:
化合反应:A + B → AB
分解反应:AB → A + B
分解反应
由一种反应物生成两种或两种以上其他物质的反应。
归纳与小结
氧气的工业制法
三
观察与思考
思考:工业制取氧气与实验室制取氧气在反应类型上是否相同?
催化剂在化工生产中的重要作用
使化学反应加快的催化剂,叫作正催化剂;使化学反应减慢的催化剂,叫作负催化剂。催化剂在化工生产中有重要的作用,如汽车尾气处理中用催化剂促进有害气体的转化,酿造工业和制药工业用酶作催化剂等。
知识与拓展
一、实验室制取氧气
过氧化氢制氧气
二、分解反应
由一种反应物生成两种或两种以上其他物质的反应。
三、工业制法
过氧化氢 氧气+水
二氧化锰
归纳与小结
1.实验室用过氧化氢制取氧气,若实验中忘记加入二氧化锰,其结果是( )
A.不产生氧气 B.产生氧气的速度慢
C.产生氧气的总量少 D.没有影响
B
知识与拓展
巩固与提高
2.下列反应属于分解反应的是:
(1)(3)
(1)碳酸 二氧化碳+水
(2)铁 + 氧气 四氧化三铁
(3)氧化汞 汞 + 氧气
(4)石蜡 + 氧气 水 +二氧化碳
加热
点燃
点燃
知识与拓展
巩固与提高
3.下图是实验室制备、收集、验满、验证氧气性质的操作,其中正确的是( )
A
知识与拓展
巩固与提高
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
