第3单元 物质构成的奥秘(单元课件精讲)
文档属性
| 名称 | 第3单元 物质构成的奥秘(单元课件精讲) |  | |
| 格式 | pptx | ||
| 文件大小 | 828.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-09 16:14:48 | ||
图片预览









文档简介
(共34张PPT)
第3单元 物质构成的奥秘
人教版 化学(初中)
(复 习)
重点难 点
2
预习检测
4
学习目标
3
1
新课引入
3
3
合作探究
3
5
典例精讲
6
归纳小结
3
8
课堂内容
达标检测
3
7
学习目标:
复习重难点:
1.知道物质是由分子、原子、离子构成的。
2.知道原子的结构和构成特点。
3.知道离子的结构特点,会写常见的离子符号。
4.能用微粒的观点解释生活中的现象。
5.知道元素组成物质,能从元素周期表获取有用信息。
1.知道离子的结构特点,会写常见的离子符号。
2.能从元素周期表获取有用信息。
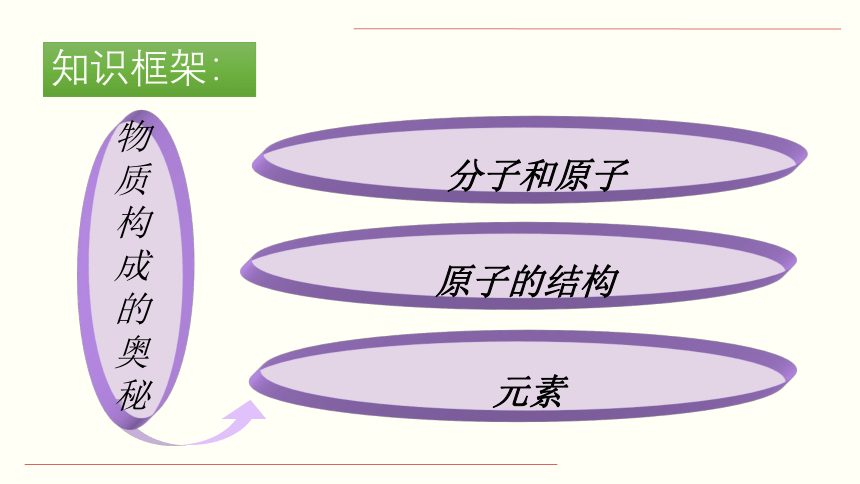
知识框架:
物
质
构
成
的
奥
秘
原子的结构
分子和原子
元素
一.分子和原子
2.什么是分子?
分子是保持其化学性质的最小粒子
1.什么是原子?
原子是化学变化中的最小粒子
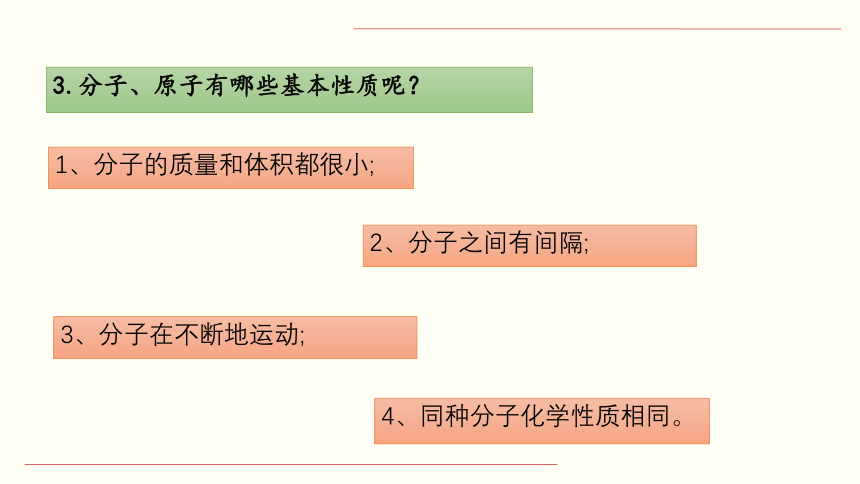
4、同种分子化学性质相同。
1、分子的质量和体积都很小;
3、分子在不断地运动;
2、分子之间有间隔;
3.分子、原子有哪些基本性质呢?
从分子的角度分析水的蒸发与水的分解两种变化的不同之处。
变化或现象 解 释
水的蒸发
水的分解
水蒸发是物理变化,水分子本身没有变化,变化的只是分子间的间隔。
水分解是化学变化,水分子变成了氢分子和氧分子。
交流与讨论
【典例精讲】
例1.(2020湖南衡阳)某同学从衡阳到西藏旅游,到达西藏后,发现从衡阳
带来的密封饼干包装袋鼓起了。包装袋鼓起的原因是( )
A.袋内饼干的体积变大
B.袋内气体分子的体积变大
C.袋内气体分子个数增多
D.袋内气体分子间的间隙变大
【解析】将方便面从衡阳带到西藏,西藏属于高原地区,气压低,故饼干包装
袋内气体分子间间隔变大,而饼干的体积、气体分子的体积和个数不会变化。故选D。
D
例2. (2021云南省卷)打开香水瓶盖闻到浓郁的香水气味,说明( )
A.分子在不停地运动 B.分子间有间隔
C.分子的体积很小 D.分子的质量很小
【典例精讲】
【答案】A
【解析】打开香水瓶盖闻到浓郁的香水气味,是因为分子是不断运动的,香水气味的分子运动到我们的鼻腔被我们感受到,所以有香水味,故选:A。
A
【典例精讲】
例3.(2021山西晋中)随着科技的进步,我们可通过扫描隧道显微
镜获得苯分子的图像。观察下图,有关苯分子的表述错误的是( )
A.它在不断运动 B.它体积很小
C.分子间有间隔 D.它真实存在
【答案】A
【解析】通过扫描隧道显微镜获得苯分子的图像,苯分子肉眼不可见,通过扫描隧道显微镜才能发现,说明它的体积很小,通过图像可以看出,分子之间存在间隔,能通过扫描隧道显微镜获得苯分子的图像,说明它真实存在,不能说明它在不断运动。故选A。
例2.(2021湖南长沙)防疫期间常用酒精消毒,在消毒过程中我们能闻到酒精散发出的特殊气味,主要是因为( )
A.分子的体积很小 B.分子间有间隔
C.分子在不断运动 D.分子可以再分
【答案】C
【解析】分子是在不断运动的,我们能闻到酒精散发出的特殊气味,主要是因为分子不断运动,向四周扩散,被人闻到;故选C。
C
【典例精讲】
二.原子的结构
原子
原子核
电 子
质子
中子
(不带电)
(+)
(-)
(+)
(不带电)
元素种类
决定
原子质量
最外层电子数决
定元素化学性质
排 布
分层
就近
限量
核电荷数=质子数=电子数
相对原子质量≈质子数+中子数
相对原子质量=
某元素一个原子的质量
一个碳原子质量的1/12
原子结构示意图
+11
2
8
1
Na
原子核
核内质子数
电子层
电子层上
的电子数
原子的构成规律
归纳总结
2、核电荷数 = 质子数 = 核外电子数
1、原子核所带的电荷数简称为核电荷数
3、原子中质子数不一定等于中子数
4、原子中不一定含有中子
5、不同种类的原子,其核内质子数和核外电子数都不相同
6、原子的质量主要集中在原子核上
归纳总结
构成物质的微粒:分子、原子、离子
由原子构成的物质:
稀有气体(He、 Ne 、 Ar 等)
金属 ( Fe、Mg、Zn等 )
一些固态非金属( Si、P等)
由分子构
成的物质:
一些常见的气体
(H 2O 、P2O5、HgO等)
(H2 、O2 、Cl2 、N2等)
(CO2、CO 、 SO2等)
其他物质
金属元素和非金属元素组成的物质(如:NaCl、等)
金属(铵根)和酸根离子组成的物质(KNO3)
由离子构
成的物质:
什么是离子?
离子也是构成物质的一种粒子。
归纳总结
离子是带电的原子或原子团。
1.定义
2.分类:
阳离子
带正电的原子,如Na+
阴离子
带负电的原子,如Cl-
3.离子符号的意义
表示每个镁离子带2个单位的正电荷
2Mg2+
表示2个镁离子
粒子种类 核内质子数与核外电子数的关系
原子(不带电)
阳离子(带正电)
阴离子(带负电)
核内质子数 = 核外电子数
核内质子数 > 核外电子数
核内质子数 < 核外电子数
原子和离子的联系和区别
原子
阳离子
阴离子
失电子
得电子
失电子
得电子
【典例精讲】
例4.(2021江苏省苏州高新区实验初级中学二模)下列对分子、原子和离
子的认识正确的是( )
A. 分子和原子在化学变化中都能够再分
B. 只有分子能保持物质的化学性质
C. 原子的质量主要集中在原子核上
D. 离子之间存在着相互作用,分子之间没有相互作用
【解析】A、分子在化学变化中能够再分,原子在化学变化中不能再分,错误;B、分子、原子、离子都能保持物质的化学性质,错误;C、原子的质量主要集中在原子核上,正确;D、离子、分子、原子之间都存在着相互作用,错误。故选C。
C
例5.(2021 江苏南京)下列粒子结构示意图中,表示阴离子的是( )
A B C D
【答案】A
【解析】A、质子数=9>核外电子数=10,为阴离子,正确;B、质子数=10,核外电子数=10,质子数=核外电子数,为原子,错误;C、质子数=11,核外电子数=10,质子数>核外电子数,为阳离子,错误;D、质子数=13>核外电子数=10,质子数>核外电子数,为阳离子,错误;故选A。
【典例精讲】
A
三.元 素
1.元素的概念
元素是 (即核电荷数)相同的一类原子的总称。
质子数
2.元素的化学性质
(1)元素的化学性质与其原子的核外电子排布,特别是______________________有关。
最外层电子的数目
(2)在化学变化时, 的种类不变, 也不变。
元素
原子
3.元素分类——目前已发现一百余种元素
元素
金属元素:
非金属元素:
汉字特点:带“钅”旁,“金”和“汞”例外
稀有气体元素:
“石” 固态非金属
“气” 气态非金属
“氵” 液态非金属
氦、氖、氩、氪、氙
4.元素与原子的区别与联系
元素 原子
定 义
不 同 点
相互关系
具有相同核电荷数的一类原子的总称
化学变化中的最小粒子
①只讲种类,不讲个数;
②是宏观的概念;
③只能组成物质,不能构成物质;
④化学变化中元素的种类和质量不变。
①既讲种类,又讲个数;
②是微观的概念;
③可直接构成物质,也可构成分子;
④化学变化中原子的种类、数目、质量都不变。
元素是具有相同核电荷数的一类原子的总称,
原子是元素的个体,是化学变化中的最小粒子。
5.元素与物质、微观粒子的关系
元素
质子数相同
的一类原子
金刚石、
汞等
分子
氧气、氢气等
离子
氯化钠等
结合
分解
聚集
得失电子
结合
原子
结合
6.元素符号
(1)书写:“一大二小”。
(2)元素符号的意义
①表示一种______;
②表示这种元素的一个______;
③对于由单个原子构成的单质,还表示这种______。
如Fe、Ar。
元素
原子
物质
7.元素周期表
(1)原子序数:元素周期表按原子________________的顺序给元素编的号。
(2)布局:7横行形成____个周期,18纵行形成____个族( 8、9、10三纵行组成一个族)。
(3)每一个元素占据一格,每一格均包含一种元素的___________________________________________________等内容。
核电荷数递增
7
16
原子序数、元素符号、元素名称、相对原子质量
原子序数=核电荷数=质子数=核外电子数
【典例精讲】
例6. (2021四川广安)加碘盐是在食盐中加入一定量的碘酸钾(K1O3),其中碘元素在周期表中的信息及碘原子的结构示意图如图所示,下列说法正确的是( )
A.碘元素是金属元素 B.碘原子的质子数是53
C.图中n的值为5 D.碘原子在反应中一般较易失去电子
B
【答案】B
【分析】
元素周期表信息图中,元素名称的左上角的数字为元素的原子序数,右上角为元素符号,中间的汉字表示元素名称,下边是元素的相对原子质量。
【解析】
A、由汉字结构可知,碘元素是非金属元素,错误;
B、原子中质子数=原子序数,故碘原子的质子数是53,正确;
C、原子中质子数=核外电子数,故55=2+8+18+18+n,n=7,错误;
D、碘原子最外层电子数为7,大于4,在反应中一般容易得到1个电子,错误。
故选B。
【典例精讲】
例5.(2021宁波市海曙外国语学校二模)2019是门捷列夫发现元素
周期表的150周年,被确定为“世界化学元素周期表年”,图1是元素周期表的部分内
容,图2是这三种元素的原子结构示意图。
(1)SeO2的相对分子质量为__________________。
(2)图2中硫原子的结构示意图是_____________。
(3)氧、硫、硒三种元素化学性质相似的原因是 。
(4)画出O2-离子的结构示意图是_____________。
。
111
B
最外层电子数相同
【解析】(1)SeO2的相对分子质量=79+16x2=111;
(2)硫原子的质子数为16,所以硫原子的结构示意图是B;
(3)元素的化学性质跟它的原子的最外层电子数目关系非常密切,
最外层电子数相同的元素化学性质相似,氧、硫、硒三种元素化学
性质相似的原因是它们的原子的最外层电子数相同;
(4)氧离子的核内质子数为8,带有2个单位的负电荷,核外有2个
电子层,第一层上有2个电子、第二层上有8个电子,其结构示意图
为:
1.完成配套练习册单元检测题;
2.预习课题1 爱护水资源。
【作业布置】
谢 谢!
第3单元 物质构成的奥秘
人教版 化学(初中)
(复 习)
重点难 点
2
预习检测
4
学习目标
3
1
新课引入
3
3
合作探究
3
5
典例精讲
6
归纳小结
3
8
课堂内容
达标检测
3
7
学习目标:
复习重难点:
1.知道物质是由分子、原子、离子构成的。
2.知道原子的结构和构成特点。
3.知道离子的结构特点,会写常见的离子符号。
4.能用微粒的观点解释生活中的现象。
5.知道元素组成物质,能从元素周期表获取有用信息。
1.知道离子的结构特点,会写常见的离子符号。
2.能从元素周期表获取有用信息。
知识框架:
物
质
构
成
的
奥
秘
原子的结构
分子和原子
元素
一.分子和原子
2.什么是分子?
分子是保持其化学性质的最小粒子
1.什么是原子?
原子是化学变化中的最小粒子
4、同种分子化学性质相同。
1、分子的质量和体积都很小;
3、分子在不断地运动;
2、分子之间有间隔;
3.分子、原子有哪些基本性质呢?
从分子的角度分析水的蒸发与水的分解两种变化的不同之处。
变化或现象 解 释
水的蒸发
水的分解
水蒸发是物理变化,水分子本身没有变化,变化的只是分子间的间隔。
水分解是化学变化,水分子变成了氢分子和氧分子。
交流与讨论
【典例精讲】
例1.(2020湖南衡阳)某同学从衡阳到西藏旅游,到达西藏后,发现从衡阳
带来的密封饼干包装袋鼓起了。包装袋鼓起的原因是( )
A.袋内饼干的体积变大
B.袋内气体分子的体积变大
C.袋内气体分子个数增多
D.袋内气体分子间的间隙变大
【解析】将方便面从衡阳带到西藏,西藏属于高原地区,气压低,故饼干包装
袋内气体分子间间隔变大,而饼干的体积、气体分子的体积和个数不会变化。故选D。
D
例2. (2021云南省卷)打开香水瓶盖闻到浓郁的香水气味,说明( )
A.分子在不停地运动 B.分子间有间隔
C.分子的体积很小 D.分子的质量很小
【典例精讲】
【答案】A
【解析】打开香水瓶盖闻到浓郁的香水气味,是因为分子是不断运动的,香水气味的分子运动到我们的鼻腔被我们感受到,所以有香水味,故选:A。
A
【典例精讲】
例3.(2021山西晋中)随着科技的进步,我们可通过扫描隧道显微
镜获得苯分子的图像。观察下图,有关苯分子的表述错误的是( )
A.它在不断运动 B.它体积很小
C.分子间有间隔 D.它真实存在
【答案】A
【解析】通过扫描隧道显微镜获得苯分子的图像,苯分子肉眼不可见,通过扫描隧道显微镜才能发现,说明它的体积很小,通过图像可以看出,分子之间存在间隔,能通过扫描隧道显微镜获得苯分子的图像,说明它真实存在,不能说明它在不断运动。故选A。
例2.(2021湖南长沙)防疫期间常用酒精消毒,在消毒过程中我们能闻到酒精散发出的特殊气味,主要是因为( )
A.分子的体积很小 B.分子间有间隔
C.分子在不断运动 D.分子可以再分
【答案】C
【解析】分子是在不断运动的,我们能闻到酒精散发出的特殊气味,主要是因为分子不断运动,向四周扩散,被人闻到;故选C。
C
【典例精讲】
二.原子的结构
原子
原子核
电 子
质子
中子
(不带电)
(+)
(-)
(+)
(不带电)
元素种类
决定
原子质量
最外层电子数决
定元素化学性质
排 布
分层
就近
限量
核电荷数=质子数=电子数
相对原子质量≈质子数+中子数
相对原子质量=
某元素一个原子的质量
一个碳原子质量的1/12
原子结构示意图
+11
2
8
1
Na
原子核
核内质子数
电子层
电子层上
的电子数
原子的构成规律
归纳总结
2、核电荷数 = 质子数 = 核外电子数
1、原子核所带的电荷数简称为核电荷数
3、原子中质子数不一定等于中子数
4、原子中不一定含有中子
5、不同种类的原子,其核内质子数和核外电子数都不相同
6、原子的质量主要集中在原子核上
归纳总结
构成物质的微粒:分子、原子、离子
由原子构成的物质:
稀有气体(He、 Ne 、 Ar 等)
金属 ( Fe、Mg、Zn等 )
一些固态非金属( Si、P等)
由分子构
成的物质:
一些常见的气体
(H 2O 、P2O5、HgO等)
(H2 、O2 、Cl2 、N2等)
(CO2、CO 、 SO2等)
其他物质
金属元素和非金属元素组成的物质(如:NaCl、等)
金属(铵根)和酸根离子组成的物质(KNO3)
由离子构
成的物质:
什么是离子?
离子也是构成物质的一种粒子。
归纳总结
离子是带电的原子或原子团。
1.定义
2.分类:
阳离子
带正电的原子,如Na+
阴离子
带负电的原子,如Cl-
3.离子符号的意义
表示每个镁离子带2个单位的正电荷
2Mg2+
表示2个镁离子
粒子种类 核内质子数与核外电子数的关系
原子(不带电)
阳离子(带正电)
阴离子(带负电)
核内质子数 = 核外电子数
核内质子数 > 核外电子数
核内质子数 < 核外电子数
原子和离子的联系和区别
原子
阳离子
阴离子
失电子
得电子
失电子
得电子
【典例精讲】
例4.(2021江苏省苏州高新区实验初级中学二模)下列对分子、原子和离
子的认识正确的是( )
A. 分子和原子在化学变化中都能够再分
B. 只有分子能保持物质的化学性质
C. 原子的质量主要集中在原子核上
D. 离子之间存在着相互作用,分子之间没有相互作用
【解析】A、分子在化学变化中能够再分,原子在化学变化中不能再分,错误;B、分子、原子、离子都能保持物质的化学性质,错误;C、原子的质量主要集中在原子核上,正确;D、离子、分子、原子之间都存在着相互作用,错误。故选C。
C
例5.(2021 江苏南京)下列粒子结构示意图中,表示阴离子的是( )
A B C D
【答案】A
【解析】A、质子数=9>核外电子数=10,为阴离子,正确;B、质子数=10,核外电子数=10,质子数=核外电子数,为原子,错误;C、质子数=11,核外电子数=10,质子数>核外电子数,为阳离子,错误;D、质子数=13>核外电子数=10,质子数>核外电子数,为阳离子,错误;故选A。
【典例精讲】
A
三.元 素
1.元素的概念
元素是 (即核电荷数)相同的一类原子的总称。
质子数
2.元素的化学性质
(1)元素的化学性质与其原子的核外电子排布,特别是______________________有关。
最外层电子的数目
(2)在化学变化时, 的种类不变, 也不变。
元素
原子
3.元素分类——目前已发现一百余种元素
元素
金属元素:
非金属元素:
汉字特点:带“钅”旁,“金”和“汞”例外
稀有气体元素:
“石” 固态非金属
“气” 气态非金属
“氵” 液态非金属
氦、氖、氩、氪、氙
4.元素与原子的区别与联系
元素 原子
定 义
不 同 点
相互关系
具有相同核电荷数的一类原子的总称
化学变化中的最小粒子
①只讲种类,不讲个数;
②是宏观的概念;
③只能组成物质,不能构成物质;
④化学变化中元素的种类和质量不变。
①既讲种类,又讲个数;
②是微观的概念;
③可直接构成物质,也可构成分子;
④化学变化中原子的种类、数目、质量都不变。
元素是具有相同核电荷数的一类原子的总称,
原子是元素的个体,是化学变化中的最小粒子。
5.元素与物质、微观粒子的关系
元素
质子数相同
的一类原子
金刚石、
汞等
分子
氧气、氢气等
离子
氯化钠等
结合
分解
聚集
得失电子
结合
原子
结合
6.元素符号
(1)书写:“一大二小”。
(2)元素符号的意义
①表示一种______;
②表示这种元素的一个______;
③对于由单个原子构成的单质,还表示这种______。
如Fe、Ar。
元素
原子
物质
7.元素周期表
(1)原子序数:元素周期表按原子________________的顺序给元素编的号。
(2)布局:7横行形成____个周期,18纵行形成____个族( 8、9、10三纵行组成一个族)。
(3)每一个元素占据一格,每一格均包含一种元素的___________________________________________________等内容。
核电荷数递增
7
16
原子序数、元素符号、元素名称、相对原子质量
原子序数=核电荷数=质子数=核外电子数
【典例精讲】
例6. (2021四川广安)加碘盐是在食盐中加入一定量的碘酸钾(K1O3),其中碘元素在周期表中的信息及碘原子的结构示意图如图所示,下列说法正确的是( )
A.碘元素是金属元素 B.碘原子的质子数是53
C.图中n的值为5 D.碘原子在反应中一般较易失去电子
B
【答案】B
【分析】
元素周期表信息图中,元素名称的左上角的数字为元素的原子序数,右上角为元素符号,中间的汉字表示元素名称,下边是元素的相对原子质量。
【解析】
A、由汉字结构可知,碘元素是非金属元素,错误;
B、原子中质子数=原子序数,故碘原子的质子数是53,正确;
C、原子中质子数=核外电子数,故55=2+8+18+18+n,n=7,错误;
D、碘原子最外层电子数为7,大于4,在反应中一般容易得到1个电子,错误。
故选B。
【典例精讲】
例5.(2021宁波市海曙外国语学校二模)2019是门捷列夫发现元素
周期表的150周年,被确定为“世界化学元素周期表年”,图1是元素周期表的部分内
容,图2是这三种元素的原子结构示意图。
(1)SeO2的相对分子质量为__________________。
(2)图2中硫原子的结构示意图是_____________。
(3)氧、硫、硒三种元素化学性质相似的原因是 。
(4)画出O2-离子的结构示意图是_____________。
。
111
B
最外层电子数相同
【解析】(1)SeO2的相对分子质量=79+16x2=111;
(2)硫原子的质子数为16,所以硫原子的结构示意图是B;
(3)元素的化学性质跟它的原子的最外层电子数目关系非常密切,
最外层电子数相同的元素化学性质相似,氧、硫、硒三种元素化学
性质相似的原因是它们的原子的最外层电子数相同;
(4)氧离子的核内质子数为8,带有2个单位的负电荷,核外有2个
电子层,第一层上有2个电子、第二层上有8个电子,其结构示意图
为:
1.完成配套练习册单元检测题;
2.预习课题1 爱护水资源。
【作业布置】
谢 谢!
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
