鲁教版(五四制)化学九年级全一册 4.2 金属的化学性质(课件)(17张PPT)
文档属性
| 名称 | 鲁教版(五四制)化学九年级全一册 4.2 金属的化学性质(课件)(17张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 241.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-09 15:38:24 | ||
图片预览





文档简介
(共17张PPT)
金属的化学性质
内容提要
金属与氧气的反应
1
金属与酸的反应
2
金属与盐溶液的反应
3
学习目标
1.认识镁、铝、铁、铜等常见金属与氧气的反应;
2.认识常见金属与盐酸、硫酸及某些盐溶液的置换反应,并能解释日常生活中的一些化学现象;
3.能说出常见金属的活动性顺序,并能利用该规律判断置换反应。
回顾与讨论:
请同学们回忆过去的学习中,我们了解了哪几种金属和氧气的反应?你还能回忆起这些反应的现象吗?
一、金属与氧气的反应
镁条和铝片在常温下就能和空气中的氧气反应
4Al+3O2=2Al2O3 2Mg+O2=2MgO
铁丝和铜片在高温时能与氧气反应:
金不能和氧气反应
综合上述信息可知:
1.大多数金属都能与_______反应,反应难易程度 ______。
2.金属的性质: _______ 较活泼,________次之, ____不活泼。
3Fe+2O2 Fe3O4
点燃
2Cu+O2 2CuO
△
Au+O2 →
×
Au
氧气
不相同
Al、Mg
Fe、Cu
资料:16世纪中叶,瑞士化学家帕拉塞斯和17世纪的一些化学家,都发现了有些金属和酸可以反应生成一种可燃性气体——氢气,并发现不同的金属反应的剧烈程度不同。
活动与探究:如何判断Fe、Cu、Al的活动性
二、金属与酸的反应
B组:在点滴板中分别放入铁片、铜片、铝片。然后,分别向其中加入一些稀硫酸。
A组:在点滴板中分别放入铁片、铜片、铝片。然后,分别向其中加入一些盐酸。
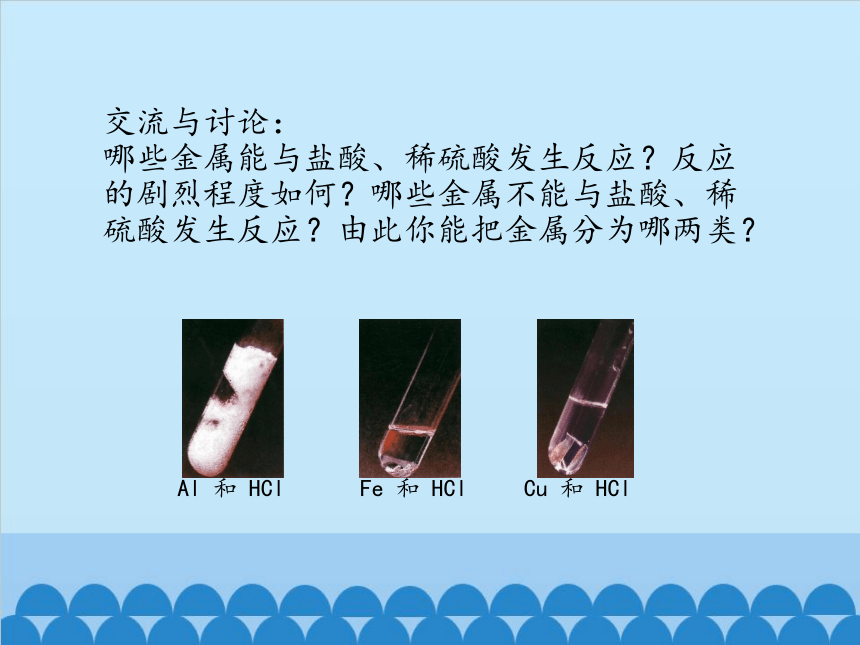
交流与讨论:
哪些金属能与盐酸、稀硫酸发生反应?反应的剧烈程度如何?哪些金属不能与盐酸、稀硫酸发生反应?由此你能把金属分为哪两类?
Fe 和 HCl
Al 和 HCl
Cu 和 HCl
反应物 反应现象 反应方程式
稀盐酸或稀硫酸 铝
铁
铜
2Al + 3H2SO4 = Al 2(SO4 )3 + 3H2 ↑
2Al+ 6HCl = 2AlCl3 + 3H2 ↑
Fe + H2SO4 = FeSO4 + H2 ↑
Fe + 2HCl = FeCl2 + H2 ↑
放出气泡最迅速,反应最剧烈
放出气泡速度缓慢,反应较为缓和
不反应
金属活动性由强到弱
Al Fe Cu
﹖
H
H
金属活动性顺序:
在金属活动性顺序中:
1、金属的位置越靠前,它的活动性越强。
2、位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
分析铁、铝与盐酸反应的化学方程式
由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应叫作置换反应。
2Al + 6HCl = 2AlCl3 + 3H2 ↑
Fe + 2HCl = FeCl2 + H2 ↑
单质 化合物 化合物 单质
置换反应
许多金属能与酸溶液反应,那么金属能否与盐溶液发生反应呢?
三、金属与盐溶液的反应
铁与硫酸铜溶液的反应
Fe+CuSO4 =Cu+ FeSO4
现象:铁钉的表面覆盖一层红色物质,溶液由蓝色变成浅绿色。
金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
铜与硝酸银溶液的反应
铜丝表面覆盖一层银白色物质,溶液由无色逐渐变为蓝色
Cu+2AgNO3 =2Ag+Cu(NO3)2
课堂小结
金属的化学性质
高温时:铁、铜
不与氧反应:金
常温下:镁、铝
金属活动性顺序
置换反应
镁/铝/锌/铁可反应,铜不能反应
金属活动性顺序的应用
活泼金属可把不活泼金属从它的盐溶液中置换出来
与酸反应
与氧气反应
与盐溶液反应
1.下列物质中,不能在氧气中燃烧的是( )
A.金箔 B.铁丝 C.木炭 D.氢气
2.遇稀盐酸不产生气体的是( )
A.铁片 B.铜片
C.铝片 D.镁条
知能训练
B
A
3.下列化学变化属于置换反应的有:
(1)CO+Fe2O3→Fe+CO2
(2)C+Fe2O3 → Fe+CO2
(3)H2O2 → H2O+O2
(4)Fe+AgNO3 → Fe(NO3)2+Ag
解答:(2)(4)
4.X、Y、Z是三种金属,根据下列有关化学方程式可知,三种金属的活动性顺序是( )
①Z + YSO4 = ZSO4+ Y ②X + YSO4 = XSO4+ Y
③X + H2SO4 = XSO4+ H2 ↑
④Z + H2SO4不反应
A. Z>X>Y B. Z>Y>X
C. X>Y>Z D. X>Z>Y
D
谢 谢
金属的化学性质
内容提要
金属与氧气的反应
1
金属与酸的反应
2
金属与盐溶液的反应
3
学习目标
1.认识镁、铝、铁、铜等常见金属与氧气的反应;
2.认识常见金属与盐酸、硫酸及某些盐溶液的置换反应,并能解释日常生活中的一些化学现象;
3.能说出常见金属的活动性顺序,并能利用该规律判断置换反应。
回顾与讨论:
请同学们回忆过去的学习中,我们了解了哪几种金属和氧气的反应?你还能回忆起这些反应的现象吗?
一、金属与氧气的反应
镁条和铝片在常温下就能和空气中的氧气反应
4Al+3O2=2Al2O3 2Mg+O2=2MgO
铁丝和铜片在高温时能与氧气反应:
金不能和氧气反应
综合上述信息可知:
1.大多数金属都能与_______反应,反应难易程度 ______。
2.金属的性质: _______ 较活泼,________次之, ____不活泼。
3Fe+2O2 Fe3O4
点燃
2Cu+O2 2CuO
△
Au+O2 →
×
Au
氧气
不相同
Al、Mg
Fe、Cu
资料:16世纪中叶,瑞士化学家帕拉塞斯和17世纪的一些化学家,都发现了有些金属和酸可以反应生成一种可燃性气体——氢气,并发现不同的金属反应的剧烈程度不同。
活动与探究:如何判断Fe、Cu、Al的活动性
二、金属与酸的反应
B组:在点滴板中分别放入铁片、铜片、铝片。然后,分别向其中加入一些稀硫酸。
A组:在点滴板中分别放入铁片、铜片、铝片。然后,分别向其中加入一些盐酸。
交流与讨论:
哪些金属能与盐酸、稀硫酸发生反应?反应的剧烈程度如何?哪些金属不能与盐酸、稀硫酸发生反应?由此你能把金属分为哪两类?
Fe 和 HCl
Al 和 HCl
Cu 和 HCl
反应物 反应现象 反应方程式
稀盐酸或稀硫酸 铝
铁
铜
2Al + 3H2SO4 = Al 2(SO4 )3 + 3H2 ↑
2Al+ 6HCl = 2AlCl3 + 3H2 ↑
Fe + H2SO4 = FeSO4 + H2 ↑
Fe + 2HCl = FeCl2 + H2 ↑
放出气泡最迅速,反应最剧烈
放出气泡速度缓慢,反应较为缓和
不反应
金属活动性由强到弱
Al Fe Cu
﹖
H
H
金属活动性顺序:
在金属活动性顺序中:
1、金属的位置越靠前,它的活动性越强。
2、位于氢前面的金属能置换出盐酸、稀硫酸中的氢。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
分析铁、铝与盐酸反应的化学方程式
由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应叫作置换反应。
2Al + 6HCl = 2AlCl3 + 3H2 ↑
Fe + 2HCl = FeCl2 + H2 ↑
单质 化合物 化合物 单质
置换反应
许多金属能与酸溶液反应,那么金属能否与盐溶液发生反应呢?
三、金属与盐溶液的反应
铁与硫酸铜溶液的反应
Fe+CuSO4 =Cu+ FeSO4
现象:铁钉的表面覆盖一层红色物质,溶液由蓝色变成浅绿色。
金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。
铜与硝酸银溶液的反应
铜丝表面覆盖一层银白色物质,溶液由无色逐渐变为蓝色
Cu+2AgNO3 =2Ag+Cu(NO3)2
课堂小结
金属的化学性质
高温时:铁、铜
不与氧反应:金
常温下:镁、铝
金属活动性顺序
置换反应
镁/铝/锌/铁可反应,铜不能反应
金属活动性顺序的应用
活泼金属可把不活泼金属从它的盐溶液中置换出来
与酸反应
与氧气反应
与盐溶液反应
1.下列物质中,不能在氧气中燃烧的是( )
A.金箔 B.铁丝 C.木炭 D.氢气
2.遇稀盐酸不产生气体的是( )
A.铁片 B.铜片
C.铝片 D.镁条
知能训练
B
A
3.下列化学变化属于置换反应的有:
(1)CO+Fe2O3→Fe+CO2
(2)C+Fe2O3 → Fe+CO2
(3)H2O2 → H2O+O2
(4)Fe+AgNO3 → Fe(NO3)2+Ag
解答:(2)(4)
4.X、Y、Z是三种金属,根据下列有关化学方程式可知,三种金属的活动性顺序是( )
①Z + YSO4 = ZSO4+ Y ②X + YSO4 = XSO4+ Y
③X + H2SO4 = XSO4+ H2 ↑
④Z + H2SO4不反应
A. Z>X>Y B. Z>Y>X
C. X>Y>Z D. X>Z>Y
D
谢 谢
同课章节目录
- 第一单元 溶液
- 1 溶液的形成
- 2 溶液组成的定量表示
- 3物质的溶解性
- 到实验室去:配制一定溶质质量分数的溶液
- 第二单元 常见的酸和碱
- 1 酸及其性质
- 2 碱及其性质
- 3 溶液的酸碱性
- 4 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 到图书馆去:分子变成离子
- 第三单元 海水中的化学
- 1 海洋化学资源
- 2 海水“晒盐”
- 3 海水“制碱”
- 到实验室去:粗盐中难溶性杂质的去除
- 第四单元 金属
- 1 常见的金属材料
- 2 金属的化学性质
- 3 钢铁的锈蚀与防护
- 到实验室去:探究金属的性质
- 第五单元 化学与健康
- 1 食物中的有机物
- 2 化学元素与人体健康
- 3 远离有毒物质
- 第六单元 化学与社会发展
- 1 化学与能源开发
- 2 化学与材料研制
- 3 化学与农业生产
- 4 化学与环境保护
