物质的量浓度的配置
图片预览








文档简介
(共22张PPT)
第二节
——化学计量在实验中的应用
都是高锰酸钾溶液,为什么颜色不
同呢
因为浓度不同
溶质的质量分数
溶质的质量分数=
溶质的质量
溶液的质量
×100%
一、物质的量浓度
定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度
符号:C(B)
单位: mol / L
表达式:C(B)=
n(B)
v
课堂练习
用5molNaOH配成500mL溶液,其浓度为 mol/L
从1L 1mol/L NaCl溶液中,分别取出100mL、10mL和1mL溶液,它们的物质的量浓度是否相等?
10
容量瓶
1. 结构:
2. 特点:
3. 注意事项:
②溶解或稀释的操作不能在容量瓶中进行
③不能长期存放溶液或进行化学反应
细颈、平底玻璃瓶,瓶口配有磨口玻璃塞或
塑料塞
①容量瓶上标有温度和容积
②容量瓶上有刻度线而无刻度
①使用前要检查是否漏水
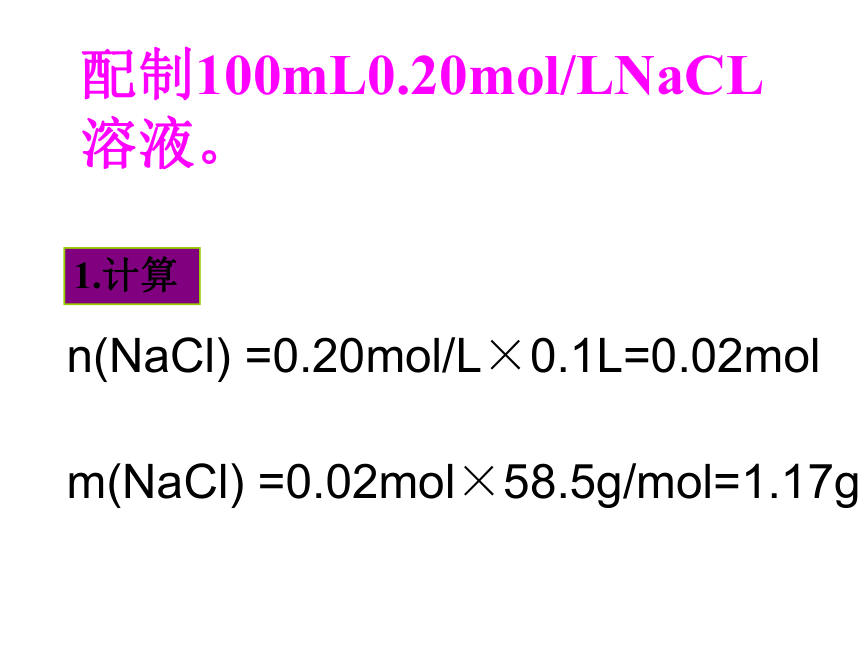
配制100mL0.20mol/LNaCL溶液。
n(NaCl) =0.20mol/L×0.1L=0.02mol
m(NaCl) =0.02mol×58.5g/mol=1.17g
1.计算
注意事项:
(1)使用前要调零
(2)两个托盘上各放一张大小相同的称量纸
(3)称量时遵循左物右码的原则
(4)用镊子夹取砝码应按照从大到小的顺序
(5)称量完毕应将砝码放回盒中,游码归零
思考:NaOH能否直接放在称量纸上称量?为什么?应如何
操作?
2.称量
1. 溶解要在烧杯中进行
2.朝一个方向搅拌,不要碰到烧杯壁
3. 溶解过程中,不要把 玻璃棒放在实验台上
4. 溶解时,加水不能过 多,一般在所配溶液 体积的1/3
3.溶解
1. 溶液要先冷却至 室温
2. 要用玻璃棒引流
4.转移
1. 遵循少量多次原则
2. 洗涤液要转入容量瓶中
5.洗涤
1. 先向容量瓶中加水到刻度线以下1~2cm 处,后改用滴管滴加至刻度线。
2. 视线与液体的凹液面相切
6.定容
手要拿稳, 反复倒转
7.摇匀
容量瓶中不能存放溶液,因此要把配制好的溶液转移到试剂瓶
中,贴好标签,注明溶液的名称和浓度。
8.装瓶贴签
讨论
在配制溶液中哪些操作可能引起溶液浓度的误差?
1)定容时仰视刻度
2)定容后发现液面高于刻度线后,用滴 管吸出少量溶液
3)未洗涤溶解用的玻璃棒和烧杯
有关溶液稀释和浓缩的计算
结论:浓溶液配制稀溶液前后
C1V1= C2V2
随堂检测
欲配制1mol/L的氢氧化钠溶液250mL, 完成下列步骤:
① 用天平称取氢氧化钠固体____g。
② 将称好氢氧化钠固体放入_____中加_____ 蒸馏水将其溶解,待_____后,将溶液沿 _______移入_______的容量瓶中。
③用少量蒸馏水洗涤烧杯壁____次,并将每 次洗涤后的溶液都注入______中,轻轻振 荡容量瓶使溶液充分混合。在操作过程中 不能损失点滴液体,否则会使溶液的浓度 偏___(低或高)。
10
烧杯
少量
冷却
玻璃棒
250mL
2-3
容量瓶
低
第二节
——化学计量在实验中的应用
都是高锰酸钾溶液,为什么颜色不
同呢
因为浓度不同
溶质的质量分数
溶质的质量分数=
溶质的质量
溶液的质量
×100%
一、物质的量浓度
定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的量浓度
符号:C(B)
单位: mol / L
表达式:C(B)=
n(B)
v
课堂练习
用5molNaOH配成500mL溶液,其浓度为 mol/L
从1L 1mol/L NaCl溶液中,分别取出100mL、10mL和1mL溶液,它们的物质的量浓度是否相等?
10
容量瓶
1. 结构:
2. 特点:
3. 注意事项:
②溶解或稀释的操作不能在容量瓶中进行
③不能长期存放溶液或进行化学反应
细颈、平底玻璃瓶,瓶口配有磨口玻璃塞或
塑料塞
①容量瓶上标有温度和容积
②容量瓶上有刻度线而无刻度
①使用前要检查是否漏水
配制100mL0.20mol/LNaCL溶液。
n(NaCl) =0.20mol/L×0.1L=0.02mol
m(NaCl) =0.02mol×58.5g/mol=1.17g
1.计算
注意事项:
(1)使用前要调零
(2)两个托盘上各放一张大小相同的称量纸
(3)称量时遵循左物右码的原则
(4)用镊子夹取砝码应按照从大到小的顺序
(5)称量完毕应将砝码放回盒中,游码归零
思考:NaOH能否直接放在称量纸上称量?为什么?应如何
操作?
2.称量
1. 溶解要在烧杯中进行
2.朝一个方向搅拌,不要碰到烧杯壁
3. 溶解过程中,不要把 玻璃棒放在实验台上
4. 溶解时,加水不能过 多,一般在所配溶液 体积的1/3
3.溶解
1. 溶液要先冷却至 室温
2. 要用玻璃棒引流
4.转移
1. 遵循少量多次原则
2. 洗涤液要转入容量瓶中
5.洗涤
1. 先向容量瓶中加水到刻度线以下1~2cm 处,后改用滴管滴加至刻度线。
2. 视线与液体的凹液面相切
6.定容
手要拿稳, 反复倒转
7.摇匀
容量瓶中不能存放溶液,因此要把配制好的溶液转移到试剂瓶
中,贴好标签,注明溶液的名称和浓度。
8.装瓶贴签
讨论
在配制溶液中哪些操作可能引起溶液浓度的误差?
1)定容时仰视刻度
2)定容后发现液面高于刻度线后,用滴 管吸出少量溶液
3)未洗涤溶解用的玻璃棒和烧杯
有关溶液稀释和浓缩的计算
结论:浓溶液配制稀溶液前后
C1V1= C2V2
随堂检测
欲配制1mol/L的氢氧化钠溶液250mL, 完成下列步骤:
① 用天平称取氢氧化钠固体____g。
② 将称好氢氧化钠固体放入_____中加_____ 蒸馏水将其溶解,待_____后,将溶液沿 _______移入_______的容量瓶中。
③用少量蒸馏水洗涤烧杯壁____次,并将每 次洗涤后的溶液都注入______中,轻轻振 荡容量瓶使溶液充分混合。在操作过程中 不能损失点滴液体,否则会使溶液的浓度 偏___(低或高)。
10
烧杯
少量
冷却
玻璃棒
250mL
2-3
容量瓶
低
