《苯的结构和性质》上课)
图片预览







文档简介
(共26张PPT)
第二单元 芳香烃
苯的结构与性质
芳香烃:
含有苯环的碳氢化合物
苯是结构最简单的芳香烃
一、苯的物理性质及用途
苯是一种无色、有特殊气味的液体,密度比水小,不溶于水,是重要的有机溶剂。熔点5.5℃,苯的沸点80.1 ℃,易挥发。
有毒,对人的神经系统、造血系统有伤害,甚至导致白血病。
危害:
用途:
苯主要运用于染料工业,是农药生产及香料制作的原料,苯作为溶剂和粘合剂运用于造漆、喷漆、制药、制鞋及家具制造业等。
苯的发现史
苯是在1825年由英国科学家法拉第首先发现的。他用蒸馏的方法将煤气灯中剩余的油状液体进行分离,得到一种新的液体,它实际上就是苯。当时法拉第将这种液体称为“氢的重碳化合物”。
法国化学家日拉尔等人又通过实验确定了苯的相对分子质量为78,分子式为C6H6。苯分子中碳的相对含量如此之高,使化学家们感到惊讶。如何确定它的结构式呢?
德国化学家凯库勒对苯的结构进行了大量的实验分析之后认为:这是一个很稳定的“核”,6个碳原子之间的结合非常牢固,而且排列十分紧凑。凯库勒在提出了多种开链式结构,但又因其与实验结果不符而一一否定。1865年他终于悟出闭合链的形式是解决苯分子结构的关键,最后他终于成功的提出了苯的结构,也就是我们现在所说的凯库勒式。
二、苯的结构探究
C6H6
分子式
苯分子中是否存在碳碳单键、碳碳双键交替结构呢?
你能写出C6H6的可能具有的结构么?
1. CH≡C-CH2-CH2-C≡CH
2. CH3-C≡C-C≡C-CH3
3. CH2=CH-CH=CH-C≡ CH
4. HC≡C-CH2-CH2-C≡CH
5 ……
二、苯的结构探究
苯不能像烯烃那样使酸性KMnO4溶液褪色,也不能通过化学反应使溴水褪色。
1、用实验事实说明
往酸性KMnO4溶液中加入苯:
往溴水中加入苯:
上层无色,下层紫红色
上层橙红色,下层无色
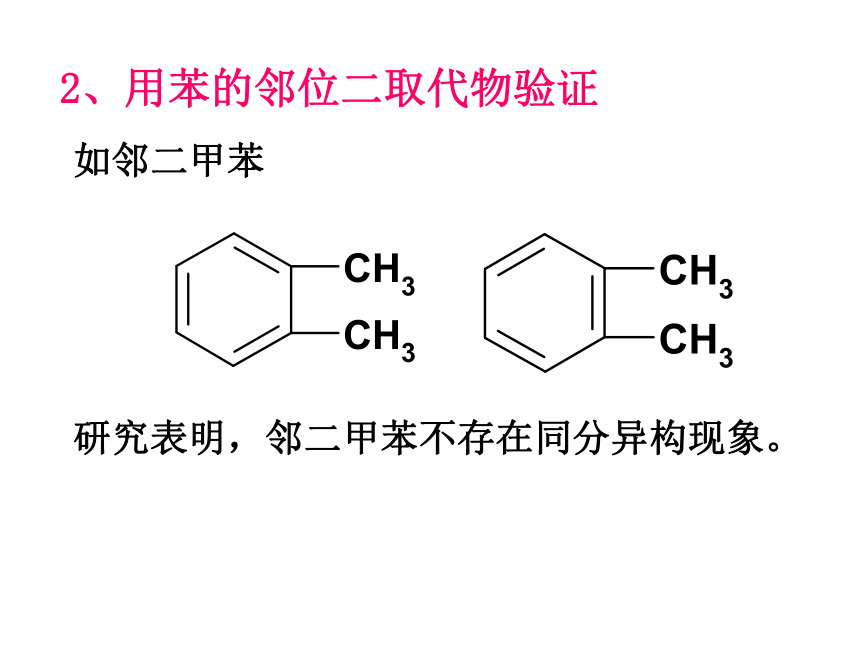
2、用苯的邻位二取代物验证
研究表明,邻二甲苯不存在同分异构现象。
如邻二甲苯
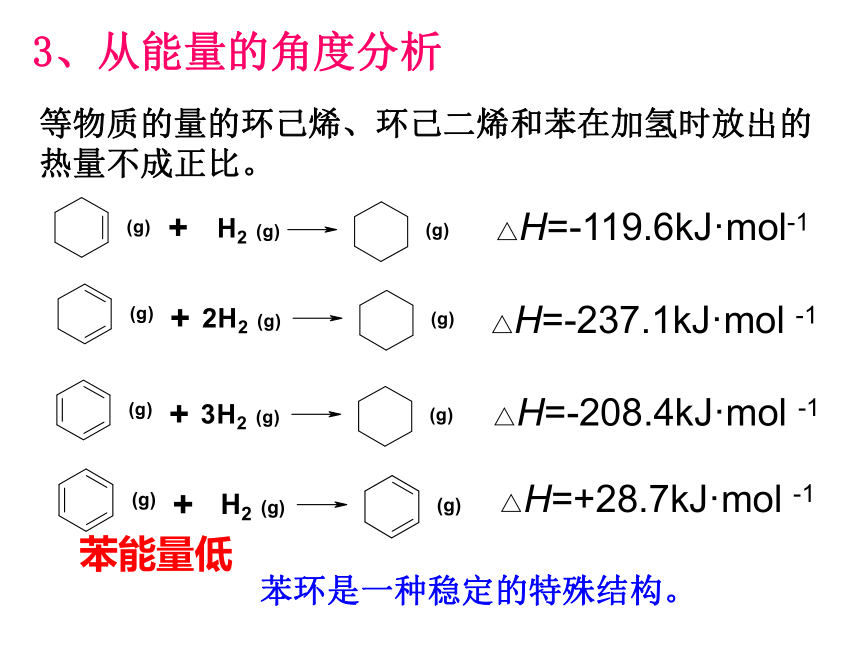
等物质的量的环己烯、环己二烯和苯在加氢时放出的热量不成正比。
3、从能量的角度分析
苯环是一种稳定的特殊结构。
△H=-119.6kJ·mol-1
△H=-237.1kJ·mol -1
△H=-208.4kJ·mol -1
△H=+28.7kJ·mol -1
苯能量低
4、从键长的角度分析
碳碳单键键长:1.54×10-10m
碳碳双键键长:1.34×10-10m
苯分子中碳碳键长都相等,为1.40×10-10m
苯分子中的碳碳键是介于碳碳单键和碳碳双键之间的特殊的键。
苯分子中6个碳原子和6个氢原子都处于同一平面上,为平面正六边形,键角为120 。
三、苯的化学性质:
苯不能使KMnO4(H+)
溶液褪色,能与溴水发生萃取。
1、可燃
2C6H6 +15 O2 → 12CO2 + 6H2O
点燃
现象:火焰明亮,冒浓烟
(含碳量等于乙炔)
苯与液溴的反应探究
冷凝回流、导气
吸收检验HBr
吸收HBr,防止污染环境
除去溶解在溴苯中的液溴,以提纯溴苯
防止倒吸
现象:
1 向三颈烧瓶中加入苯和液溴后,反应迅速进行,溶液几乎“沸腾”,一段时间后反应停止
2 反应结束后,三颈烧瓶底部出现红褐色油状液体(溴苯)
3 锥形瓶内有白雾,向锥形瓶中加入AgNO3溶液,出现浅黄色沉淀
4 向三颈烧瓶中加入NaOH溶液,产生红褐色沉淀(Fe(OH)3)
注意:
1 纯净的溴苯应为无色,为什么反应制得的溴苯为褐色——溴苯中溶解的溴单质
2 最后产生的红褐色沉淀是什么——Fe(OH)3沉淀,反应中真正起催化作用的是FeBr3
—Br
+HBr
+Br2
FeBr3
溴苯:无色油状液体,密度大于水
如何除去溴苯中混有的溴?
溴苯为无色液体,密度比水大,不
溶于水,易溶于有机溶剂,实验中溴苯
中溶解了溴显褐色,除溴苯中的溴用
NaOH溶液洗涤分液.
注意事项:
1、必须用液溴,不可用溴水
2、必须用铁粉作催化剂,但实际催化
作用的是FeBr3
3、苯、溴、Fe屑等试剂加入烧瓶的
顺序是
苯 液溴 Fe屑
4、锥形瓶中导管末端不插入液面以下,
防HBr倒吸
5.在三卤化铁作催化剂时,苯与氯气、溴单质可发生取代反应,生成一卤代苯、二卤代苯等。生成二卤代苯主要是邻位和对位取代产物
(2)苯的硝化反应
苯与浓硫酸和浓硝酸的混合物共热到
60℃
现象:将反应后的
混合液倒入冷水中,
杯底有浅黄色油状
不溶物,并能闻到
苦杏仁味
+ HNO3
浓H2SO4
60℃
NO2
+ H2O
硝基苯
纯硝基苯为无色有苦杏仁气味的油状
液体,有毒,密度大于水,不溶于水,实
验制得的硝基苯因混有硝酸分解的NO2常
为淡黄色,为提纯硝基苯,一般将粗产
品依次用蒸馏水和NaOH溶液洗涤,分液。
硝化反应:烃分子中的H原子被硝基取
代的反应。
硝基:-NO2(注意与NO2、NO2- 区别)
注意事项:
1、滴加酸的顺序是:先加浓硝酸再加浓硫酸,冷却到50℃以下,在不断振荡下逐滴加入苯。因为反应放热,温度过高,苯易挥发,且硝酸也会分解。苯和浓硫酸在70~80℃时会发生反应。
2、反应中浓硫酸的作用是:催化剂、
吸水剂
3、使用水浴加热的目的:受热均匀,
容易控制温度。温度计水银球的位置,
必须悬挂在水浴中。
4、长玻璃导管的作用:导气兼冷凝回流;
(3)苯的磺化反应:
+ HO-SO3H
70℃~80℃
SO3H
+ H2O
苯磺酸易溶于水的一元酸
5.苯与浓硝酸、浓硫酸的混合物在60℃时生成一取代产物硝基苯,当温度升高至100℃~110℃时则生成二取代产物间二硝基苯
3、特定条件下,苯的加成反应
苯不具有典型双键的加成反应性能,
不能使溴水褪色。但特殊情况下可以
发生加成反应。
+ 3H2
催化剂
(环己烷,无色液体)
苯与氯气在紫外线照下可加成:
Cl
H
H
Cl
Cl
Cl
Cl
Cl
H
H
H
H
+ 3Cl2
光
苯的性质特点小结:易取代、
难加成、难氧化
四、苯的用途:
合成纤维、合成橡胶、塑料、农药、医药、染料、香料等。苯也常用于有机溶剂
苯常从煤焦油中取得,大量的苯可从
石油工业获得。
第二单元 芳香烃
苯的结构与性质
芳香烃:
含有苯环的碳氢化合物
苯是结构最简单的芳香烃
一、苯的物理性质及用途
苯是一种无色、有特殊气味的液体,密度比水小,不溶于水,是重要的有机溶剂。熔点5.5℃,苯的沸点80.1 ℃,易挥发。
有毒,对人的神经系统、造血系统有伤害,甚至导致白血病。
危害:
用途:
苯主要运用于染料工业,是农药生产及香料制作的原料,苯作为溶剂和粘合剂运用于造漆、喷漆、制药、制鞋及家具制造业等。
苯的发现史
苯是在1825年由英国科学家法拉第首先发现的。他用蒸馏的方法将煤气灯中剩余的油状液体进行分离,得到一种新的液体,它实际上就是苯。当时法拉第将这种液体称为“氢的重碳化合物”。
法国化学家日拉尔等人又通过实验确定了苯的相对分子质量为78,分子式为C6H6。苯分子中碳的相对含量如此之高,使化学家们感到惊讶。如何确定它的结构式呢?
德国化学家凯库勒对苯的结构进行了大量的实验分析之后认为:这是一个很稳定的“核”,6个碳原子之间的结合非常牢固,而且排列十分紧凑。凯库勒在提出了多种开链式结构,但又因其与实验结果不符而一一否定。1865年他终于悟出闭合链的形式是解决苯分子结构的关键,最后他终于成功的提出了苯的结构,也就是我们现在所说的凯库勒式。
二、苯的结构探究
C6H6
分子式
苯分子中是否存在碳碳单键、碳碳双键交替结构呢?
你能写出C6H6的可能具有的结构么?
1. CH≡C-CH2-CH2-C≡CH
2. CH3-C≡C-C≡C-CH3
3. CH2=CH-CH=CH-C≡ CH
4. HC≡C-CH2-CH2-C≡CH
5 ……
二、苯的结构探究
苯不能像烯烃那样使酸性KMnO4溶液褪色,也不能通过化学反应使溴水褪色。
1、用实验事实说明
往酸性KMnO4溶液中加入苯:
往溴水中加入苯:
上层无色,下层紫红色
上层橙红色,下层无色
2、用苯的邻位二取代物验证
研究表明,邻二甲苯不存在同分异构现象。
如邻二甲苯
等物质的量的环己烯、环己二烯和苯在加氢时放出的热量不成正比。
3、从能量的角度分析
苯环是一种稳定的特殊结构。
△H=-119.6kJ·mol-1
△H=-237.1kJ·mol -1
△H=-208.4kJ·mol -1
△H=+28.7kJ·mol -1
苯能量低
4、从键长的角度分析
碳碳单键键长:1.54×10-10m
碳碳双键键长:1.34×10-10m
苯分子中碳碳键长都相等,为1.40×10-10m
苯分子中的碳碳键是介于碳碳单键和碳碳双键之间的特殊的键。
苯分子中6个碳原子和6个氢原子都处于同一平面上,为平面正六边形,键角为120 。
三、苯的化学性质:
苯不能使KMnO4(H+)
溶液褪色,能与溴水发生萃取。
1、可燃
2C6H6 +15 O2 → 12CO2 + 6H2O
点燃
现象:火焰明亮,冒浓烟
(含碳量等于乙炔)
苯与液溴的反应探究
冷凝回流、导气
吸收检验HBr
吸收HBr,防止污染环境
除去溶解在溴苯中的液溴,以提纯溴苯
防止倒吸
现象:
1 向三颈烧瓶中加入苯和液溴后,反应迅速进行,溶液几乎“沸腾”,一段时间后反应停止
2 反应结束后,三颈烧瓶底部出现红褐色油状液体(溴苯)
3 锥形瓶内有白雾,向锥形瓶中加入AgNO3溶液,出现浅黄色沉淀
4 向三颈烧瓶中加入NaOH溶液,产生红褐色沉淀(Fe(OH)3)
注意:
1 纯净的溴苯应为无色,为什么反应制得的溴苯为褐色——溴苯中溶解的溴单质
2 最后产生的红褐色沉淀是什么——Fe(OH)3沉淀,反应中真正起催化作用的是FeBr3
—Br
+HBr
+Br2
FeBr3
溴苯:无色油状液体,密度大于水
如何除去溴苯中混有的溴?
溴苯为无色液体,密度比水大,不
溶于水,易溶于有机溶剂,实验中溴苯
中溶解了溴显褐色,除溴苯中的溴用
NaOH溶液洗涤分液.
注意事项:
1、必须用液溴,不可用溴水
2、必须用铁粉作催化剂,但实际催化
作用的是FeBr3
3、苯、溴、Fe屑等试剂加入烧瓶的
顺序是
苯 液溴 Fe屑
4、锥形瓶中导管末端不插入液面以下,
防HBr倒吸
5.在三卤化铁作催化剂时,苯与氯气、溴单质可发生取代反应,生成一卤代苯、二卤代苯等。生成二卤代苯主要是邻位和对位取代产物
(2)苯的硝化反应
苯与浓硫酸和浓硝酸的混合物共热到
60℃
现象:将反应后的
混合液倒入冷水中,
杯底有浅黄色油状
不溶物,并能闻到
苦杏仁味
+ HNO3
浓H2SO4
60℃
NO2
+ H2O
硝基苯
纯硝基苯为无色有苦杏仁气味的油状
液体,有毒,密度大于水,不溶于水,实
验制得的硝基苯因混有硝酸分解的NO2常
为淡黄色,为提纯硝基苯,一般将粗产
品依次用蒸馏水和NaOH溶液洗涤,分液。
硝化反应:烃分子中的H原子被硝基取
代的反应。
硝基:-NO2(注意与NO2、NO2- 区别)
注意事项:
1、滴加酸的顺序是:先加浓硝酸再加浓硫酸,冷却到50℃以下,在不断振荡下逐滴加入苯。因为反应放热,温度过高,苯易挥发,且硝酸也会分解。苯和浓硫酸在70~80℃时会发生反应。
2、反应中浓硫酸的作用是:催化剂、
吸水剂
3、使用水浴加热的目的:受热均匀,
容易控制温度。温度计水银球的位置,
必须悬挂在水浴中。
4、长玻璃导管的作用:导气兼冷凝回流;
(3)苯的磺化反应:
+ HO-SO3H
70℃~80℃
SO3H
+ H2O
苯磺酸易溶于水的一元酸
5.苯与浓硝酸、浓硫酸的混合物在60℃时生成一取代产物硝基苯,当温度升高至100℃~110℃时则生成二取代产物间二硝基苯
3、特定条件下,苯的加成反应
苯不具有典型双键的加成反应性能,
不能使溴水褪色。但特殊情况下可以
发生加成反应。
+ 3H2
催化剂
(环己烷,无色液体)
苯与氯气在紫外线照下可加成:
Cl
H
H
Cl
Cl
Cl
Cl
Cl
H
H
H
H
+ 3Cl2
光
苯的性质特点小结:易取代、
难加成、难氧化
四、苯的用途:
合成纤维、合成橡胶、塑料、农药、医药、染料、香料等。苯也常用于有机溶剂
苯常从煤焦油中取得,大量的苯可从
石油工业获得。
