第二章 化学物质及其变化 第一节 物质的分类含课时训练
文档属性
| 名称 | 第二章 化学物质及其变化 第一节 物质的分类含课时训练 |  | |
| 格式 | zip | ||
| 文件大小 | 67.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-19 14:36:09 | ||
图片预览



文档简介
第二章 化学物质及其变化
第一节 物质的分类
【三维目标】
知识与技能:熟练地写出中学常见各种物质的化学式
清楚地知道每种物质的归类(酸、碱或盐)
掌握溶液、胶体和浊液这三种分散系的划分依据和鉴别
了解分散系的概念;了解胶体的概念;了解胶体的性质;了解胶体的实际应用。
掌握胶体与溶液,悬浊液,乳浊液的区别;掌握胶体的精制方法;理解丁达尔效应。
过程与方法:了解分类是进行化学学习和研究的重要方法
了解分类的方法:交叉分类法和树状分类法
学会用树状分类法逐步将自己所学的知识系统化、条理化、归纳化
培养学生的思维能力和自学能力
情感态度与价值:掌握辩证唯物主义一分为二和具体问题具体分析的观点,领会透过现象看本质的哲学思想
通过探究溶液、胶体、浊液本质,发展学习化学的兴趣与热情
培养学生严肃认真、一丝不苟勇于探索的科学态度
【重点难点】胶体的有关概念;学生实验能力、思维能力、自学能力的培养
了解常见化学物质及其变化的分类方法
掌握胶体与溶液,悬浊液,乳浊液的区别
【教学方法】情景创设、实验、引导学生归纳、总结、自学
简单分类法及其应用(第1课时)
【教学过程】
【新课导入】
图书馆或图书大厦里有许多的书籍,为什么你能够很快就找到你所需要的书?大超市里有成千上万种商品,为什么你能够迅速挑出你所需要的商品?
【推进新课】
分类是把某些特征相似的物体归类到一起的方法,它也是学习和研究化学物质及其变化的一种常用科学方法。运用分类的方法不仅能使有关化学物质及其变化的知识系统化,还可以通过分门别类的研究,发现物质及其变化的规律。现在我们开始学习物质的分类。
【过渡】实际上科学家早就按照物质的某些“特征”“属性”对化学物质以及他们所发生的化学反应进行了分类。
【板书】第一节 物质的分类
简单分类法及应用
【练习】
1 将下列元素进行分类
H He O Na Si Fe Ar Ba I Pb Ba Pb
非金属元素有
金属元素有
2 将下列物质进行分类,将其序号填在相应的空白处
①空气 ②液氯 ③啤酒 ④泥浆水 ⑤铁粉 ⑥硫酸 ⑦碘的四氯化碳溶液 ⑧氢氧化钠 ⑨氯化钠晶体 ⑩二氧化碳
混合物有
纯净物有
3 将下列化学反应进行分类,将其序号填入题后的横线上
①硫在氧气里的燃烧 ②红磷在氧气里的燃烧 ③铁丝在氧气里的燃烧 ④铝箔在氧气里的燃烧 ⑤蜡烛在氧气里的燃烧
化合反应有
非金属与氧气反应的有
金属与氧气反应的有
【问题】1、在初中化学课上曾经学习过哪些有关物质分类的概念?请大家先独立思考,然后交流。
2、纯净物Na2CO3,从其组成的阳离子来看,它属于什么盐?从阴离子来看,又属于什么盐?
【归纳总结】
1.将事物进行分类时,按照不同的分类标准进行分类会产生不同的分类结果。
2.在认识事物时,运用多种分类方法,可以弥补单一分类方法的不足。交叉分类法就是这种思想的体现。
3.对同类事物可以通过树状分类法进行再分类。
【板书】1、物质的分类
(1)交叉分类法
Na2CO3 钠盐
Na2SO4 钾盐
K2SO4 硫酸盐
K2CO3 碳酸盐
【思考与交流】
1.对于化学物质,如果按照所含物质种类的多少,可以怎样分类?
2.对于化合物我们按照不同的分类标准进行分类可以产生哪些分类结果?
【归纳与整理】
【板书】(2)树状分类法
【实践与探究】
1、选择熟悉的物质,制作一张交叉分类图。
提示:氧化物、酸、碱、盐等还可以按照不同的标准进一步进行分类,化合物也可以分为无机化合物和有机化合物等。
【思考与交流】
1.在初中我们学习过四种基本化学反应类型,它们是按照什么标准进行分类的?将化学反应又可以按照哪些不同的标准进行分类呢?
【归纳与整理】
【板书】2.化学反应的分类:
【思考与交流】
初中所学习的化学反应四种基本类型能概括所有的化学反应吗?我们应当用什么样的态度对待对已学知识?
【实践与探究】
根据物质的组成和性质,可以将化学物质分成哪几类?每类物质具有哪些主要的化学性质?你的这种分类采取了哪种分类方法?
【归纳与整理】
【小结反思】
1.分类法是一种行之有效、简单易行的科学方法。运用分类的方法不仅能使有关化学物质及其变化的知识系统化,还可以通过分门别类的研究,发现物质及其变化的规律。
2.在认识事物时,运用多种分类方法,可以弥补单一分类方法的不足。交叉分类法和树状分类法是化学分类中常用的两种分类方法。
【作业布置】课时作业(六)
【板书设计】
物质的分类
物质分类法及其应用
物质分类
(1)交叉分类
(2)树状分类
2、化学反应分类
【达标练习】
1.下列物质属于金属单质的是 [ ]
A.氖气 B.汞
C.氯化锌 D.碘
2.某药品说明书中标明:本品每克含碘150mg,镁65mg,锌1.5mg,锰1mg,这里的碘、镁、锌、锰是指 [ ]
A.分子 B.原子 C.元素 D.物质
3.氮气、铁、镁、硫、水、三氧化二铝、碳酸氢铵、氯酸钾等8种物质,请用化学式填写下列问题:
(1)属于金属单质的有______;
(2)属于非金属单质的是______;
(3)属于化合物的是______;
(4)其中属于氧化物的有______。
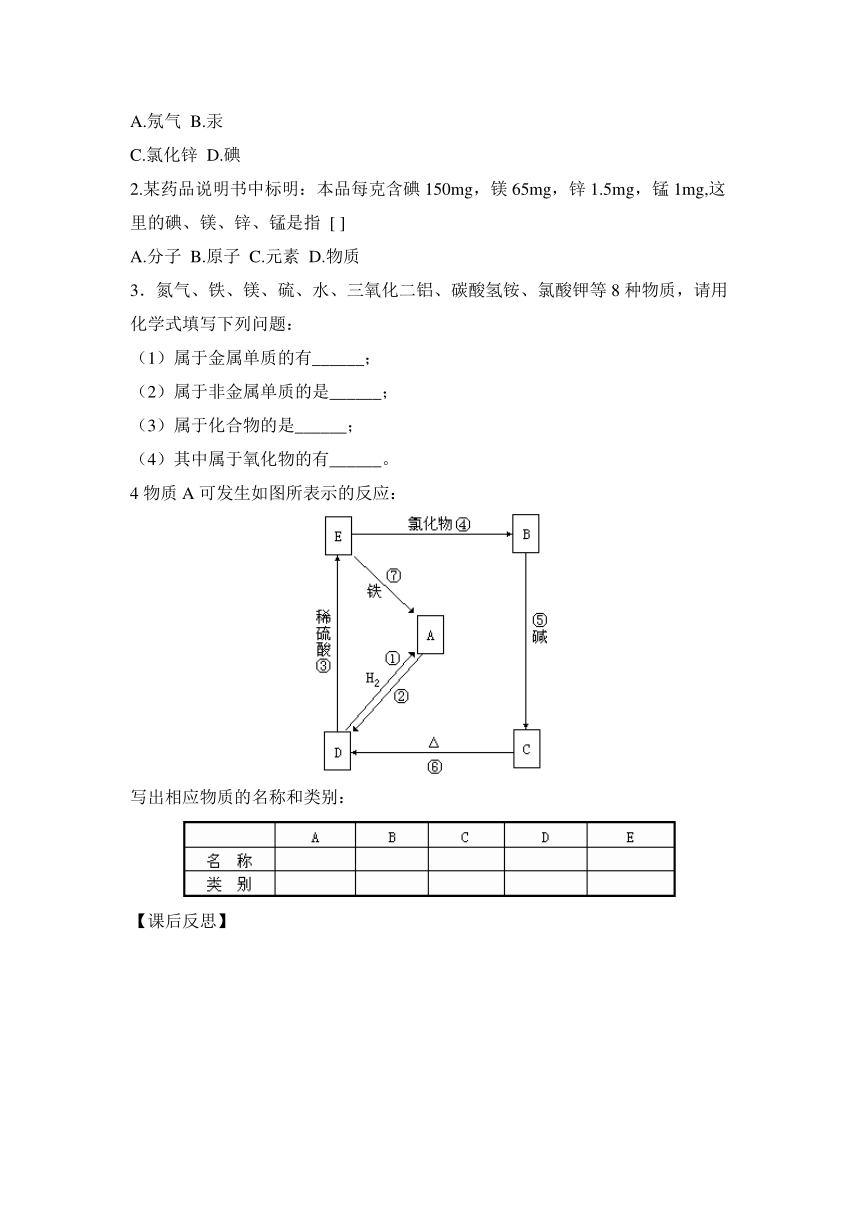
4物质A可发生如图所表示的反应:
写出相应物质的名称和类别:
【课后反思】
分散系及其分类(第2课时)
【教学过程】
【引入】展示NaCl溶液、淀粉溶液于水中形成的混合溶液和泥水混合液,他们有什么共同特点?
【学生思考回答】
【教学推进】都是一种物质(或几种物质)分散到另一种物质里形成的混合体系。我们把他们称为分散系。
【板书】二、分散系及其分类
1、分散系
【讲述】正如溶液由溶质和溶剂组成的一样。分散系由分散系和分散质组成。在分散系中,我们把被分散的物质称为分散质,如NaCl;而把容纳分散质的物质称为分散剂,如水。
【板书】2、分类
【提问】同学们,我手中的这瓶蓝色的药品是CuSO4晶体将它加入到水中,同学们说,CuSO4晶体在水中应该是怎样变化的呢?
【回答】CuSO4晶体溶解。
【讲述追问】是的。我们可以发现,在水中,CuSO4晶体是不断的分散到水分子中去的。我们将这个形成的体系叫做溶液。同学们再看纸包的泥沙,将它加入到水中,它又将有什么变化呢?
【回答】泥沙不溶解。
【讲解】不错。泥沙与CuSO4晶体不同,它不能溶解于水,且久置会有沉淀。但加入到水的过程中,泥沙也是不断地分散到水分子中的,这个体系叫做浊液。前面这两个体系都是固定物质加到水所形成的过程。如果,把FeCl3溶液加到沸水中,同学们设想一下,应该会有什么现象呢?
【回答】没变化、FeCl3溶液颜色变浅…
【思考与交流】P26图2-4:9种分散系,列举生活中分散系的实例
【归纳与整理】
分散系按照分散质或分散剂聚集状态不同分类,有9种类型。对比如下:
分散 质 分 散 剂 实 例
气 气 空气
液 气 云、雾
固 气 烟灰尘
气 液 泡沫
液 液 牛奶、酒精的水溶液
固 液 糖水、油漆
气 固 泡沫塑料
液 固 珍珠(包藏着水的碳酸钙)
固 固 有色玻璃、合金
【思考与交流】
1.按照分散质粒子的大小,能对分散系进行分类吗?
2.不同的分散系有什么区别?
【实验与探究】
1.取三个小烧杯,分别加入25 mL 蒸馏水、25 mL CuSO4溶液和25 mL泥水。将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液。继续煮沸至溶液呈红褐色,停止加热。观察制得的Fe(0H)3胶体,并与CuSO4溶液和泥水比较。
2.将盛有CuSO4溶液和Fe(0H)3胶体的烧杯置于暗处,分别用激光笔(或手电筒)照射烧杯中的液体,在于光束垂直的方向进行观察,并记录实验现象。
3.将Fe(0H)3胶体和泥水分别进行过滤,观察并记录实验现象。
【归纳与整理】
1.当光束通过Fe(0H)3胶体时,可以看到一条光亮的“通路”。而光束通过CuSO4溶液时,则看不到此现象。这条光亮的“通路”是由于胶体粒子对光线散射(光波偏离原来的方向而分散传播)形成的,叫做丁达尔效应。利用丁达尔效应是区分胶体与溶液的一种常用物理方法。
2.胶体的分散质能通过滤纸孔隙,而浊液的分散质则不能。这说明浊液的分散质粒子比较大。
3.三种分散系的比较
分散系 溶液 胶体 浊液
外观 均一、透明、稳定 多数均一、透明、介稳性 不均一、不透明、不稳定
分散质粒子 直径 <1nm 1nm~100nm >100nm
组成 单个分子或离子 分子集合体或有机高分子 许多分子集合体
能否透过滤纸 能 能 不能
典型实例 食盐水、碘酒 食盐酒精溶液、淀粉溶液 泥水
【思考与交流】
1.能举出日常生活中的一些丁达尔效应在吗?
2.通过刚才的学习,你对胶体有哪些认识?
【板书】三、胶体:
1、定义:分散质粒子在1nm-100nm之间的分散系。
2、胶体的本质特征:分散质粒子在1nm-100nm之间(在超显微镜下可见)。选择性透过(半透膜实验)
【阅读与拓展】了解胶体的介稳性及其破坏、布朗运动,胶体介稳性的应用。
【思考与交流】随着科技水平的不断发展,我们经常在媒体上听到一些有关纳米材料,你知道有哪些呢?
【阅读与拓展】纳米粒子的尺寸与胶体粒子大致相当。原有的胶体化学原理和方法不仅有助于纳米技术的发展,胶体化学也从中获得了新的研究方向和动力。
【回顾与总结】
1.分散系按照分散质粒子的大小不同分类可以分为溶液、胶体、浊液三类
2.分散系按照分散质粒子的大小不同分类,有3种类型。
分散系 溶液 胶体 浊液
外观 均一、透明、稳定 多数均一、透明、介稳性 不均一、不透明、不稳定
分散质粒子 直径 <1nm 1nm-100nm >100nm
组成 单个分子或离子 分子集合体或有机高分子 许多分子集合体
能否透过滤纸 能 能 不能
典型实例 食盐水、碘酒 食盐酒精溶液、淀粉溶液 泥水
【板书】3.胶体的性质:
丁达尔效应、布朗运动、聚沉(胶体的介稳性及其破坏)
4.纳米技术与胶体
【小结反思】
学生要理清胶体与溶液的的关系,特别掌握胶体的制备和主要性质
【作业布置】课时作业(七)
【板书设计】
二、分散系及其分类
1、分散系
2、分类
三、胶体
1、概念
2、本质
3、性质:丁达尔效应、布朗运动、聚沉(胶体的介稳性及其破坏)
【达标练习】
1.既能透过半透膜,又能通过滤纸的是 ( )
A.FeCl3 B.Fe(OH)3 C.医院酒精 D.Cu(OH)2悬浊液
2.关于胶体的叙述正确的是 [ ]
A.胶体微粒的直径小于1nm B.胶体微粒的直径介于1nm~100nm
C.胶体微粒不可以通过滤纸 D.胶体微粒可以通过半透膜
3.用饱和的FeCl3溶液制取Fe(OH)3胶体,正确的操作是( )
(A)将FeCl3溶液滴人蒸馏水中
(B)将FeCl3溶液滴人热水中,生成棕黄色液体
(C)将FeCl3溶液滴人沸水中,并继续煮沸至生成红褐色液体
(D)将FeCl3溶液滴人沸水中,并继续煮沸至生成红褐色沉淀
4 在一定温度下,向足量的饱和Na2CO3溶液中加入1.06克无水Na2CO3,搅拌后静置,最终所得晶体的质量 ( )
(A)等于1.06克 (B)大于1.06克而小于2.86克(C)等于2.86克 (D)大于2.86克
某温度时,化合物甲的饱和溶液mg中含有溶质ag,化合物乙的饱和溶液mg中含有溶质bg。则在此温度时,甲、乙两化合物的溶解度之比是
A B C D
分别取等质量80℃的甲、乙两种化合物的饱和溶液,降温至20℃后,所析出的甲的质量比乙的大(甲和乙均无结晶水).下列关于甲、乙溶解度的叙述中肯定正确的是( )
(A)20℃时,乙的溶解度比甲的大 (B)80℃时,甲的溶解度比乙的大
(C)温度对乙的溶解度影响较大 (D)温度对甲的溶解度影响较大
7.自来水厂常用FeCl3或明矾作净水剂,其原因是
8.实验时,手不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,其原因是_______,若换成硫酸铜溶液,是否可以?其原因是_________。
9.填写分离下列各组混合物所用的物理方法:
(1)除去水中少量的溴;( )
(2)除去石灰水中悬浮的碳酸钙;( )
(3)除去食盐中的淀粉;(半透膜)(实验班用)
10、将某溶液逐滴加入Fe(OH)3溶液胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是()(实验班用)
A、2mol/L H2SO4溶液 B、2mol/L NaOH溶液
C、2mol/L MgSO4溶液 D、硅酸溶胶
【教学反思】
四 种 基 本 反 应 类 型
第一节 物质的分类
【三维目标】
知识与技能:熟练地写出中学常见各种物质的化学式
清楚地知道每种物质的归类(酸、碱或盐)
掌握溶液、胶体和浊液这三种分散系的划分依据和鉴别
了解分散系的概念;了解胶体的概念;了解胶体的性质;了解胶体的实际应用。
掌握胶体与溶液,悬浊液,乳浊液的区别;掌握胶体的精制方法;理解丁达尔效应。
过程与方法:了解分类是进行化学学习和研究的重要方法
了解分类的方法:交叉分类法和树状分类法
学会用树状分类法逐步将自己所学的知识系统化、条理化、归纳化
培养学生的思维能力和自学能力
情感态度与价值:掌握辩证唯物主义一分为二和具体问题具体分析的观点,领会透过现象看本质的哲学思想
通过探究溶液、胶体、浊液本质,发展学习化学的兴趣与热情
培养学生严肃认真、一丝不苟勇于探索的科学态度
【重点难点】胶体的有关概念;学生实验能力、思维能力、自学能力的培养
了解常见化学物质及其变化的分类方法
掌握胶体与溶液,悬浊液,乳浊液的区别
【教学方法】情景创设、实验、引导学生归纳、总结、自学
简单分类法及其应用(第1课时)
【教学过程】
【新课导入】
图书馆或图书大厦里有许多的书籍,为什么你能够很快就找到你所需要的书?大超市里有成千上万种商品,为什么你能够迅速挑出你所需要的商品?
【推进新课】
分类是把某些特征相似的物体归类到一起的方法,它也是学习和研究化学物质及其变化的一种常用科学方法。运用分类的方法不仅能使有关化学物质及其变化的知识系统化,还可以通过分门别类的研究,发现物质及其变化的规律。现在我们开始学习物质的分类。
【过渡】实际上科学家早就按照物质的某些“特征”“属性”对化学物质以及他们所发生的化学反应进行了分类。
【板书】第一节 物质的分类
简单分类法及应用
【练习】
1 将下列元素进行分类
H He O Na Si Fe Ar Ba I Pb Ba Pb
非金属元素有
金属元素有
2 将下列物质进行分类,将其序号填在相应的空白处
①空气 ②液氯 ③啤酒 ④泥浆水 ⑤铁粉 ⑥硫酸 ⑦碘的四氯化碳溶液 ⑧氢氧化钠 ⑨氯化钠晶体 ⑩二氧化碳
混合物有
纯净物有
3 将下列化学反应进行分类,将其序号填入题后的横线上
①硫在氧气里的燃烧 ②红磷在氧气里的燃烧 ③铁丝在氧气里的燃烧 ④铝箔在氧气里的燃烧 ⑤蜡烛在氧气里的燃烧
化合反应有
非金属与氧气反应的有
金属与氧气反应的有
【问题】1、在初中化学课上曾经学习过哪些有关物质分类的概念?请大家先独立思考,然后交流。
2、纯净物Na2CO3,从其组成的阳离子来看,它属于什么盐?从阴离子来看,又属于什么盐?
【归纳总结】
1.将事物进行分类时,按照不同的分类标准进行分类会产生不同的分类结果。
2.在认识事物时,运用多种分类方法,可以弥补单一分类方法的不足。交叉分类法就是这种思想的体现。
3.对同类事物可以通过树状分类法进行再分类。
【板书】1、物质的分类
(1)交叉分类法
Na2CO3 钠盐
Na2SO4 钾盐
K2SO4 硫酸盐
K2CO3 碳酸盐
【思考与交流】
1.对于化学物质,如果按照所含物质种类的多少,可以怎样分类?
2.对于化合物我们按照不同的分类标准进行分类可以产生哪些分类结果?
【归纳与整理】
【板书】(2)树状分类法
【实践与探究】
1、选择熟悉的物质,制作一张交叉分类图。
提示:氧化物、酸、碱、盐等还可以按照不同的标准进一步进行分类,化合物也可以分为无机化合物和有机化合物等。
【思考与交流】
1.在初中我们学习过四种基本化学反应类型,它们是按照什么标准进行分类的?将化学反应又可以按照哪些不同的标准进行分类呢?
【归纳与整理】
【板书】2.化学反应的分类:
【思考与交流】
初中所学习的化学反应四种基本类型能概括所有的化学反应吗?我们应当用什么样的态度对待对已学知识?
【实践与探究】
根据物质的组成和性质,可以将化学物质分成哪几类?每类物质具有哪些主要的化学性质?你的这种分类采取了哪种分类方法?
【归纳与整理】
【小结反思】
1.分类法是一种行之有效、简单易行的科学方法。运用分类的方法不仅能使有关化学物质及其变化的知识系统化,还可以通过分门别类的研究,发现物质及其变化的规律。
2.在认识事物时,运用多种分类方法,可以弥补单一分类方法的不足。交叉分类法和树状分类法是化学分类中常用的两种分类方法。
【作业布置】课时作业(六)
【板书设计】
物质的分类
物质分类法及其应用
物质分类
(1)交叉分类
(2)树状分类
2、化学反应分类
【达标练习】
1.下列物质属于金属单质的是 [ ]
A.氖气 B.汞
C.氯化锌 D.碘
2.某药品说明书中标明:本品每克含碘150mg,镁65mg,锌1.5mg,锰1mg,这里的碘、镁、锌、锰是指 [ ]
A.分子 B.原子 C.元素 D.物质
3.氮气、铁、镁、硫、水、三氧化二铝、碳酸氢铵、氯酸钾等8种物质,请用化学式填写下列问题:
(1)属于金属单质的有______;
(2)属于非金属单质的是______;
(3)属于化合物的是______;
(4)其中属于氧化物的有______。
4物质A可发生如图所表示的反应:
写出相应物质的名称和类别:
【课后反思】
分散系及其分类(第2课时)
【教学过程】
【引入】展示NaCl溶液、淀粉溶液于水中形成的混合溶液和泥水混合液,他们有什么共同特点?
【学生思考回答】
【教学推进】都是一种物质(或几种物质)分散到另一种物质里形成的混合体系。我们把他们称为分散系。
【板书】二、分散系及其分类
1、分散系
【讲述】正如溶液由溶质和溶剂组成的一样。分散系由分散系和分散质组成。在分散系中,我们把被分散的物质称为分散质,如NaCl;而把容纳分散质的物质称为分散剂,如水。
【板书】2、分类
【提问】同学们,我手中的这瓶蓝色的药品是CuSO4晶体将它加入到水中,同学们说,CuSO4晶体在水中应该是怎样变化的呢?
【回答】CuSO4晶体溶解。
【讲述追问】是的。我们可以发现,在水中,CuSO4晶体是不断的分散到水分子中去的。我们将这个形成的体系叫做溶液。同学们再看纸包的泥沙,将它加入到水中,它又将有什么变化呢?
【回答】泥沙不溶解。
【讲解】不错。泥沙与CuSO4晶体不同,它不能溶解于水,且久置会有沉淀。但加入到水的过程中,泥沙也是不断地分散到水分子中的,这个体系叫做浊液。前面这两个体系都是固定物质加到水所形成的过程。如果,把FeCl3溶液加到沸水中,同学们设想一下,应该会有什么现象呢?
【回答】没变化、FeCl3溶液颜色变浅…
【思考与交流】P26图2-4:9种分散系,列举生活中分散系的实例
【归纳与整理】
分散系按照分散质或分散剂聚集状态不同分类,有9种类型。对比如下:
分散 质 分 散 剂 实 例
气 气 空气
液 气 云、雾
固 气 烟灰尘
气 液 泡沫
液 液 牛奶、酒精的水溶液
固 液 糖水、油漆
气 固 泡沫塑料
液 固 珍珠(包藏着水的碳酸钙)
固 固 有色玻璃、合金
【思考与交流】
1.按照分散质粒子的大小,能对分散系进行分类吗?
2.不同的分散系有什么区别?
【实验与探究】
1.取三个小烧杯,分别加入25 mL 蒸馏水、25 mL CuSO4溶液和25 mL泥水。将烧杯中的蒸馏水加热至沸腾,向沸水中逐滴加入1~2 mL FeCl3饱和溶液。继续煮沸至溶液呈红褐色,停止加热。观察制得的Fe(0H)3胶体,并与CuSO4溶液和泥水比较。
2.将盛有CuSO4溶液和Fe(0H)3胶体的烧杯置于暗处,分别用激光笔(或手电筒)照射烧杯中的液体,在于光束垂直的方向进行观察,并记录实验现象。
3.将Fe(0H)3胶体和泥水分别进行过滤,观察并记录实验现象。
【归纳与整理】
1.当光束通过Fe(0H)3胶体时,可以看到一条光亮的“通路”。而光束通过CuSO4溶液时,则看不到此现象。这条光亮的“通路”是由于胶体粒子对光线散射(光波偏离原来的方向而分散传播)形成的,叫做丁达尔效应。利用丁达尔效应是区分胶体与溶液的一种常用物理方法。
2.胶体的分散质能通过滤纸孔隙,而浊液的分散质则不能。这说明浊液的分散质粒子比较大。
3.三种分散系的比较
分散系 溶液 胶体 浊液
外观 均一、透明、稳定 多数均一、透明、介稳性 不均一、不透明、不稳定
分散质粒子 直径 <1nm 1nm~100nm >100nm
组成 单个分子或离子 分子集合体或有机高分子 许多分子集合体
能否透过滤纸 能 能 不能
典型实例 食盐水、碘酒 食盐酒精溶液、淀粉溶液 泥水
【思考与交流】
1.能举出日常生活中的一些丁达尔效应在吗?
2.通过刚才的学习,你对胶体有哪些认识?
【板书】三、胶体:
1、定义:分散质粒子在1nm-100nm之间的分散系。
2、胶体的本质特征:分散质粒子在1nm-100nm之间(在超显微镜下可见)。选择性透过(半透膜实验)
【阅读与拓展】了解胶体的介稳性及其破坏、布朗运动,胶体介稳性的应用。
【思考与交流】随着科技水平的不断发展,我们经常在媒体上听到一些有关纳米材料,你知道有哪些呢?
【阅读与拓展】纳米粒子的尺寸与胶体粒子大致相当。原有的胶体化学原理和方法不仅有助于纳米技术的发展,胶体化学也从中获得了新的研究方向和动力。
【回顾与总结】
1.分散系按照分散质粒子的大小不同分类可以分为溶液、胶体、浊液三类
2.分散系按照分散质粒子的大小不同分类,有3种类型。
分散系 溶液 胶体 浊液
外观 均一、透明、稳定 多数均一、透明、介稳性 不均一、不透明、不稳定
分散质粒子 直径 <1nm 1nm-100nm >100nm
组成 单个分子或离子 分子集合体或有机高分子 许多分子集合体
能否透过滤纸 能 能 不能
典型实例 食盐水、碘酒 食盐酒精溶液、淀粉溶液 泥水
【板书】3.胶体的性质:
丁达尔效应、布朗运动、聚沉(胶体的介稳性及其破坏)
4.纳米技术与胶体
【小结反思】
学生要理清胶体与溶液的的关系,特别掌握胶体的制备和主要性质
【作业布置】课时作业(七)
【板书设计】
二、分散系及其分类
1、分散系
2、分类
三、胶体
1、概念
2、本质
3、性质:丁达尔效应、布朗运动、聚沉(胶体的介稳性及其破坏)
【达标练习】
1.既能透过半透膜,又能通过滤纸的是 ( )
A.FeCl3 B.Fe(OH)3 C.医院酒精 D.Cu(OH)2悬浊液
2.关于胶体的叙述正确的是 [ ]
A.胶体微粒的直径小于1nm B.胶体微粒的直径介于1nm~100nm
C.胶体微粒不可以通过滤纸 D.胶体微粒可以通过半透膜
3.用饱和的FeCl3溶液制取Fe(OH)3胶体,正确的操作是( )
(A)将FeCl3溶液滴人蒸馏水中
(B)将FeCl3溶液滴人热水中,生成棕黄色液体
(C)将FeCl3溶液滴人沸水中,并继续煮沸至生成红褐色液体
(D)将FeCl3溶液滴人沸水中,并继续煮沸至生成红褐色沉淀
4 在一定温度下,向足量的饱和Na2CO3溶液中加入1.06克无水Na2CO3,搅拌后静置,最终所得晶体的质量 ( )
(A)等于1.06克 (B)大于1.06克而小于2.86克(C)等于2.86克 (D)大于2.86克
某温度时,化合物甲的饱和溶液mg中含有溶质ag,化合物乙的饱和溶液mg中含有溶质bg。则在此温度时,甲、乙两化合物的溶解度之比是
A B C D
分别取等质量80℃的甲、乙两种化合物的饱和溶液,降温至20℃后,所析出的甲的质量比乙的大(甲和乙均无结晶水).下列关于甲、乙溶解度的叙述中肯定正确的是( )
(A)20℃时,乙的溶解度比甲的大 (B)80℃时,甲的溶解度比乙的大
(C)温度对乙的溶解度影响较大 (D)温度对甲的溶解度影响较大
7.自来水厂常用FeCl3或明矾作净水剂,其原因是
8.实验时,手不慎被玻璃划破,可从急救箱中取氯化铁溶液应急止血,其原因是_______,若换成硫酸铜溶液,是否可以?其原因是_________。
9.填写分离下列各组混合物所用的物理方法:
(1)除去水中少量的溴;( )
(2)除去石灰水中悬浮的碳酸钙;( )
(3)除去食盐中的淀粉;(半透膜)(实验班用)
10、将某溶液逐滴加入Fe(OH)3溶液胶内,开始时产生沉淀,继续滴加时沉淀又溶解,该溶液是()(实验班用)
A、2mol/L H2SO4溶液 B、2mol/L NaOH溶液
C、2mol/L MgSO4溶液 D、硅酸溶胶
【教学反思】
四 种 基 本 反 应 类 型
