2013届高三化学一轮复习3.4《铁及其化合物》教案(鲁科版)
文档属性
| 名称 | 2013届高三化学一轮复习3.4《铁及其化合物》教案(鲁科版) |
|
|
| 格式 | zip | ||
| 文件大小 | 139.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | |||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-19 00:00:00 | ||
图片预览

文档简介
铁及其化合物高三化学第一轮复习教案
考点突破
1、铁的化合物的相互转化关系
2、铁的氧化物和氢氧化物
3、Fe2+、Fe3+的鉴别
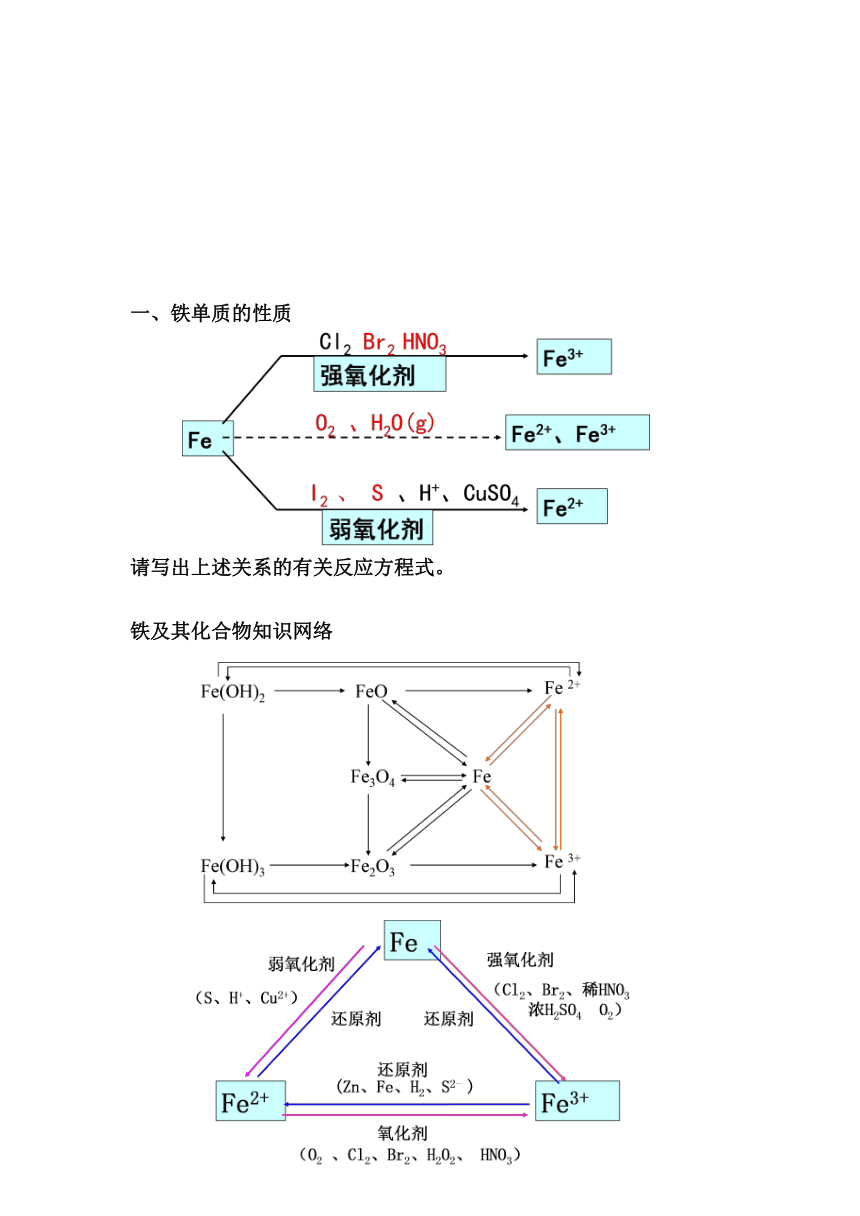
铁的原子结构与性质:
一、铁单质的性质
请写出上述关系的有关反应方程式。
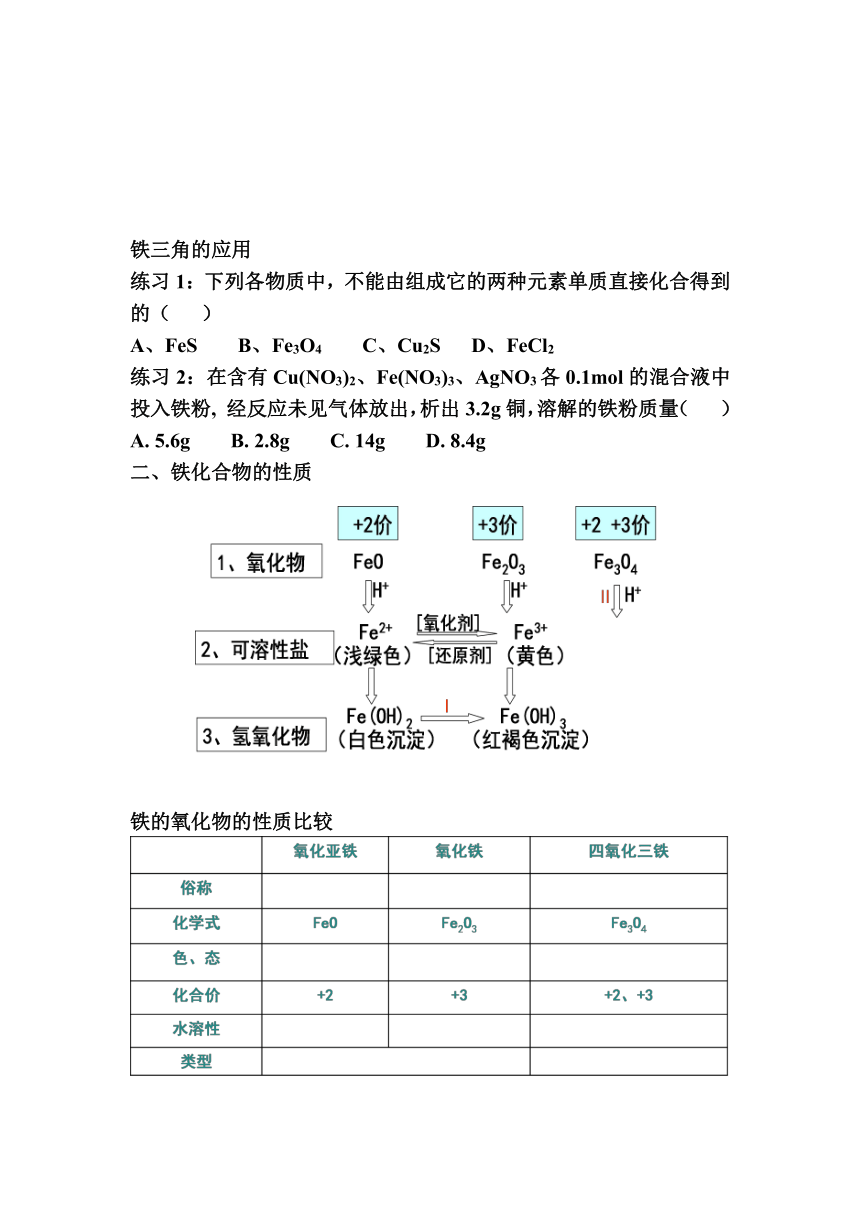
铁及其化合物知识网络
铁三角的应用
练习1:下列各物质中,不能由组成它的两种元素单质直接化合得到的( )
A、FeS B、Fe3O4 C、Cu2S D、FeCl2
练习2:在含有Cu(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合液中投入铁粉, 经反应未见气体放出,析出3.2g铜,溶解的铁粉质量( )
A. 5.6g B. 2.8g C. 14g D. 8.4g
二、铁化合物的性质
铁的氧化物的性质比较
[例二] 下列离子方程式书写正确的是( D)
A、FeO与稀HNO3反应:FeO + 2H+= Fe2++ H2O
B、Fe与FeCl3反应:Fe + Fe3+= 2Fe2+
C、Fe(OH)3与HI酸反应 Fe(OH)3 + 3H+ = Fe3+ + 3H2O
D、FeCl3与足量H2S溶液反应
2Fe3+ + H2S = 2Fe2+ + S ↓+2H+
[例三] 向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 1 mol/L 的盐酸,恰好使混合物完全溶解,放出224mL(标况)的气体,向所得溶液中,加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量为:C
A、11.2g B、5.6g
C、2.8g D、无法确定
练习3: 某物质A的溶液有如下性质:
上述实验现象分析得出(用化学式表示)
(1)A是 ,B是 ,C是 ;
(2)加入盐酸变红的原因是3Fe2++4H++NO3- =3Fe3++NO+2H2O。
练习4: 在FeCl3溶液中加少量Na2S溶液,溶液变浑浊,这时反应的离子方程式是2Fe3++S2-=2Fe2++S,如果再继续加入Na2S溶液时,则出现黑色沉淀,此时反应的离子方程式是Fe2++S2-=FeS。
三、Fe2+、Fe3+的鉴别
讨论1: 用尽可能多的方法区别存在铁离子和亚铁离子的两种溶液?
区别方法小结:1、直接观察颜色;2、利用显色反应;3、利用沉淀反应;4、利用Fe2+的还原性;5、利用Fe3+的氧化性
讨论2:怎样用实验方法来制取氢氧化铁和氢氧化亚铁?
用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入铁粉。
(2)除去蒸馏水中溶解的O2常采用加热煮沸的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是防止生成的Fe(OH)2沉淀接触空气。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
讨论3:如何保存氯化铁和氯化亚铁溶液?为什么?原理是什么?写出有关化学方程式。
讨论4:如何除去铁离子中的亚铁离子?如何除去亚铁离子中的铁离子?
钢铁的吸氧腐蚀与析氢腐蚀
背景知识:全球每年由于腐蚀而直接消
耗的金属材料,约占金属年产量的10%.
其中Fe是如何变成铁锈的?
吸氧腐蚀: (-)Fe-2e=Fe2+ (+)2H2O+O2+4e=4OH-
Fe2+ +2 OH- =4Fe(OH)2
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)3 ~ Fe2O3 nH2O(铁红)
析氢腐蚀: (-)Fe-2e=Fe2+ (+)2H++2e=H2
考点突破
1、铁的化合物的相互转化关系
2、铁的氧化物和氢氧化物
3、Fe2+、Fe3+的鉴别
铁的原子结构与性质:
一、铁单质的性质
请写出上述关系的有关反应方程式。
铁及其化合物知识网络
铁三角的应用
练习1:下列各物质中,不能由组成它的两种元素单质直接化合得到的( )
A、FeS B、Fe3O4 C、Cu2S D、FeCl2
练习2:在含有Cu(NO3)2、Fe(NO3)3、AgNO3各0.1mol的混合液中投入铁粉, 经反应未见气体放出,析出3.2g铜,溶解的铁粉质量( )
A. 5.6g B. 2.8g C. 14g D. 8.4g
二、铁化合物的性质
铁的氧化物的性质比较
[例二] 下列离子方程式书写正确的是( D)
A、FeO与稀HNO3反应:FeO + 2H+= Fe2++ H2O
B、Fe与FeCl3反应:Fe + Fe3+= 2Fe2+
C、Fe(OH)3与HI酸反应 Fe(OH)3 + 3H+ = Fe3+ + 3H2O
D、FeCl3与足量H2S溶液反应
2Fe3+ + H2S = 2Fe2+ + S ↓+2H+
[例三] 向一定量的Fe、FeO、Fe2O3的混合物中,加入100mL 1 mol/L 的盐酸,恰好使混合物完全溶解,放出224mL(标况)的气体,向所得溶液中,加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的混合物,能得到铁的质量为:C
A、11.2g B、5.6g
C、2.8g D、无法确定
练习3: 某物质A的溶液有如下性质:
上述实验现象分析得出(用化学式表示)
(1)A是 ,B是 ,C是 ;
(2)加入盐酸变红的原因是3Fe2++4H++NO3- =3Fe3++NO+2H2O。
练习4: 在FeCl3溶液中加少量Na2S溶液,溶液变浑浊,这时反应的离子方程式是2Fe3++S2-=2Fe2++S,如果再继续加入Na2S溶液时,则出现黑色沉淀,此时反应的离子方程式是Fe2++S2-=FeS。
三、Fe2+、Fe3+的鉴别
讨论1: 用尽可能多的方法区别存在铁离子和亚铁离子的两种溶液?
区别方法小结:1、直接观察颜色;2、利用显色反应;3、利用沉淀反应;4、利用Fe2+的还原性;5、利用Fe3+的氧化性
讨论2:怎样用实验方法来制取氢氧化铁和氢氧化亚铁?
用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入铁粉。
(2)除去蒸馏水中溶解的O2常采用加热煮沸的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的理由是防止生成的Fe(OH)2沉淀接触空气。
方法二:在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。
(1)在试管Ⅰ里加入的试剂是 。
(2)在试管Ⅱ里加入的试剂是 。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
讨论3:如何保存氯化铁和氯化亚铁溶液?为什么?原理是什么?写出有关化学方程式。
讨论4:如何除去铁离子中的亚铁离子?如何除去亚铁离子中的铁离子?
钢铁的吸氧腐蚀与析氢腐蚀
背景知识:全球每年由于腐蚀而直接消
耗的金属材料,约占金属年产量的10%.
其中Fe是如何变成铁锈的?
吸氧腐蚀: (-)Fe-2e=Fe2+ (+)2H2O+O2+4e=4OH-
Fe2+ +2 OH- =4Fe(OH)2
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)3 ~ Fe2O3 nH2O(铁红)
析氢腐蚀: (-)Fe-2e=Fe2+ (+)2H++2e=H2
同课章节目录
