第一节 物质的分类
图片预览





文档简介
(共27张PPT)
第二章 化学物质及其变化
第一节 物质的分类
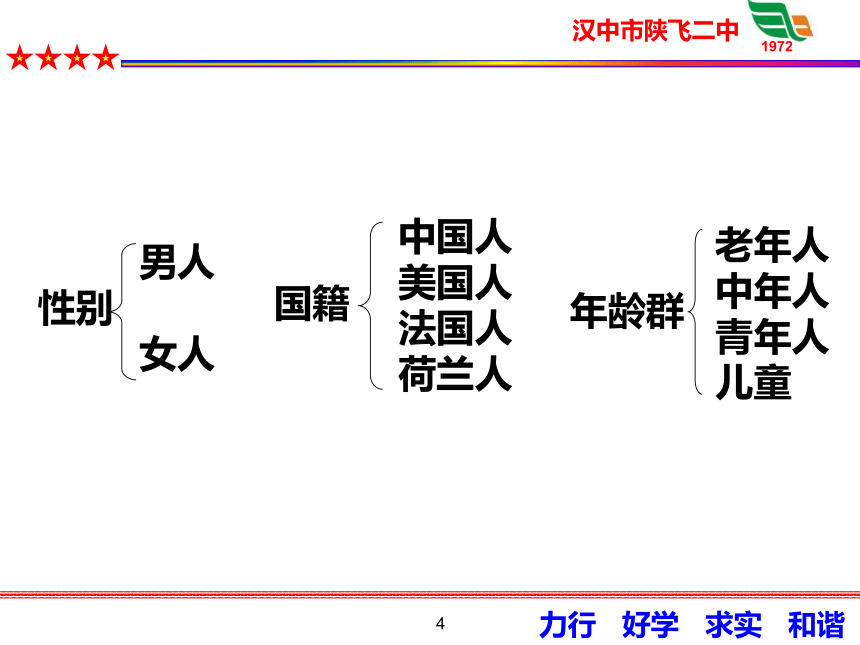
男人
女人
老年人
中年人
青年人
儿童
性别
国籍
年龄群
中国人
美国人
法国人
荷兰人
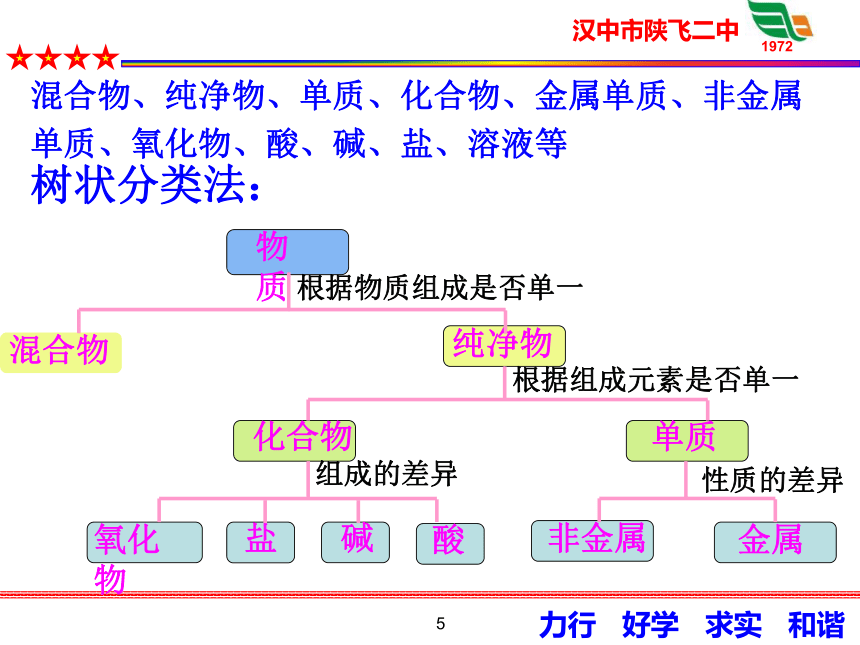
物质
混合物
纯净物
单质
化合物
金属
非金属
酸
碱
盐
氧化物
树状分类法:
根据物质组成是否单一
根据组成元素是否单一
混合物、纯净物、单质、化合物、金属单质、非金属单质、氧化物、酸、碱、盐、溶液等
组成的差异
性质的差异
下列的物质:O2 、 H2O、 空气、Fe、 Al(OH)3 、干冰、K2SO4 、Na2SO4 、Ca(OH)2、 Na2CO3 、 H2SO4、 K2CO3 、 HCl、 CuSO4溶液、HNO3 、NaOH 、 H2S、H2CO3、MgO中,属于
Fe
O2
空气 CuSO4溶液
H2O 干冰 MgO
H2SO4 HCl HNO3 H2S H2CO3
K2SO4 Na2SO4 Na2CO3 K2CO3
Ca(OH)2 NaOH Al(OH)3
混合物:
金属单质:
非金属单质:
氧化物:
酸:
碱:
盐:
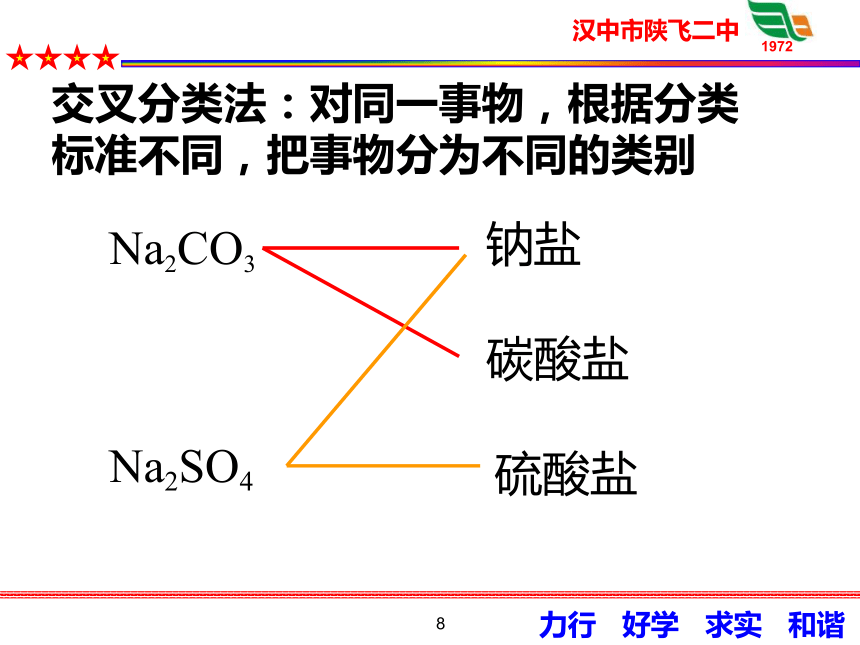
请大家对下列盐从阴阳离子的角度进行
分类:Na2SO4、K2CO3、Na2CO3、K2SO4。
从阳离子的角度:钠盐、钾盐
从阴离子的角度:硫酸盐、碳酸盐
Na2CO3
Na2SO4
钠盐
碳酸盐
硫酸盐
交叉分类法:对同一事物,根据分类
标准不同,把事物分为不同的类别
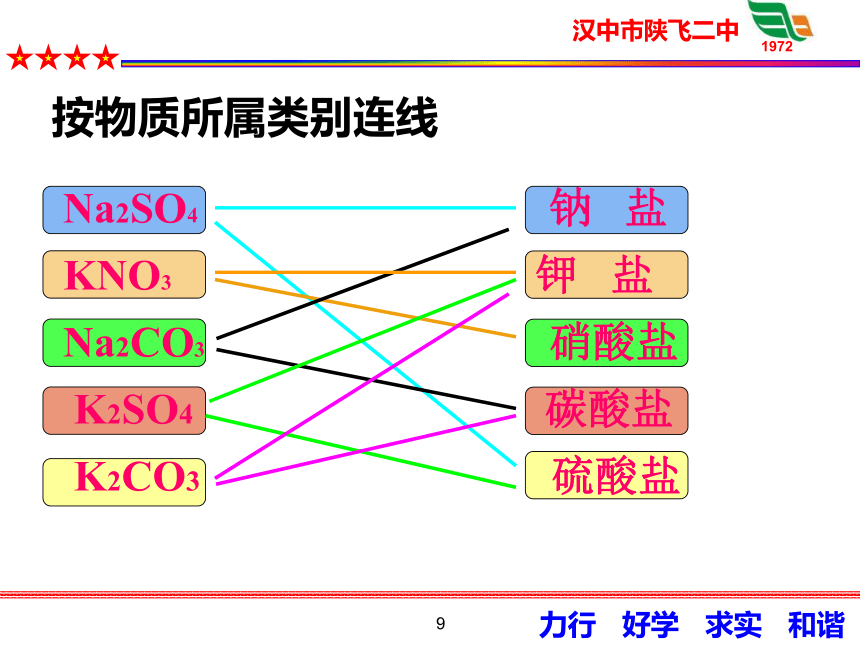
按物质所属类别连线
Na2SO4 钠 盐
KNO3 钾 盐
Na2CO3 硝酸盐
K2SO4 碳酸盐
K2CO3 硫酸盐
请大家思考、交流:我们可以从哪些不同的角度对下列酸进行分类:HCl、 H2SO4、H2S、H2CO3、HNO3
无氧酸
含氧酸
一元酸
二元酸
强酸
弱酸
HCl
H2SO4
HNO3
H2S
H2CO3
强 酸
弱 酸
无氧酸
含氧酸
一元酸
二元酸
按物质所属类别连线
树状分类法
交叉分类法
请大家对下列反应方程式进行分类:
①CaCO3 = CaO + CO2 ↑
高温
②3Fe + 2O2 = Fe3O4
点燃
③Fe + 2HCl = FeCl2 + H2↑
④2HCl + Ca(OH)2 = CaCl2 + H2O
⑤2H2O2 = 2H2O + O2 ↑
MnO2
⑥NaOH + HCl = NaCl + H2O
化合反应:
分解反应:
置换反应:
复分解反应:
①
②
③
④
⑤
⑥
常见反应类型
反应类型
化合反应
分解反应
置换反应
复分解反应
A + B = AB
AB = A + B
A + BC = AC + B
AB + CD = AD + CB
1.铁在氧气中燃烧
2.铁跟稀盐酸反应
3.碳酸钙在高温的条件下煅烧
4.稀盐酸与氢氧化钙的反应
请写出下列有关反应的化学反应方程式
Fe + 2HCl = FeCl2 + H2↑
2HCl + Ca(OH)2 = CaCl2 + H2O
3Fe + 2O2 = Fe3O4
点燃
CaCO3 = CaO + CO2 ↑
高温
化合反应
分解反应
置换反应
复分解反应
二、分散系及其分类
1、分散系:一种物质(或几种物质) 以粒子形式分散到另一种物质里所形成的混合物。
分散成微粒的物质—分散质
微粒分布在其中的物质—分散剂
思考与交流:请试着举出几种分散系的实例,并讨论交流。说明属于哪一类型的分散系?
分散质
分散剂
实例
气
气
空气
液
气
云、雾
固
气
烟灰尘
气
液
泡沫
液
液
牛奶、酒精水溶液
固
液
糖水、油漆
气
固
泡沫塑料
液
固
珍珠(包藏着水的碳酸钙)
固
固
有色玻璃、合金
按照分散质或分散剂的聚集状态(气、液、固)来分:
按照分散质粒子的大小来分:
分散系
溶液
(小于1nm)
胶体
(介于1-100nm之间)
浊液
(大于100nm)
均一、透明
不均一、不透明
均一、个别透明
稳定
不稳定
在一定条件下稳定
(介稳性)
2、胶体
1)定义:
分散质微粒的直径大小在1nm 100nm
之间的分散系叫胶体。
如:豆浆、牛奶、淀粉溶胶、蛋清溶胶、墨水、
Fe(OH)3 胶体 等。
如:把淀粉颗粒分散到水中
常见的胶体有:淀粉胶体、墨汁、豆浆、碳素墨水等
(1)物理分散法
将悬浊液或乳浊液中的
分散质分散
2)胶体的制备
豆浆
(2)化学结合法
——溶质分子聚合成胶粒
①水解法
②复分解法
此法注意的问题:
Ⅰ不能过度加热,以免出现Fe(OH)3胶体凝聚。
Ⅱ不能用玻璃搅拌,防止生成Fe(OH)3沉淀。
FeCl3 + 3H2O △ Fe(OH)3(胶体)+3HCl
红褐色
AgNO3 + KI = AgI(胶体)+ KNO3
浅黄色
此法注意的问题:
①浓度控制,浓度过大会生成沉淀。
②逐滴滴加,同时要不断振荡。
光束通过溶液和胶体时的现象
a)能发生丁达尔效应(区别于溶液的一种
物理方法)
b)能透过滤纸(区分悬浊液)
不能透过半透膜(区分溶液)
c)具有介稳性(同种胶粒带同性电荷,相互排斥,不易聚沉;粒子的布朗运动)
d)改变条件(加入带相反电荷的粒子的物质、加热),会发生凝聚
生活中的丁达尔现象
生活中的丁达尔现象
生活中的丁达尔现象
4)胶体的分类
根据分散质微粒的构成分
粒子胶体:Fe(OH)3胶体、
AgI胶体
分子胶体:淀粉溶液、
蛋白质溶液
固溶胶:有色玻璃、烟水晶
液溶胶:AgI胶体、Fe(OH)3胶体
气溶胶:烟、云、雾
根据分散剂状态分
第二章 化学物质及其变化
第一节 物质的分类
男人
女人
老年人
中年人
青年人
儿童
性别
国籍
年龄群
中国人
美国人
法国人
荷兰人
物质
混合物
纯净物
单质
化合物
金属
非金属
酸
碱
盐
氧化物
树状分类法:
根据物质组成是否单一
根据组成元素是否单一
混合物、纯净物、单质、化合物、金属单质、非金属单质、氧化物、酸、碱、盐、溶液等
组成的差异
性质的差异
下列的物质:O2 、 H2O、 空气、Fe、 Al(OH)3 、干冰、K2SO4 、Na2SO4 、Ca(OH)2、 Na2CO3 、 H2SO4、 K2CO3 、 HCl、 CuSO4溶液、HNO3 、NaOH 、 H2S、H2CO3、MgO中,属于
Fe
O2
空气 CuSO4溶液
H2O 干冰 MgO
H2SO4 HCl HNO3 H2S H2CO3
K2SO4 Na2SO4 Na2CO3 K2CO3
Ca(OH)2 NaOH Al(OH)3
混合物:
金属单质:
非金属单质:
氧化物:
酸:
碱:
盐:
请大家对下列盐从阴阳离子的角度进行
分类:Na2SO4、K2CO3、Na2CO3、K2SO4。
从阳离子的角度:钠盐、钾盐
从阴离子的角度:硫酸盐、碳酸盐
Na2CO3
Na2SO4
钠盐
碳酸盐
硫酸盐
交叉分类法:对同一事物,根据分类
标准不同,把事物分为不同的类别
按物质所属类别连线
Na2SO4 钠 盐
KNO3 钾 盐
Na2CO3 硝酸盐
K2SO4 碳酸盐
K2CO3 硫酸盐
请大家思考、交流:我们可以从哪些不同的角度对下列酸进行分类:HCl、 H2SO4、H2S、H2CO3、HNO3
无氧酸
含氧酸
一元酸
二元酸
强酸
弱酸
HCl
H2SO4
HNO3
H2S
H2CO3
强 酸
弱 酸
无氧酸
含氧酸
一元酸
二元酸
按物质所属类别连线
树状分类法
交叉分类法
请大家对下列反应方程式进行分类:
①CaCO3 = CaO + CO2 ↑
高温
②3Fe + 2O2 = Fe3O4
点燃
③Fe + 2HCl = FeCl2 + H2↑
④2HCl + Ca(OH)2 = CaCl2 + H2O
⑤2H2O2 = 2H2O + O2 ↑
MnO2
⑥NaOH + HCl = NaCl + H2O
化合反应:
分解反应:
置换反应:
复分解反应:
①
②
③
④
⑤
⑥
常见反应类型
反应类型
化合反应
分解反应
置换反应
复分解反应
A + B = AB
AB = A + B
A + BC = AC + B
AB + CD = AD + CB
1.铁在氧气中燃烧
2.铁跟稀盐酸反应
3.碳酸钙在高温的条件下煅烧
4.稀盐酸与氢氧化钙的反应
请写出下列有关反应的化学反应方程式
Fe + 2HCl = FeCl2 + H2↑
2HCl + Ca(OH)2 = CaCl2 + H2O
3Fe + 2O2 = Fe3O4
点燃
CaCO3 = CaO + CO2 ↑
高温
化合反应
分解反应
置换反应
复分解反应
二、分散系及其分类
1、分散系:一种物质(或几种物质) 以粒子形式分散到另一种物质里所形成的混合物。
分散成微粒的物质—分散质
微粒分布在其中的物质—分散剂
思考与交流:请试着举出几种分散系的实例,并讨论交流。说明属于哪一类型的分散系?
分散质
分散剂
实例
气
气
空气
液
气
云、雾
固
气
烟灰尘
气
液
泡沫
液
液
牛奶、酒精水溶液
固
液
糖水、油漆
气
固
泡沫塑料
液
固
珍珠(包藏着水的碳酸钙)
固
固
有色玻璃、合金
按照分散质或分散剂的聚集状态(气、液、固)来分:
按照分散质粒子的大小来分:
分散系
溶液
(小于1nm)
胶体
(介于1-100nm之间)
浊液
(大于100nm)
均一、透明
不均一、不透明
均一、个别透明
稳定
不稳定
在一定条件下稳定
(介稳性)
2、胶体
1)定义:
分散质微粒的直径大小在1nm 100nm
之间的分散系叫胶体。
如:豆浆、牛奶、淀粉溶胶、蛋清溶胶、墨水、
Fe(OH)3 胶体 等。
如:把淀粉颗粒分散到水中
常见的胶体有:淀粉胶体、墨汁、豆浆、碳素墨水等
(1)物理分散法
将悬浊液或乳浊液中的
分散质分散
2)胶体的制备
豆浆
(2)化学结合法
——溶质分子聚合成胶粒
①水解法
②复分解法
此法注意的问题:
Ⅰ不能过度加热,以免出现Fe(OH)3胶体凝聚。
Ⅱ不能用玻璃搅拌,防止生成Fe(OH)3沉淀。
FeCl3 + 3H2O △ Fe(OH)3(胶体)+3HCl
红褐色
AgNO3 + KI = AgI(胶体)+ KNO3
浅黄色
此法注意的问题:
①浓度控制,浓度过大会生成沉淀。
②逐滴滴加,同时要不断振荡。
光束通过溶液和胶体时的现象
a)能发生丁达尔效应(区别于溶液的一种
物理方法)
b)能透过滤纸(区分悬浊液)
不能透过半透膜(区分溶液)
c)具有介稳性(同种胶粒带同性电荷,相互排斥,不易聚沉;粒子的布朗运动)
d)改变条件(加入带相反电荷的粒子的物质、加热),会发生凝聚
生活中的丁达尔现象
生活中的丁达尔现象
生活中的丁达尔现象
4)胶体的分类
根据分散质微粒的构成分
粒子胶体:Fe(OH)3胶体、
AgI胶体
分子胶体:淀粉溶液、
蛋白质溶液
固溶胶:有色玻璃、烟水晶
液溶胶:AgI胶体、Fe(OH)3胶体
气溶胶:烟、云、雾
根据分散剂状态分
