人教版(五四制)八年级全一册化学 第五单元 课题1 质量守恒定律 第一课时(课件)(25张PPT)
文档属性
| 名称 | 人教版(五四制)八年级全一册化学 第五单元 课题1 质量守恒定律 第一课时(课件)(25张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-11 13:12:08 | ||
图片预览








文档简介
(共25张PPT)
课题1 质量守恒定律
分解 结合
水分子 氢原子 氧原子 氢分子 氧分子
多角度认识化学反应
H2O H2 + O2
通电
1.宏观现象角度: 定性分析
2.微观实质角度:
3.符号表达:
4.反应类型:
质量计算的角度: 定量分析
结论:反应物的总质量小于生成物的总质量
结论:反应物的总质量等于生成物的总质量
文字表达式:汞 + 氧气 氧化汞
密闭装置
敞口装置
点燃
化学史料:科学家对化学变化中质量变化的探究
波义耳的实验(1673年)
拉瓦锡的实验(1777年)
物质在发生化学变化时,反应物的质量总和与生成物的质量总和之间存在什么关系呢?
提出问题
猜想:可能。
反应物的质量总和
生成物的质量总和
大于
等于
小于
证明猜想?
实验与探究一
1.在锥形瓶底部铺一层细沙,上面放一块红磷,用带有导管的橡胶塞盖紧(事先在导管上系一气球),放在天平上称量,记录数据m1;
2.取下锥形瓶,用酒精灯将玻璃导管灼烧至红热,迅速插入锥形瓶中,观察现象;再将其放在天平上称量,记录数据m2。
【实验原理】
红磷燃烧前后质量总和的测定
【实验步骤】
红磷+氧气 五氧化二磷
点燃
1.锥形瓶底部应预先装部分沙子的目的:
防止红磷燃烧时炸裂瓶底。
2.导管口放一气球的目的:平衡装置内压强,防止橡皮塞被弹出。
红磷燃烧前后质量的测定
实验方案 红磷燃烧前后质量的测定
实验现象
反应前总质量(g)
反应后总质量(g)
反应符号表达式
数据分析
红磷燃烧,产生大量白烟,放出热量,气球先变大后又缩小。
点燃
P+O2 P2O5
m1
m2
m1 = m2,反应前后总质量相等
反应前后天平平衡
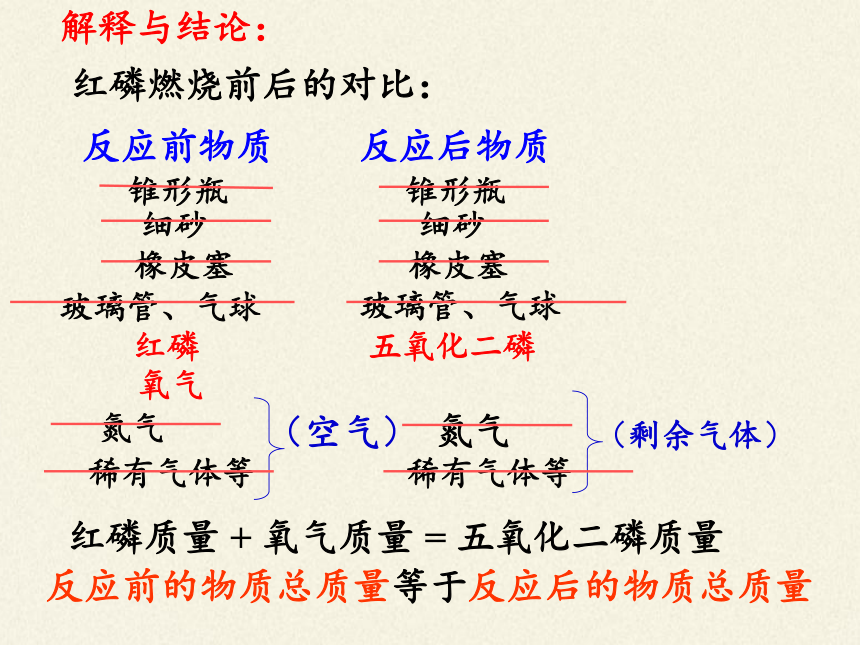
解释与结论:
红磷燃烧前后的对比:
反应前的物质总质量等于反应后的物质总质量
反应前物质
反应后物质
锥形瓶
细砂
橡皮塞
玻璃管、气球
(空气)
氮气
锥形瓶
细砂
橡皮塞
玻璃管、气球
(剩余气体)
氮气
稀有气体等
稀有气体等
红磷
五氧化二磷
氧气
红磷质量 + 氧气质量 = 五氧化二磷质量
【实验原理】
铁钉与硫酸铜溶液反应
【实验步骤】
铁+ 硫酸铜 铜+ 硫酸亚铁
实验与探究二
1.把天平调节平衡;
2.取一锥形瓶(或小烧杯)倒入约15mL硫酸铜溶液;
3.把装有硫酸铜溶液的锥形瓶(或小烧杯)和2枚打磨好的铁钉一同称量, 称得反应前总质量m3;
4.把铁钉放入装有硫酸铜溶液的锥形瓶(或小烧杯)中,观察现象;再称得反应后总质量m4, 比较m3和m4的大小。
温馨提示:
1.2枚铁钉用砂纸打磨光亮,用镊子夹取;
2.在反应前称量时,先进行估值,砝码按由大到小的顺序加;反应结束后称量时,保持砝码不动,看天平是否平衡。
实验方案 铁钉与硫酸铜溶液反应
实验现象
反应前总质量(g)
反应后总质量(g)
反应表达式
分析
铁钉表面出现红色物质,溶液由蓝色变为浅绿色。
Fe + CuSO4→FeSO4 + Cu
天平平衡
m3
m4
m3 = m4,反应前后总质量相等
实验方案 实验一 实验二
实验现象
反应前总质量/g
反应后总质量/g
分析
m1
铁钉表面出现红色物质,溶液
由蓝色变为浅绿色;天平平衡
m2
m3
m4
m1=m2 , m3=m4反应前后总质量相等
红磷燃烧产生大量白烟,气球先变大后又缩小;天平平衡
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个定律叫质量守恒定律。
质量守恒定律的内容和理解
参加化学反应
的各物质的
质量总和
反应后生成的各物质的质量总和
关键词:参加、化学反应、质量、总和
1.“参加”意味着不参加反应的物质的质量不能计算在内;不是反应中生成的不能计算在生成物质量内 ;
4.“总和”意味着把反应中出现的所有反应物和生成物的质量都计算在内,特别是气体物质。
3.质量守恒定律的“守恒”,是指质量守恒,而不是体积、分子个数或其他方面的守恒。
2.质量守恒定律适用于所有的化学变化,物理变化不在讨论范围。
把握质量守恒定律应注意几点:
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
质量守恒定律的发现
无论是人工的或是自然的作用都没有创造出什么东西。物质在每一个化学反应前的数量等于反应后的数量,这可以算是一个公理。
《化学纲要》
拉瓦锡及其使用的实验仪器
1774年,拉瓦锡用精确的定量实验研究了氧化汞的分解和合成反应中各物质质量之间的变化关系。他将45.0份质量的氧化汞分解,恰好得到了41.5份质量的汞和3.5份质量的氧气。
实验名称 碳酸钠与盐酸的反应
实验方案(图示表示)
实验现象
实验结论与结果分析
思考:所有化学反应都遵守质量守恒定律吗?
盐酸 + 碳酸钠 → 氯化钠 + 水 +二氧化碳
在敞口容器中反应时,二氧化碳扩散到空气中,使反应后总质量减少。
碳酸钠粉末逐渐消失,有气泡产生
天平指针向右偏,失去平衡
提供的仪器:(1)烧杯、小试管、药匙;(2)小矿泉水瓶、小试管、细线、药匙;(3)小矿泉水瓶、药匙、气球。
实验名称 镁的燃烧
实验现象
实验结论与结果分析
思考:所有化学反应都遵守质量守恒定律吗?
剧烈燃烧,发出耀眼白光, 生成白色固体;
天平失去平衡,指针向右偏。
镁 + 氧气 → 氧化镁
坩埚钳上残留一部分氧化镁;实验过程中随
白烟跑走一部分氧化镁。使反应后总质量减少.
【生活现场】 蜡烛的燃烧、天然气的燃烧、铁生锈等,它们都遵守质量守恒定律吗?
结论:在验证质量守恒定律实验时,如果选择有气体参加反应或者生成的反应时,一定要在密闭容器内进行。
学以致用
下列说法正确的是( )
A.根据质量守恒定律,1L氢气和1L氧气反应能生成2L水
B.蜡烛完全燃烧后,蜡烛没有了,违背了质量守恒定律
C.只有固体、液体间的物质反应才遵守质量守恒定律,如果有气体参加反应,就不遵守
D.铁丝在氧气中燃烧,生成四氧化三铁的质量等于参加反应的铁丝和氧气的质量之和
E.100克冰加热后变成了2克水蒸气和98克水,所以遵循质量守恒定律
为什么化学反应前后的物质的质量总和相等?
想一想:
水通电分解的微观展示
水的电解反应微观分析:
1.反应前后原子的种类、数目不变,分子的种类改变了。
2.化学反应的实质:参加反应的各物质的原子重新组合生成其它物质的过程。
分子
原子
新的分子
新物质
聚集
新物质
被破坏
重新组合
聚集
O
H
H
O
O
O
H
H
H
H
H
H
H
H
H
H
O
O
水分子
氢分子
氧分子
氢原子
氧原子
原子质量
微观
不 变
物质的种类
分子的种类
改变
宏观
可能改变
分子的数目
从微观的角度来解释质量守恒的本质
元素化合价
在化学反应中有六不变、三改变、两个可能改变
元素种类
物质的总质量
原子种类
原子数目
元素质量
质量守恒定律的定量研究对化学科学发展的意义
1、根据质量守恒定律的内容,可以解释反应前后物质的质量变化及用质量差确定某反应物或生成物的质量。
2、根据质量守恒定律,化学反应前后元素的种类和质量不变,由此可以推断反应物或生成物的组成元素。
3、根据质量守恒定律:化学反应前后元素的种类和原子的数目相等,推断反应物或生成物的化学式。
4、已知某反应物或生成物质量,根据化学反应中各物质的质量比,可求出生成物或反应物的质量。
【学以致用2】已知:24g镁与16g氧气恰好完全反应,则生成氧化镁的质量为 g.
【学以致用3】蜡烛在空气中燃烧后,生成了二氧化碳(CO2)和水(H2O),试推断蜡烛中一定含有 元素,可能含有 _元素。
【学以致用4】 潜水员所带呼吸面具中的物质与呼出的二氧化碳发生如下反应,2Na2O2+2CO2=2X+O2,其中X的化学式为 ( )
A. Na2O B. NaOH C. Na D. Na2CO3
质量守恒定律的应用
利用质量差确定某反应物或生成物的质量
推断反应物或生成物的组成元素
推断反应物或生成物的化学式
回顾本节课的学习历程,畅谈收获
概念提出
概念深化应用
概念建立
微粒观
定性分析
定量计算
化学反应观
1. C 2. 9.6 14.9 3. B 4.氢、氧
谢 谢
课题1 质量守恒定律
分解 结合
水分子 氢原子 氧原子 氢分子 氧分子
多角度认识化学反应
H2O H2 + O2
通电
1.宏观现象角度: 定性分析
2.微观实质角度:
3.符号表达:
4.反应类型:
质量计算的角度: 定量分析
结论:反应物的总质量小于生成物的总质量
结论:反应物的总质量等于生成物的总质量
文字表达式:汞 + 氧气 氧化汞
密闭装置
敞口装置
点燃
化学史料:科学家对化学变化中质量变化的探究
波义耳的实验(1673年)
拉瓦锡的实验(1777年)
物质在发生化学变化时,反应物的质量总和与生成物的质量总和之间存在什么关系呢?
提出问题
猜想:可能。
反应物的质量总和
生成物的质量总和
大于
等于
小于
证明猜想?
实验与探究一
1.在锥形瓶底部铺一层细沙,上面放一块红磷,用带有导管的橡胶塞盖紧(事先在导管上系一气球),放在天平上称量,记录数据m1;
2.取下锥形瓶,用酒精灯将玻璃导管灼烧至红热,迅速插入锥形瓶中,观察现象;再将其放在天平上称量,记录数据m2。
【实验原理】
红磷燃烧前后质量总和的测定
【实验步骤】
红磷+氧气 五氧化二磷
点燃
1.锥形瓶底部应预先装部分沙子的目的:
防止红磷燃烧时炸裂瓶底。
2.导管口放一气球的目的:平衡装置内压强,防止橡皮塞被弹出。
红磷燃烧前后质量的测定
实验方案 红磷燃烧前后质量的测定
实验现象
反应前总质量(g)
反应后总质量(g)
反应符号表达式
数据分析
红磷燃烧,产生大量白烟,放出热量,气球先变大后又缩小。
点燃
P+O2 P2O5
m1
m2
m1 = m2,反应前后总质量相等
反应前后天平平衡
解释与结论:
红磷燃烧前后的对比:
反应前的物质总质量等于反应后的物质总质量
反应前物质
反应后物质
锥形瓶
细砂
橡皮塞
玻璃管、气球
(空气)
氮气
锥形瓶
细砂
橡皮塞
玻璃管、气球
(剩余气体)
氮气
稀有气体等
稀有气体等
红磷
五氧化二磷
氧气
红磷质量 + 氧气质量 = 五氧化二磷质量
【实验原理】
铁钉与硫酸铜溶液反应
【实验步骤】
铁+ 硫酸铜 铜+ 硫酸亚铁
实验与探究二
1.把天平调节平衡;
2.取一锥形瓶(或小烧杯)倒入约15mL硫酸铜溶液;
3.把装有硫酸铜溶液的锥形瓶(或小烧杯)和2枚打磨好的铁钉一同称量, 称得反应前总质量m3;
4.把铁钉放入装有硫酸铜溶液的锥形瓶(或小烧杯)中,观察现象;再称得反应后总质量m4, 比较m3和m4的大小。
温馨提示:
1.2枚铁钉用砂纸打磨光亮,用镊子夹取;
2.在反应前称量时,先进行估值,砝码按由大到小的顺序加;反应结束后称量时,保持砝码不动,看天平是否平衡。
实验方案 铁钉与硫酸铜溶液反应
实验现象
反应前总质量(g)
反应后总质量(g)
反应表达式
分析
铁钉表面出现红色物质,溶液由蓝色变为浅绿色。
Fe + CuSO4→FeSO4 + Cu
天平平衡
m3
m4
m3 = m4,反应前后总质量相等
实验方案 实验一 实验二
实验现象
反应前总质量/g
反应后总质量/g
分析
m1
铁钉表面出现红色物质,溶液
由蓝色变为浅绿色;天平平衡
m2
m3
m4
m1=m2 , m3=m4反应前后总质量相等
红磷燃烧产生大量白烟,气球先变大后又缩小;天平平衡
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。这个定律叫质量守恒定律。
质量守恒定律的内容和理解
参加化学反应
的各物质的
质量总和
反应后生成的各物质的质量总和
关键词:参加、化学反应、质量、总和
1.“参加”意味着不参加反应的物质的质量不能计算在内;不是反应中生成的不能计算在生成物质量内 ;
4.“总和”意味着把反应中出现的所有反应物和生成物的质量都计算在内,特别是气体物质。
3.质量守恒定律的“守恒”,是指质量守恒,而不是体积、分子个数或其他方面的守恒。
2.质量守恒定律适用于所有的化学变化,物理变化不在讨论范围。
把握质量守恒定律应注意几点:
参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
质量守恒定律的发现
无论是人工的或是自然的作用都没有创造出什么东西。物质在每一个化学反应前的数量等于反应后的数量,这可以算是一个公理。
《化学纲要》
拉瓦锡及其使用的实验仪器
1774年,拉瓦锡用精确的定量实验研究了氧化汞的分解和合成反应中各物质质量之间的变化关系。他将45.0份质量的氧化汞分解,恰好得到了41.5份质量的汞和3.5份质量的氧气。
实验名称 碳酸钠与盐酸的反应
实验方案(图示表示)
实验现象
实验结论与结果分析
思考:所有化学反应都遵守质量守恒定律吗?
盐酸 + 碳酸钠 → 氯化钠 + 水 +二氧化碳
在敞口容器中反应时,二氧化碳扩散到空气中,使反应后总质量减少。
碳酸钠粉末逐渐消失,有气泡产生
天平指针向右偏,失去平衡
提供的仪器:(1)烧杯、小试管、药匙;(2)小矿泉水瓶、小试管、细线、药匙;(3)小矿泉水瓶、药匙、气球。
实验名称 镁的燃烧
实验现象
实验结论与结果分析
思考:所有化学反应都遵守质量守恒定律吗?
剧烈燃烧,发出耀眼白光, 生成白色固体;
天平失去平衡,指针向右偏。
镁 + 氧气 → 氧化镁
坩埚钳上残留一部分氧化镁;实验过程中随
白烟跑走一部分氧化镁。使反应后总质量减少.
【生活现场】 蜡烛的燃烧、天然气的燃烧、铁生锈等,它们都遵守质量守恒定律吗?
结论:在验证质量守恒定律实验时,如果选择有气体参加反应或者生成的反应时,一定要在密闭容器内进行。
学以致用
下列说法正确的是( )
A.根据质量守恒定律,1L氢气和1L氧气反应能生成2L水
B.蜡烛完全燃烧后,蜡烛没有了,违背了质量守恒定律
C.只有固体、液体间的物质反应才遵守质量守恒定律,如果有气体参加反应,就不遵守
D.铁丝在氧气中燃烧,生成四氧化三铁的质量等于参加反应的铁丝和氧气的质量之和
E.100克冰加热后变成了2克水蒸气和98克水,所以遵循质量守恒定律
为什么化学反应前后的物质的质量总和相等?
想一想:
水通电分解的微观展示
水的电解反应微观分析:
1.反应前后原子的种类、数目不变,分子的种类改变了。
2.化学反应的实质:参加反应的各物质的原子重新组合生成其它物质的过程。
分子
原子
新的分子
新物质
聚集
新物质
被破坏
重新组合
聚集
O
H
H
O
O
O
H
H
H
H
H
H
H
H
H
H
O
O
水分子
氢分子
氧分子
氢原子
氧原子
原子质量
微观
不 变
物质的种类
分子的种类
改变
宏观
可能改变
分子的数目
从微观的角度来解释质量守恒的本质
元素化合价
在化学反应中有六不变、三改变、两个可能改变
元素种类
物质的总质量
原子种类
原子数目
元素质量
质量守恒定律的定量研究对化学科学发展的意义
1、根据质量守恒定律的内容,可以解释反应前后物质的质量变化及用质量差确定某反应物或生成物的质量。
2、根据质量守恒定律,化学反应前后元素的种类和质量不变,由此可以推断反应物或生成物的组成元素。
3、根据质量守恒定律:化学反应前后元素的种类和原子的数目相等,推断反应物或生成物的化学式。
4、已知某反应物或生成物质量,根据化学反应中各物质的质量比,可求出生成物或反应物的质量。
【学以致用2】已知:24g镁与16g氧气恰好完全反应,则生成氧化镁的质量为 g.
【学以致用3】蜡烛在空气中燃烧后,生成了二氧化碳(CO2)和水(H2O),试推断蜡烛中一定含有 元素,可能含有 _元素。
【学以致用4】 潜水员所带呼吸面具中的物质与呼出的二氧化碳发生如下反应,2Na2O2+2CO2=2X+O2,其中X的化学式为 ( )
A. Na2O B. NaOH C. Na D. Na2CO3
质量守恒定律的应用
利用质量差确定某反应物或生成物的质量
推断反应物或生成物的组成元素
推断反应物或生成物的化学式
回顾本节课的学习历程,畅谈收获
概念提出
概念深化应用
概念建立
微粒观
定性分析
定量计算
化学反应观
1. C 2. 9.6 14.9 3. B 4.氢、氧
谢 谢
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
