西藏自治区山南三高2021-2022学年高二上学期期中备考化学试卷(A卷)(Word版含答案)
文档属性
| 名称 | 西藏自治区山南三高2021-2022学年高二上学期期中备考化学试卷(A卷)(Word版含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 368.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-12 00:00:00 | ||
图片预览



文档简介
山南三高2021-2022学年上学期高二期中备考卷
化 学 (A)
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
第Ⅰ卷(选择题)
一、选择题:本大题共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列生活现象中,用化学原理解释正确的是
A.某雨水样品采集后放置一段时间,pH减小,是因为水中溶解了更多的CO2
B.流感疫苗需冷藏运输,是为了使蛋白质失去活性延长保质期
C.某胃药的主要成分为Al(OH)3,服药期间不宜饮醋,避免中和Al(OH)3降低药性
D.用食醋除去水壶中的水垢,其反应的离子方程式为:2H++CO=H2O+CO2↑
2.下列有关浓度与化学反应速率的说法正确的是
A.增大反应物浓度导致反应速率加快,是因为增大了活化分子百分数
B.对于任何化学反应,反应物浓度增大,反应速率一定加快
C.通常情况下,锌和盐酸反应时加入浓氯化锌溶液,可以加快反应速率
D.对于某可逆反应,只增大生成物浓度,逆反应速率会明显加快
3.下列有关反应热和能量的说法正确的是
A.热化学方程式中,如果没有注明温度和压强,则表示的反应热是在标况下测得的
B.化学能:2mol H原子>1mol H2分子
C.根据能量守恒定律,反应物总能量之和等于生成物总能量之和
D.运用盖斯定律也无法计算碳不完全燃烧时的反应热
4.能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是
A.向水中加入少量NaHSO4 B.将纯水加热至100℃
C.向水中投入少量的钾 D.向水中加食盐晶体
5.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.水电离的c(H+)=1×10-12mol/L的溶液中:K+、Na+、Cl-、HCO
B.1.0 mol/L的HCl溶液:K+、Fe3+、NO、Cl-
C.在c(OH-)∶c(H+)=1×1012的溶液:Na+、Ca2+、Cl-、K+
D.滴入紫色石蕊试剂变红色的溶液:Na+、CO、NO、SiO
6.已知某可逆反应A2(g)+2B2(s)2AB2(g)的能量变化如图所示,下列有关叙述中正确的是
A.此反应正反应在低温下可以自发进行
B.该反应的反应热ΔH=-(E1-E2)kJ/mol
C.该反应正反应的活化能大于逆反应的活化能
D.该反应中,反应物的键能总和小于生成物的键能总和
7.一定温度下,将纯净的氨基甲酸铵(NH2COONH4)置于真空密闭恒容容器中(固体试样体积忽略不计)达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g)。下列可以判断该反应达到化学平衡状态的是
A.气体的总质量保持不变 B.NH3与CO2的质量比保持不变
C.2v(NH3)=v(CO2) D.混合气体的平均相对分子质量不变
8.常温下,下列有关pH的说法正确的是
A.要使pH=5的CH3COOH溶液pH值增大3,可用加水稀释的方法
B.pH相同的HCl溶液和CH3COOH溶液,后者中和消耗NaOH的物质的量大
C.甲溶液的pH=4,乙溶液的pH=5,两溶液中c(H+)之比c(H+)甲∶c(H+)乙为1∶10
D.pH=1的HNO3溶液中,水电离出来的c(H+)=1×10-13mol/L
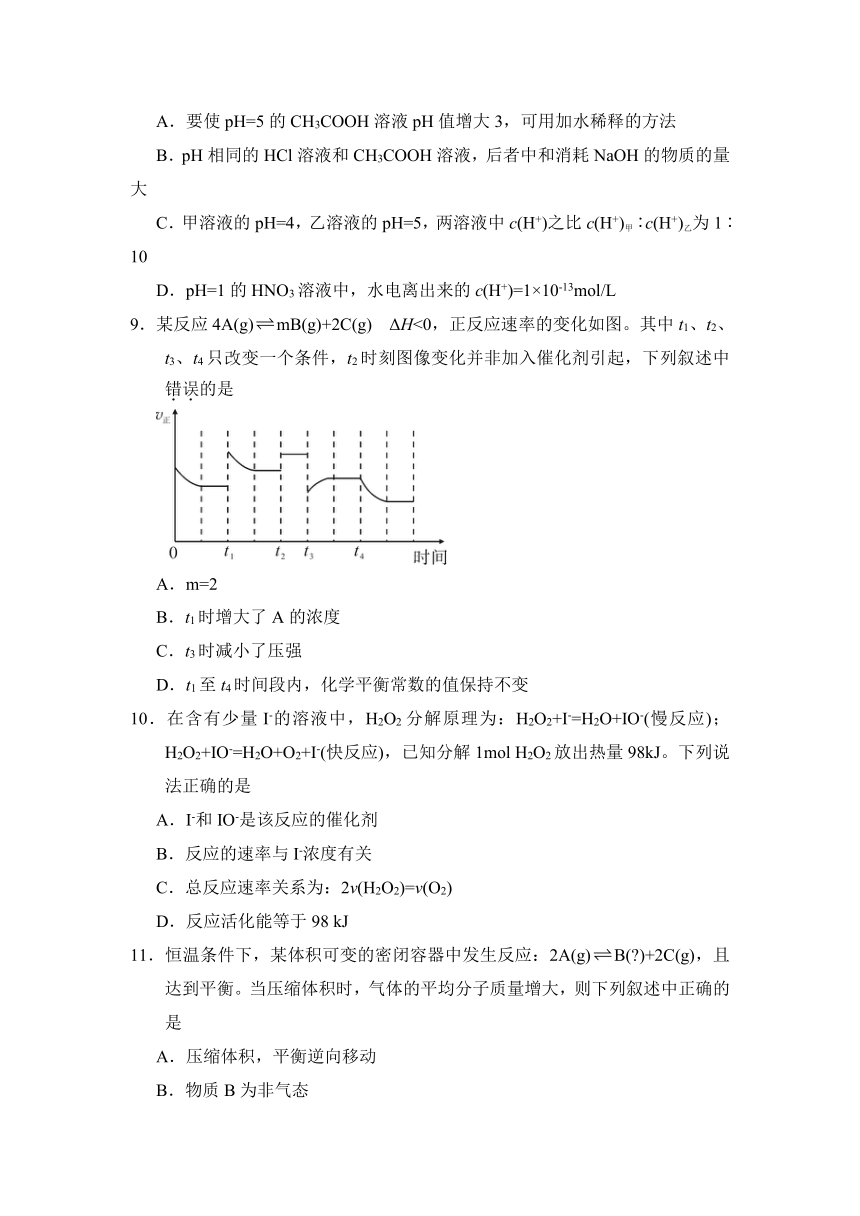
9.某反应4A(g)mB(g)+2C(g) ΔH<0,正反应速率的变化如图。其中t1、t2、t3、t4只改变一个条件,t2时刻图像变化并非加入催化剂引起,下列叙述中错误的是
A.m=2
B.t1时增大了A的浓度
C.t3时减小了压强
D.t1至t4时间段内,化学平衡常数的值保持不变
10.在含有少量I-的溶液中,H2O2分解原理为:H2O2+I-=H2O+IO-(慢反应);H2O2+IO-=H2O+O2+I-(快反应),已知分解1mol H2O2放出热量98kJ。下列说法正确的是
A.I-和IO-是该反应的催化剂
B.反应的速率与I-浓度有关
C.总反应速率关系为:2v(H2O2)=v(O2)
D.反应活化能等于98 kJ
11.恒温条件下,某体积可变的密闭容器中发生反应:2A(g)B( )+2C(g),且达到平衡。当压缩体积时,气体的平均分子质量增大,则下列叙述中正确的是
A.压缩体积,平衡逆向移动
B.物质B为非气态
C.若充入惰性气体,正、逆反应速率都会增大
D.若往容器中加入更多的C物质,化学平衡常数会变大
12.下列说法不正确的是
A.向CH3COOH溶液中加入少量CH3COONa固体,电离常数不变
B.pH相同的氨水和氢氧化钠加水稀释相同倍数后,c(NH)>c(Na+)
C.同温下,强酸溶液的pH不一定小于弱酸溶液的pH
D.足量的锌分别与等体积等浓度的稀硫酸和醋酸完全反应,在相同条件下产生的氢气体积相同
13.只改变一个条件,化学反应aA(g)+B(g)cC(g)的变化图像如下,其中表示平衡转化率,下列说法正确的是
A.反应Ⅰ中,若p1>p2,则此反应的ΔS>0
B.反应Ⅱ中,T1温度下B的转化率高于T2温度下B的转化率
C.反应Ⅲ中,若T1>T2,则该反应在一定条件下能自发进行
D.反应Ⅳ中,该反应正反应为吸热反应
14.一定温度下,已知0.1 mol/L的氨水溶液中存在电离平衡:NH3·H2ONH+OH-,对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.对氨水溶液加强热,平衡向正反应方向移动
C.0.1 mol/L的氨水溶液的pH小于1 mol/L的氨水溶液的pH
D.加入少量NH4Cl固体,平衡向正反应方向移动
15.一定温度下,将2 mol A和2 mol B两种气体混合于固定容积为2L的密闭容器中,发生反应: 2A(g)+B(g)xC(g)+2D(s)。2min末该反应达到平衡,此时剩余1.2 mol B,并测得C的浓度为1.2 mol/L。下列判断正确的是
A.D能表示的平均反应速率为0.4mol/(L·min)
B.A的转化率是40%
C.该条件下此反应的化学平衡常数约为0.72
D.若混合气体的密度保持不变,该反应达到平衡状态
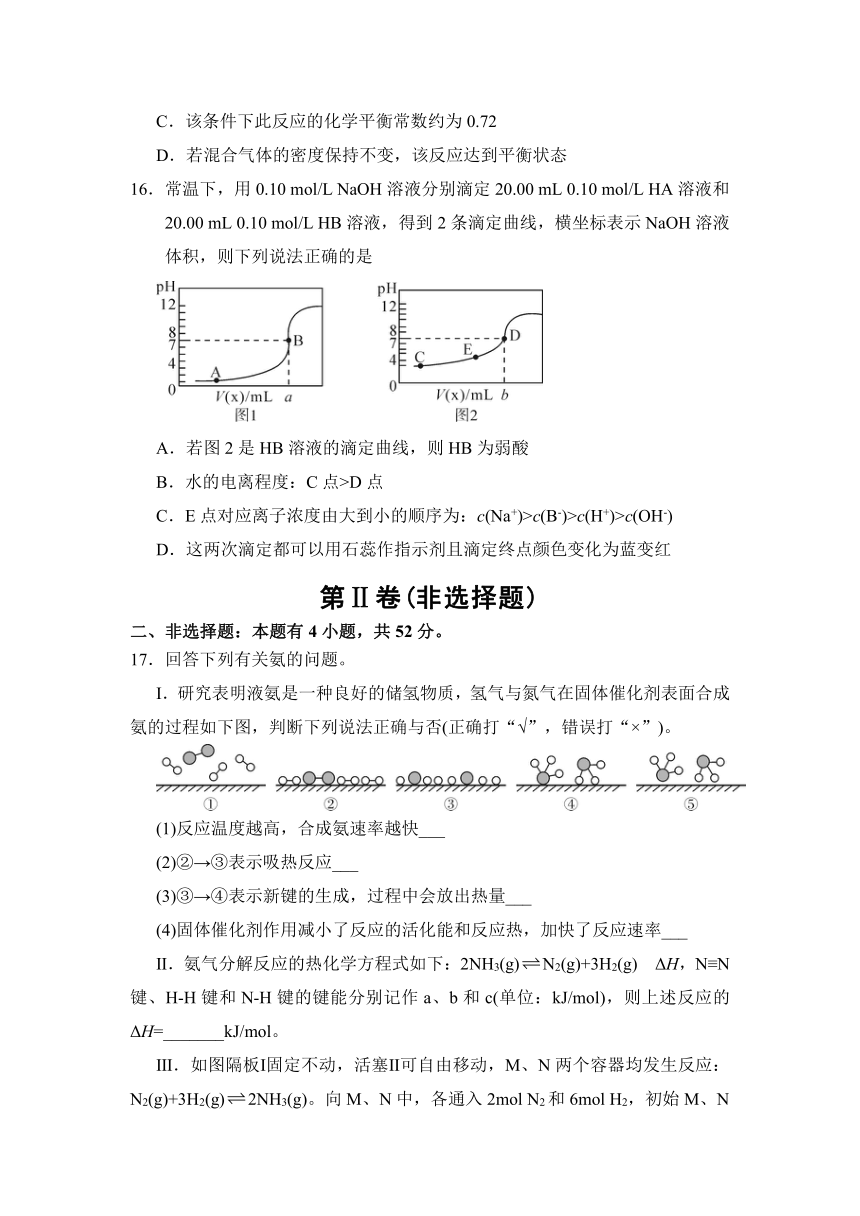
16.常温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL 0.10 mol/L HA溶液和20.00 mL 0.10 mol/L HB溶液,得到2条滴定曲线,横坐标表示NaOH溶液体积,则下列说法正确的是
A.若图2是HB溶液的滴定曲线,则HB为弱酸
B.水的电离程度:C点>D点
C.E点对应离子浓度由大到小的顺序为:c(Na+)>c(B-)>c(H+)>c(OH-)
D.这两次滴定都可以用石蕊作指示剂且滴定终点颜色变化为蓝变红
第Ⅱ卷(非选择题)
二、非选择题:本题有4小题,共52分。
17.回答下列有关氨的问题。
Ⅰ.研究表明液氨是一种良好的储氢物质,氢气与氮气在固体催化剂表面合成氨的过程如下图,判断下列说法正确与否(正确打“√”,错误打“×”)。
(1)反应温度越高,合成氨速率越快___
(2)②→③表示吸热反应___
(3)③→④表示新键的生成,过程中会放出热量___
(4)固体催化剂作用减小了反应的活化能和反应热,加快了反应速率___
Ⅱ.氨气分解反应的热化学方程式如下:2NH3(g)N2(g)+3H2(g) ΔH,N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ/mol),则上述反应的ΔH=_______kJ/mol。
Ⅲ.如图隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器均发生反应:N2(g)+3H2(g)2NH3(g)。向M、N中,各通入2mol N2和6mol H2,初始M、N容积相同,并保持温度不变。则达平衡时H2的转化率α(H2)为M_______N(填“>”“<”或“=”)。
IV.N2O4与NO2之间存在反应N2O4(g)2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
(1)图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,计算该温度下反应的平衡常数Kp=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)由图推测N2O4(g)2NO2(g)是吸热反应还是放热反应,说明理由:_______。若要提高N2O4转化率,除改变反应温度外,其他措施有_______(任写一条)。
18.我国汽车尾气和燃煤尾气的净化取得一定成效。
(1)汽车尾气净化原理2NO(g)+2CO(g)2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图1所示。
据此判断:
①该反应的ΔH_______0(填“>”或“<”)。
②T温度下,0~2s内的平均反应速率υ(H2)=_______。
③当固体催化剂的质量一定时,将催化剂磨成粉末,则反应速率_______(填“增大”“减小”或“不变”,下同),CO转化率_______。
④若在绝热、恒容的密闭体系中充入一定量的NO和CO气体进行该反应,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_______(填字母序号)。
(2)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867.0 kJ mol 1;2NO2(g) N2O4(g) ΔH=-56.9 kJ mol 1,写出CH4催化还原N2O4(g)生成N2、CO2和H2O(g)的热化学方程式:_______。
(3)工业上用CO2和H2反应合成二甲醚:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ mol 1,一定条件下,上述反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_______(填字母序号)。
a.逆反应速率先增大后减小
b.H2的转化率增大
c.反应物的体积百分含量减小
d.容器中值变小
19.回答下列有关醋酸的问题。
Ⅰ.在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如下图所示:
(1)加水量为0时,导电能力也为0,请解释原因:_______。
(2)a、b、c三点醋酸电离程度由大到小的顺序为_______;a、b、c三点对应的溶液中,pH最小的是_______;a、b、c三点对应的溶液中,水的电离程度最大的是_______。
(3)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是_______。
A.c(H+) B.H+个数 C.CH3COOH分子数 D.
Ⅱ.常温下,有HCl、H2SO4、CH3COOH三种溶液,请用化学符号填空:
(1)等体积、等物质的量浓度三种酸溶液,中和NaOH的能力由大到小的顺序是_______。
(2)当三种酸溶液c(H+)相同时,写出物质的量浓度最大的酸与氢氧化钾反应的离子方程式_______。
(3)pH=1的HCl溶液与0.04 mol/L的Ba(OH)2溶液等体积混合后溶液pH是_______。
20.氧化还原滴定法与酸碱中和滴定法类似,现测定实验室中Na2S2O3溶液的物质的量浓度。
已知:①2Na2S2O3+I2=2NaI+Na2S4O6;②Na2S2O3溶液中c(H+)Ⅰ.实验步骤
(1)用_______(填仪器名称)量取10.00mL Na2S2O3溶液于锥形瓶中,滴入2-3滴_______(填指示剂名称)。
(2)用洁净的酸式滴定管,装0.01 mol/L I2溶液后读数,如果液面位置如图所示,则此时的读数为_______mL。
(3)滴定终点的判断现象为_______。
(4)达到滴定终点即停止滴定,记录I2溶液的体积,重复滴定3次。
(5)实验记录
滴定次数 1 2 3
开始读数(mL) 0.10 1.85 0.00
结束读数(mL) 19.20 20.75 24.06
Ⅱ.数据处理与讨论
(1)按所得数据,可得c(Na2S2O3)=_______。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是_______(填写序号)。
a.酸式滴定管在滴定时未用标准I2溶液润洗
b.酸式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测Na2S2O3溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.达到滴定终点时,仰视读数
2021-2022学年上学期高二期中备考金卷答案
化 学 (A)
1.【答案】C
2.【答案】D
3.【答案】B
4.【答案】A
5.【答案】B
6.【答案】C
7.【答案】A
8.【答案】D
9.【答案】C
10.【答案】B
11.【答案】A
12.【答案】D
13.【答案】C
14.【答案】C
15.【答案】D
16.【答案】A
17.【答案】错误 错误 正确 错误 6c-a-3b < 115.2 kPa 该反应为吸热反应,因为温度升高,α(N2O4)增大,说明平衡右移 减小体系压强或移出NO2
18.【答案】< 0.05 mol L 1 s 1 增大 不变 bd CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-810.1 kJ mol 1 b
19.【答案】冰醋酸的构成微粒为分子,没有带电荷微粒,所以不导电 c>b>a b c B、D H2SO4>HCl=CH3COOH CH3COOH+OH-=CH3COO-+H2O 2
20.【答案】碱式滴定管 淀粉溶液 0.60 当滴入最后一滴I2溶液时,溶液由无色变蓝色,且半分钟不变色 0.038mol/L a、b、e
化 学 (A)
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试题卷和答题卡上,并将准考证号条形码粘贴在答题卡上的指定位置。
2.选择题的作答:每小题选出答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑,写在试题卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用签字笔直接答在答题卡上对应的答题区域内。写在试题卷、草稿纸和答题卡上的非答题区域均无效。
4.考试结束后,请将本试题卷和答题卡一并上交。
第Ⅰ卷(选择题)
一、选择题:本大题共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列生活现象中,用化学原理解释正确的是
A.某雨水样品采集后放置一段时间,pH减小,是因为水中溶解了更多的CO2
B.流感疫苗需冷藏运输,是为了使蛋白质失去活性延长保质期
C.某胃药的主要成分为Al(OH)3,服药期间不宜饮醋,避免中和Al(OH)3降低药性
D.用食醋除去水壶中的水垢,其反应的离子方程式为:2H++CO=H2O+CO2↑
2.下列有关浓度与化学反应速率的说法正确的是
A.增大反应物浓度导致反应速率加快,是因为增大了活化分子百分数
B.对于任何化学反应,反应物浓度增大,反应速率一定加快
C.通常情况下,锌和盐酸反应时加入浓氯化锌溶液,可以加快反应速率
D.对于某可逆反应,只增大生成物浓度,逆反应速率会明显加快
3.下列有关反应热和能量的说法正确的是
A.热化学方程式中,如果没有注明温度和压强,则表示的反应热是在标况下测得的
B.化学能:2mol H原子>1mol H2分子
C.根据能量守恒定律,反应物总能量之和等于生成物总能量之和
D.运用盖斯定律也无法计算碳不完全燃烧时的反应热
4.能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是
A.向水中加入少量NaHSO4 B.将纯水加热至100℃
C.向水中投入少量的钾 D.向水中加食盐晶体
5.常温下,下列各组离子在指定溶液中一定能大量共存的是
A.水电离的c(H+)=1×10-12mol/L的溶液中:K+、Na+、Cl-、HCO
B.1.0 mol/L的HCl溶液:K+、Fe3+、NO、Cl-
C.在c(OH-)∶c(H+)=1×1012的溶液:Na+、Ca2+、Cl-、K+
D.滴入紫色石蕊试剂变红色的溶液:Na+、CO、NO、SiO
6.已知某可逆反应A2(g)+2B2(s)2AB2(g)的能量变化如图所示,下列有关叙述中正确的是
A.此反应正反应在低温下可以自发进行
B.该反应的反应热ΔH=-(E1-E2)kJ/mol
C.该反应正反应的活化能大于逆反应的活化能
D.该反应中,反应物的键能总和小于生成物的键能总和
7.一定温度下,将纯净的氨基甲酸铵(NH2COONH4)置于真空密闭恒容容器中(固体试样体积忽略不计)达到分解平衡:NH2COONH4(s)2NH3(g)+CO2(g)。下列可以判断该反应达到化学平衡状态的是
A.气体的总质量保持不变 B.NH3与CO2的质量比保持不变
C.2v(NH3)=v(CO2) D.混合气体的平均相对分子质量不变
8.常温下,下列有关pH的说法正确的是
A.要使pH=5的CH3COOH溶液pH值增大3,可用加水稀释的方法
B.pH相同的HCl溶液和CH3COOH溶液,后者中和消耗NaOH的物质的量大
C.甲溶液的pH=4,乙溶液的pH=5,两溶液中c(H+)之比c(H+)甲∶c(H+)乙为1∶10
D.pH=1的HNO3溶液中,水电离出来的c(H+)=1×10-13mol/L
9.某反应4A(g)mB(g)+2C(g) ΔH<0,正反应速率的变化如图。其中t1、t2、t3、t4只改变一个条件,t2时刻图像变化并非加入催化剂引起,下列叙述中错误的是
A.m=2
B.t1时增大了A的浓度
C.t3时减小了压强
D.t1至t4时间段内,化学平衡常数的值保持不变
10.在含有少量I-的溶液中,H2O2分解原理为:H2O2+I-=H2O+IO-(慢反应);H2O2+IO-=H2O+O2+I-(快反应),已知分解1mol H2O2放出热量98kJ。下列说法正确的是
A.I-和IO-是该反应的催化剂
B.反应的速率与I-浓度有关
C.总反应速率关系为:2v(H2O2)=v(O2)
D.反应活化能等于98 kJ
11.恒温条件下,某体积可变的密闭容器中发生反应:2A(g)B( )+2C(g),且达到平衡。当压缩体积时,气体的平均分子质量增大,则下列叙述中正确的是
A.压缩体积,平衡逆向移动
B.物质B为非气态
C.若充入惰性气体,正、逆反应速率都会增大
D.若往容器中加入更多的C物质,化学平衡常数会变大
12.下列说法不正确的是
A.向CH3COOH溶液中加入少量CH3COONa固体,电离常数不变
B.pH相同的氨水和氢氧化钠加水稀释相同倍数后,c(NH)>c(Na+)
C.同温下,强酸溶液的pH不一定小于弱酸溶液的pH
D.足量的锌分别与等体积等浓度的稀硫酸和醋酸完全反应,在相同条件下产生的氢气体积相同
13.只改变一个条件,化学反应aA(g)+B(g)cC(g)的变化图像如下,其中表示平衡转化率,下列说法正确的是
A.反应Ⅰ中,若p1>p2,则此反应的ΔS>0
B.反应Ⅱ中,T1温度下B的转化率高于T2温度下B的转化率
C.反应Ⅲ中,若T1>T2,则该反应在一定条件下能自发进行
D.反应Ⅳ中,该反应正反应为吸热反应
14.一定温度下,已知0.1 mol/L的氨水溶液中存在电离平衡:NH3·H2ONH+OH-,对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.对氨水溶液加强热,平衡向正反应方向移动
C.0.1 mol/L的氨水溶液的pH小于1 mol/L的氨水溶液的pH
D.加入少量NH4Cl固体,平衡向正反应方向移动
15.一定温度下,将2 mol A和2 mol B两种气体混合于固定容积为2L的密闭容器中,发生反应: 2A(g)+B(g)xC(g)+2D(s)。2min末该反应达到平衡,此时剩余1.2 mol B,并测得C的浓度为1.2 mol/L。下列判断正确的是
A.D能表示的平均反应速率为0.4mol/(L·min)
B.A的转化率是40%
C.该条件下此反应的化学平衡常数约为0.72
D.若混合气体的密度保持不变,该反应达到平衡状态
16.常温下,用0.10 mol/L NaOH溶液分别滴定20.00 mL 0.10 mol/L HA溶液和20.00 mL 0.10 mol/L HB溶液,得到2条滴定曲线,横坐标表示NaOH溶液体积,则下列说法正确的是
A.若图2是HB溶液的滴定曲线,则HB为弱酸
B.水的电离程度:C点>D点
C.E点对应离子浓度由大到小的顺序为:c(Na+)>c(B-)>c(H+)>c(OH-)
D.这两次滴定都可以用石蕊作指示剂且滴定终点颜色变化为蓝变红
第Ⅱ卷(非选择题)
二、非选择题:本题有4小题,共52分。
17.回答下列有关氨的问题。
Ⅰ.研究表明液氨是一种良好的储氢物质,氢气与氮气在固体催化剂表面合成氨的过程如下图,判断下列说法正确与否(正确打“√”,错误打“×”)。
(1)反应温度越高,合成氨速率越快___
(2)②→③表示吸热反应___
(3)③→④表示新键的生成,过程中会放出热量___
(4)固体催化剂作用减小了反应的活化能和反应热,加快了反应速率___
Ⅱ.氨气分解反应的热化学方程式如下:2NH3(g)N2(g)+3H2(g) ΔH,N≡N键、H-H键和N-H键的键能分别记作a、b和c(单位:kJ/mol),则上述反应的ΔH=_______kJ/mol。
Ⅲ.如图隔板Ⅰ固定不动,活塞Ⅱ可自由移动,M、N两个容器均发生反应:N2(g)+3H2(g)2NH3(g)。向M、N中,各通入2mol N2和6mol H2,初始M、N容积相同,并保持温度不变。则达平衡时H2的转化率α(H2)为M_______N(填“>”“<”或“=”)。
IV.N2O4与NO2之间存在反应N2O4(g)2NO2(g)。将一定量的N2O4放入恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度变化如图所示。
(1)图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,计算该温度下反应的平衡常数Kp=_______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(2)由图推测N2O4(g)2NO2(g)是吸热反应还是放热反应,说明理由:_______。若要提高N2O4转化率,除改变反应温度外,其他措施有_______(任写一条)。
18.我国汽车尾气和燃煤尾气的净化取得一定成效。
(1)汽车尾气净化原理2NO(g)+2CO(g)2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图1所示。
据此判断:
①该反应的ΔH_______0(填“>”或“<”)。
②T温度下,0~2s内的平均反应速率υ(H2)=_______。
③当固体催化剂的质量一定时,将催化剂磨成粉末,则反应速率_______(填“增大”“减小”或“不变”,下同),CO转化率_______。
④若在绝热、恒容的密闭体系中充入一定量的NO和CO气体进行该反应,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是_______(填字母序号)。
(2)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-867.0 kJ mol 1;2NO2(g) N2O4(g) ΔH=-56.9 kJ mol 1,写出CH4催化还原N2O4(g)生成N2、CO2和H2O(g)的热化学方程式:_______。
(3)工业上用CO2和H2反应合成二甲醚:2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) ΔH=-130.8 kJ mol 1,一定条件下,上述反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_______(填字母序号)。
a.逆反应速率先增大后减小
b.H2的转化率增大
c.反应物的体积百分含量减小
d.容器中值变小
19.回答下列有关醋酸的问题。
Ⅰ.在一定温度下,向冰醋酸中加水稀释,溶液导电能力变化情况如下图所示:
(1)加水量为0时,导电能力也为0,请解释原因:_______。
(2)a、b、c三点醋酸电离程度由大到小的顺序为_______;a、b、c三点对应的溶液中,pH最小的是_______;a、b、c三点对应的溶液中,水的电离程度最大的是_______。
(3)在稀释过程中,随着醋酸浓度的降低,下列始终保持增大趋势的量是_______。
A.c(H+) B.H+个数 C.CH3COOH分子数 D.
Ⅱ.常温下,有HCl、H2SO4、CH3COOH三种溶液,请用化学符号填空:
(1)等体积、等物质的量浓度三种酸溶液,中和NaOH的能力由大到小的顺序是_______。
(2)当三种酸溶液c(H+)相同时,写出物质的量浓度最大的酸与氢氧化钾反应的离子方程式_______。
(3)pH=1的HCl溶液与0.04 mol/L的Ba(OH)2溶液等体积混合后溶液pH是_______。
20.氧化还原滴定法与酸碱中和滴定法类似,现测定实验室中Na2S2O3溶液的物质的量浓度。
已知:①2Na2S2O3+I2=2NaI+Na2S4O6;②Na2S2O3溶液中c(H+)
(1)用_______(填仪器名称)量取10.00mL Na2S2O3溶液于锥形瓶中,滴入2-3滴_______(填指示剂名称)。
(2)用洁净的酸式滴定管,装0.01 mol/L I2溶液后读数,如果液面位置如图所示,则此时的读数为_______mL。
(3)滴定终点的判断现象为_______。
(4)达到滴定终点即停止滴定,记录I2溶液的体积,重复滴定3次。
(5)实验记录
滴定次数 1 2 3
开始读数(mL) 0.10 1.85 0.00
结束读数(mL) 19.20 20.75 24.06
Ⅱ.数据处理与讨论
(1)按所得数据,可得c(Na2S2O3)=_______。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是_______(填写序号)。
a.酸式滴定管在滴定时未用标准I2溶液润洗
b.酸式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测Na2S2O3溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
e.达到滴定终点时,仰视读数
2021-2022学年上学期高二期中备考金卷答案
化 学 (A)
1.【答案】C
2.【答案】D
3.【答案】B
4.【答案】A
5.【答案】B
6.【答案】C
7.【答案】A
8.【答案】D
9.【答案】C
10.【答案】B
11.【答案】A
12.【答案】D
13.【答案】C
14.【答案】C
15.【答案】D
16.【答案】A
17.【答案】错误 错误 正确 错误 6c-a-3b < 115.2 kPa 该反应为吸热反应,因为温度升高,α(N2O4)增大,说明平衡右移 减小体系压强或移出NO2
18.【答案】< 0.05 mol L 1 s 1 增大 不变 bd CH4(g)+N2O4(g)=N2(g)+CO2(g)+2H2O(g) ΔH=-810.1 kJ mol 1 b
19.【答案】冰醋酸的构成微粒为分子,没有带电荷微粒,所以不导电 c>b>a b c B、D H2SO4>HCl=CH3COOH CH3COOH+OH-=CH3COO-+H2O 2
20.【答案】碱式滴定管 淀粉溶液 0.60 当滴入最后一滴I2溶液时,溶液由无色变蓝色,且半分钟不变色 0.038mol/L a、b、e
同课章节目录
