10.2 酸和碱的中和反应 (课件30页)
文档属性
| 名称 | 10.2 酸和碱的中和反应 (课件30页) |  | |
| 格式 | ppt | ||
| 文件大小 | 785.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-11 21:36:57 | ||
图片预览











文档简介
(共30张PPT)
酸和碱的中和反应
学习目标:
1、认识中和反应,并写出方程式。
2、了解中和反应的微观实质
3、了解中和反应的用途
酸和碱之间会发生化学反应吗?
提出问题
酸和碱之间 发生化学反应
能
不能
猜想与假设
你用什么方法证明NaOH+HCl 它们之间发生了化学反应呢?
设计方案
分组展示
方案1:在反应完的试液中加入酚酞溶液,证明氢氧化钠是否存在
方案2:在反应完的试液中加入活泼金属,证明盐酸是否存在
方案3:在盐酸中加入石蕊溶液,再逐滴加入氢氧化钠溶液
方案4:在氢氧化钠溶液中加入酚酞溶液,再逐滴加入盐酸
实验方案 实验现象 结论、解释
1、取少量NaOH溶液到烧杯中,滴入1-2滴酚酞溶液,观察现象。
2、逐滴加入盐酸,观察现象
3、用玻璃棒蘸取所得的溶液于酒精灯火焰上蒸发。
溶液变成 色
溶液变成 色
有 出现
溶液显 性
溶液显 性,
说明
实验探究2
1、怎样证明NaOH溶液与稀HCl是否恰好完全反应?
2、实验完毕,在烧杯内剩余物的溶质是什么?是NaOH吗?还是HCl吗?还是其他物质呢?为什么?
分组讨论
1、当酚酞溶液刚刚褪成无色时,恰好反应
2、实验完毕,在烧杯内的溶质的猜想
(1) NaCl、OH-、H+
(2)Na+、Cl-、H2O
学生展示
我们知道了酸和碱确实能发生化学反应,那么在微观里发生了什么变化呢?
提出问题
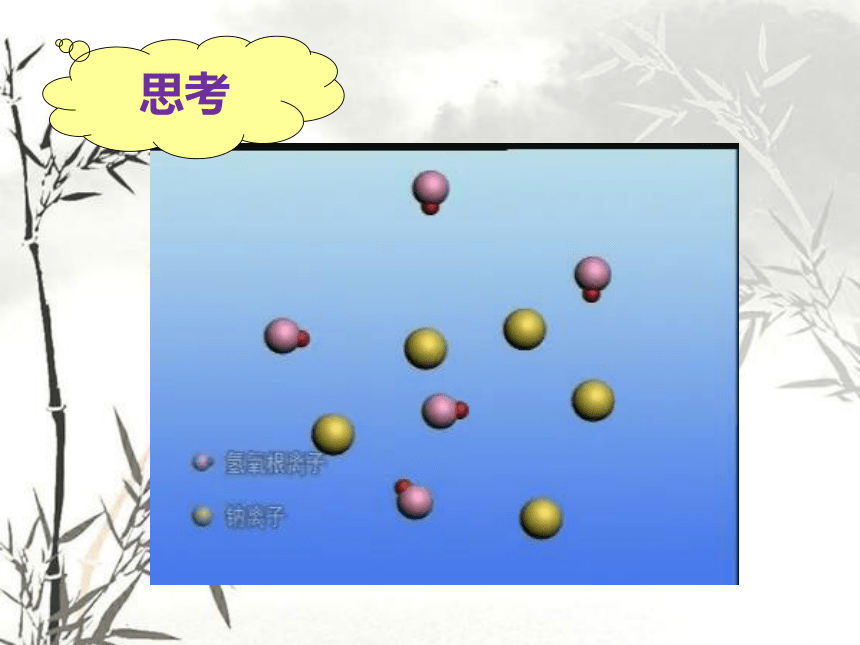
思考
酸和碱发生化学反应的实质是:
酸中的氢离子和碱中的氢氧根离子结合生成了水
学生总结
得出结论
物质类别 构成粒子
酸 氢离子 + 酸根离子
碱 氢氧根离子 + 金属离子
盐
金属离子 + 酸根离子
水
?
HCl+NaOH=NaCl+H2O
酸
碱
盐
水
+
+
=
酸和碱可以发生化学反应
得出结论
中和反应
请你完成下列化学方程式:
Ca(OH)2+2HCl
2NaOH+ H2SO4
课堂测试
完成化学方程式的步骤:
课堂测试
写物质
标组合
写生成
配平
NaOH + HCl
NaCl + H2O
完成
1、农业上,当土壤被酸雨侵蚀后,该怎么办?
2、工业上,工厂排放的含有硫酸的废水是如何处理的?
3、在我们的日常生活中,有哪些和中和反应有关呢?
—阅读思考
你能用化学方程式表示原理吗?
(说明:硫酸型酸雨)
Ca(OH)2
H2SO4
CaSO4
2H2O
+
=
+
熟石灰
处理方法:
可用熟石灰进行中和处理。
你能用微观粒子来解释这个反应吗?
此药中含有氢氧化铝
试写出胃康—U治胃酸过多的原理。
3HCl+Al(OH)3=AlCl3+3H2O
蚊
子
在蚊子的口器中分泌出一种有机酸--蚁酸,在家庭中可用浓肥皂水(显碱性)涂抹可迅速止痒。
教学流程
农业中和土壤酸性
工业处理排放废水
医学治疗胃酸过多
生活中蚊虫叮咬
—总结归纳
请你对这节课的表现做出评价吧!
结束语
1、下列反应中属于中和反应的是( )
A、Zn + 2HCl = ZnCl2 +H2↑
B、CuO + 2HCl = CuCl2+ H2O
C、Ba(OH)2+ H2SO4 = BaSO4 ↓+ 2H2O
D、AgNO3+HCl = AgCl↓ +HNO3
达标检测
达标检测
2、下列物质属于盐的是( )
CuO B.Cu(OH)2 C.CuSO4 D.HCl
3、下列各组物质通常借助指示剂才能证明是否反应的是( )
A、氢氧化铜和稀盐酸
B、石灰石和稀盐酸
C、锌与稀硫酸反应
D、烧碱和稀硫酸
达标检测
4、有些工厂排放的废水中含有硫酸,如果用氨水(NH3·H2O)中和它,能得到一种氮肥硫酸铵[(NH4)2SO4]。试写出反应的化学方程式。
达标检测
5、小松同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记了滴加指示剂。为了确定盐酸与氢氧化钠是否恰好完全反应,小松同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。于是他得出“两种物质已恰好完全中和”的结论。
(1)你认为他得出的结论是否正确 ,
理由: 。
(2)请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全反应。
达标检测
皮蛋(松花蛋)有涩味,如何验证它呈酸性还是碱性,在食用前如何除去涩味?亲自动手试试看。
课外探究
教学反思
本节课我利用了完整的科学探究来进行酸碱中和反应的教学,这样的处理比我原来单纯的说教更易于学生的接受,更能引起学生的思考,拓展学生的思维,更好的提高了学生解决问题的能力。在酸碱反应微观实质的教学中,我回顾了学生原有的酸碱构成微粒的知识了,结合视频,在学生思维中构建中和反应的实质,利用最近发展区理念,学生能自主推测出结论,并能利用结论写出相关的化学方程式,这样的教学比直接灌输更适合学生的思维,更贴切学生为主的教学理念。
酸和碱的中和反应
学习目标:
1、认识中和反应,并写出方程式。
2、了解中和反应的微观实质
3、了解中和反应的用途
酸和碱之间会发生化学反应吗?
提出问题
酸和碱之间 发生化学反应
能
不能
猜想与假设
你用什么方法证明NaOH+HCl 它们之间发生了化学反应呢?
设计方案
分组展示
方案1:在反应完的试液中加入酚酞溶液,证明氢氧化钠是否存在
方案2:在反应完的试液中加入活泼金属,证明盐酸是否存在
方案3:在盐酸中加入石蕊溶液,再逐滴加入氢氧化钠溶液
方案4:在氢氧化钠溶液中加入酚酞溶液,再逐滴加入盐酸
实验方案 实验现象 结论、解释
1、取少量NaOH溶液到烧杯中,滴入1-2滴酚酞溶液,观察现象。
2、逐滴加入盐酸,观察现象
3、用玻璃棒蘸取所得的溶液于酒精灯火焰上蒸发。
溶液变成 色
溶液变成 色
有 出现
溶液显 性
溶液显 性,
说明
实验探究2
1、怎样证明NaOH溶液与稀HCl是否恰好完全反应?
2、实验完毕,在烧杯内剩余物的溶质是什么?是NaOH吗?还是HCl吗?还是其他物质呢?为什么?
分组讨论
1、当酚酞溶液刚刚褪成无色时,恰好反应
2、实验完毕,在烧杯内的溶质的猜想
(1) NaCl、OH-、H+
(2)Na+、Cl-、H2O
学生展示
我们知道了酸和碱确实能发生化学反应,那么在微观里发生了什么变化呢?
提出问题
思考
酸和碱发生化学反应的实质是:
酸中的氢离子和碱中的氢氧根离子结合生成了水
学生总结
得出结论
物质类别 构成粒子
酸 氢离子 + 酸根离子
碱 氢氧根离子 + 金属离子
盐
金属离子 + 酸根离子
水
?
HCl+NaOH=NaCl+H2O
酸
碱
盐
水
+
+
=
酸和碱可以发生化学反应
得出结论
中和反应
请你完成下列化学方程式:
Ca(OH)2+2HCl
2NaOH+ H2SO4
课堂测试
完成化学方程式的步骤:
课堂测试
写物质
标组合
写生成
配平
NaOH + HCl
NaCl + H2O
完成
1、农业上,当土壤被酸雨侵蚀后,该怎么办?
2、工业上,工厂排放的含有硫酸的废水是如何处理的?
3、在我们的日常生活中,有哪些和中和反应有关呢?
—阅读思考
你能用化学方程式表示原理吗?
(说明:硫酸型酸雨)
Ca(OH)2
H2SO4
CaSO4
2H2O
+
=
+
熟石灰
处理方法:
可用熟石灰进行中和处理。
你能用微观粒子来解释这个反应吗?
此药中含有氢氧化铝
试写出胃康—U治胃酸过多的原理。
3HCl+Al(OH)3=AlCl3+3H2O
蚊
子
在蚊子的口器中分泌出一种有机酸--蚁酸,在家庭中可用浓肥皂水(显碱性)涂抹可迅速止痒。
教学流程
农业中和土壤酸性
工业处理排放废水
医学治疗胃酸过多
生活中蚊虫叮咬
—总结归纳
请你对这节课的表现做出评价吧!
结束语
1、下列反应中属于中和反应的是( )
A、Zn + 2HCl = ZnCl2 +H2↑
B、CuO + 2HCl = CuCl2+ H2O
C、Ba(OH)2+ H2SO4 = BaSO4 ↓+ 2H2O
D、AgNO3+HCl = AgCl↓ +HNO3
达标检测
达标检测
2、下列物质属于盐的是( )
CuO B.Cu(OH)2 C.CuSO4 D.HCl
3、下列各组物质通常借助指示剂才能证明是否反应的是( )
A、氢氧化铜和稀盐酸
B、石灰石和稀盐酸
C、锌与稀硫酸反应
D、烧碱和稀硫酸
达标检测
4、有些工厂排放的废水中含有硫酸,如果用氨水(NH3·H2O)中和它,能得到一种氮肥硫酸铵[(NH4)2SO4]。试写出反应的化学方程式。
达标检测
5、小松同学在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记了滴加指示剂。为了确定盐酸与氢氧化钠是否恰好完全反应,小松同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色。于是他得出“两种物质已恰好完全中和”的结论。
(1)你认为他得出的结论是否正确 ,
理由: 。
(2)请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全反应。
达标检测
皮蛋(松花蛋)有涩味,如何验证它呈酸性还是碱性,在食用前如何除去涩味?亲自动手试试看。
课外探究
教学反思
本节课我利用了完整的科学探究来进行酸碱中和反应的教学,这样的处理比我原来单纯的说教更易于学生的接受,更能引起学生的思考,拓展学生的思维,更好的提高了学生解决问题的能力。在酸碱反应微观实质的教学中,我回顾了学生原有的酸碱构成微粒的知识了,结合视频,在学生思维中构建中和反应的实质,利用最近发展区理念,学生能自主推测出结论,并能利用结论写出相关的化学方程式,这样的教学比直接灌输更适合学生的思维,更贴切学生为主的教学理念。
同课章节目录
