自然界中氮的循环
图片预览




文档简介
自然界中氮的循环
姓名:张丽
学校:肥城市第六高级中学
自然界中氮的循环
【课题】:自然界中氮的循环
【教学目标】:
(一)知识与技能目标
1、了解自然界中的氮循环及人类活动对氮循环的影响;
2、通过了解生物固氮和人工固氮形式,认识N2 、NO 、NO2的性质。
(二)过程与方法目标
培养学生通过观察实验现象,总结分析物质性质的能力。
(三)情感态度与价值观目标
通过介绍合成氨发展的艰辛历程,体会从实验室研究到工业生产的过程,渗透化学与技术关系的教育;
【教学重点、难点】
(一)知识上重点、难点:
重点:N2、氮的氧化物的主要性质;
难点:氮的氧化物的重要性质;
(二)方法上重点、难点
培养学生通过观察实验现象总结分析物质性质的能力。
【教学准备】
(一)学生准备
1、预习第二节——氮的循环
2、查找氮循环的资料,小组合作画出氮循环图示,写出短文。重点说明氮循环中涉及到哪些含氮元素的物质,它们是如何转化的?
(二)教师准备
1、教学媒体、课件;
2、补充实验。
【教学过程】
【引入】在空气中含量最多的元素是什么?这种元素在空气中的含量会不断变化吗?为什么?
氮是地球上含量丰富的一种元素。这节课我们就讲氮的循环。
【展示】图片
【联想 质疑】
雷电交加时,空气中的氮气和有关的含氮化合物发生了哪些化学反应?产生了哪些物质
这些化学反应和所产生的物质对于人类的生产和生活有什么意义
【阅读思考】阅读教材P70并思考下列问题:
1、氮元素在自然界中的存在形式;
2、氮在自然界中循环的基本过程;
3、含氮物质之间通过哪些途径进行相互之间的转化?
4、氮的循环过程中会产生哪些重要物质?
【小组交流】选取二个小组作为代表在课堂上交流。
【点评评价】教师点评并做好表现性评价
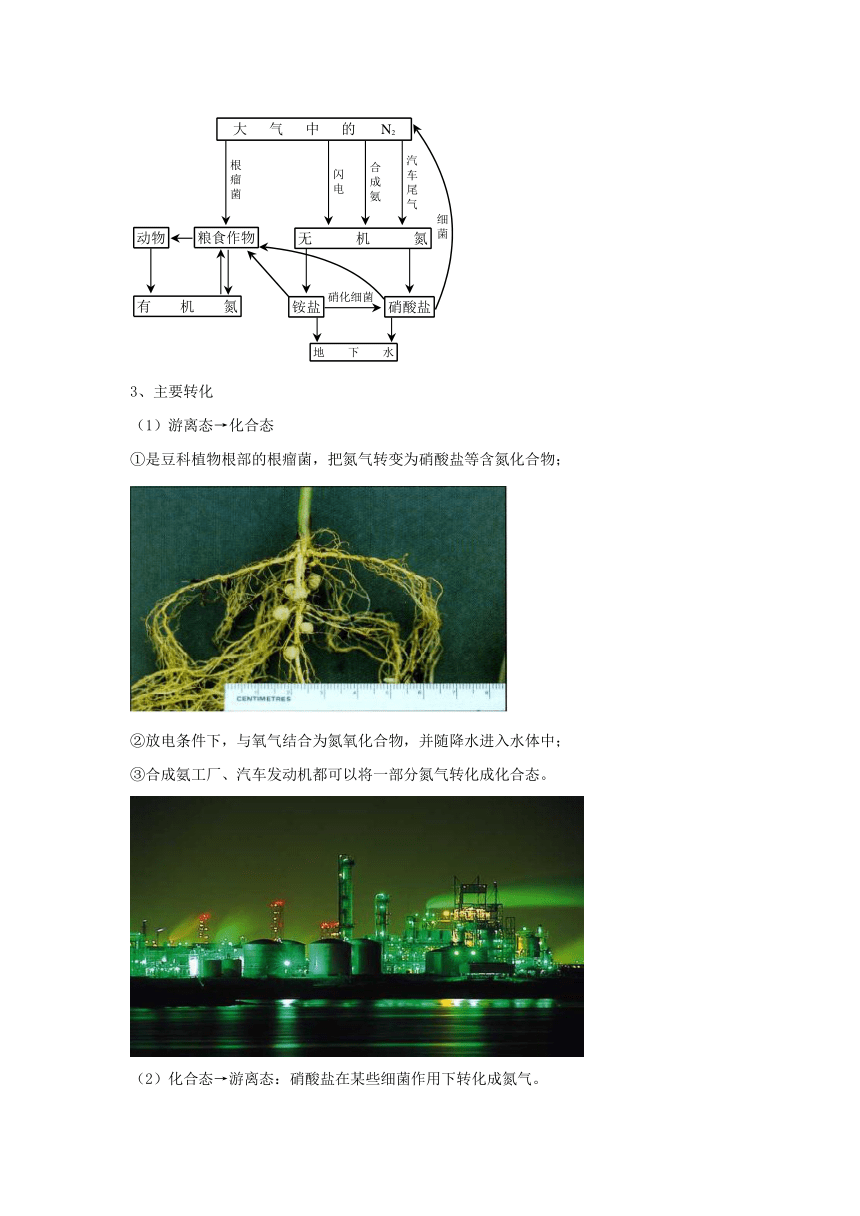
【展示】氮在自然界中的循环和存在形式:
1、氮元素在自然界中的存在形式:
自然界中氮元素存在的形式一种是游离态,如N2;一种是化合态,如铵盐、硝酸盐、氨、蛋白质等。
2、氮在自然界中的循环的基本过程:
3、主要转化
(1)游离态→化合态
①是豆科植物根部的根瘤菌,把氮气转变为硝酸盐等含氮化合物;
②放电条件下,与氧气结合为氮氧化合物,并随降水进入水体中;
③合成氨工厂、汽车发动机都可以将一部分氮气转化成化合态。
(2)化合态→游离态:硝酸盐在某些细菌作用下转化成氮气。
(3)化合态→化合态:化石燃料燃烧、森林和农作物枝叶燃烧所产生的氮氧化合物通过大气进入陆地和海洋,进入氮循环。
4、氮循环过程中的重要物质:N2、NO、NO2、NH3、铵盐、硝酸
【阅读】教材P71最后一段写出有关的化学方程式。
【过渡】像这样使空气中游离态的氮转化为化合态的氮的方法叫做氮的固定。
【阅读】教材P72
【板书】
【过渡】在氮循环中涉及到了较多重要的含氮元素的物质及其变化,下面我们一起来探讨这些物质的性质及转化。
【板书】1、氮气
【讲述】根据前面的讲解,已经知道氮气可以与氧气、氢气在一定条件下反应。
【阅读】P71知识支持
【讲述】故常温下,氮气的化学性质不活泼,很难与其它的物质发生反应。但在一定的条件下,氮气能与氧气、氢气等物质发生反应。
【结论】 在放电或高温的条件下,空气中的氮气能与氧气发生反应,生成一氧化氮,一氧化氮在空气中很不稳定,易被氧化成二氧化氮,二氧化氮与水反应生成硝酸。
【学生板书】N2+O2 2NO (有毒、无色、难溶于水)
2NO+O2=2NO2 (有毒、红棕色、与水反应)
3NO2+H2O=2HNO3+NO
【过渡】植物只能利用化合态的氮,除了闪电等自然方法外,能否用人工的方法把空气中的氮气转化为植物可吸收的含氮化合物呢?通过大量实验研究,科学家们发现在一定条件下,氮气和氢气可以直接化合生成氨。
【板书】 N2+3H2 2NH3 (可逆反应)
【阅读】P72知识支持
【指导阅读】 阅读P73——氨的合成。
【点评】目的让学生体会从实验室研究到工业生产的过程,感受化学与技术的关系。
【分析】上述有关氮气的反应方程式,判断是否属于氧化还原反应,是氧化还原反应的分析氧化剂和还原剂
【观看试验动画】1、一氧化氮和氧气与水的反应 ( http: / / www.21cnjy.com / " \o "欢迎登陆21世纪教育网 )
2、二氧化氮与水的反应 ( http: / / www.21cnjy.com / " \o "欢迎登陆21世纪教育网 )
【板书】2、NO和NO2
【学生】书写有关反应方程式,判断是否属于氧化还原反应,是氧化还原反应的分析氧化剂和还原剂。
【填表】对比NO和NO2的性质
名称 一氧化氮 二氧化氮
颜色、状态 无色气体 红棕色气体
气味 刺激性气味
溶解性 难溶 易溶
毒性 有毒 有毒
化学性质 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
【讨论】
1、现给你一试管二氧化氮,其它药品和仪器自选,根据上述反应,请你设计实验,要求尽可能多的使二氧化氮被水吸收。
2、你的设计对工业上生产硝酸有什么启示?(从原料的充分利用,减少污染物的排放等方面考虑。)
【展示答案】
实验步骤 现 象 解释(反应式)
(1) 将充满NO2的试管倒立在水槽中 红棕色逐渐消失,试管水位上升到2/3处 3NO2+H2O=2HNO3+NO
(2) 往试管通入O2 无色气体变成红棕色;水位继续上升,红棕色又消失 2NO+O2=2NO2
(3) 继续通入氧气 水逐渐充满试管 3NO2+H2O=2HNO3+NO
2、工业生产硝酸,将尾气(NO)吸收通入适量的氧气后再溶解于水,经过多次循环氧化、溶解,可充分利用原料,并减少NO的排放,保护环境。
【课堂小结】 学生自己概括·整合本节主要内容。
【展示】本节主要内容
【板书设计】
氮的循环
氮的固定
1、氮气
(1)N2+O2 2NO (有毒、无色、难溶于水)
2NO+O2=2NO2 (有毒、红棕色、与水反应)
3NO2+H2O=2HNO3+NO
(2)N2+3H2 2NH3 (可逆反应)
2、NO(有毒、无色、难溶于水)
NO2(有毒、红棕色、与水反应)
2NO+O2=2NO2 (有毒、红棕色、与水反应)
3NO2+H2O=2HNO3+NO
【课堂巩固练习】
1、氮的固定有三种途径:生物固氮、自然固氮和工业固氮。指出下列固氮方式各属于哪种类型。
⑴闪电时氮气转化为一氧化氮。
⑵豆科作物根瘤菌将氮气转化为化合态氮。
⑶在高温、高压和催化剂作用下,氮气和氢气反应合成氨。
2、雷鸣电闪是人们司空见惯的自然现象,地球上每年平均发生31560余次闪电。
(1)每当雷电交加之际,轰鸣闪电之时,空气中可能发生如下反应:
① 。
② 。
③ 。
(2)由此说明闪电对人类生活有何益处: 。
3、下图是氮元素在自然界中的循环示意图,试回答:图中 过程称为氮的固定(填写序号)
4.下列属于氮的固定的是
A.N2与H2在一定条件下反应生成NH3? B.NO与O2反应生成NO2?
C.NH3经催化氧化生成NO? D.N2蛋白质
5.收集NO和NO2两种气体
A.都可用排水法
B.NO用排水法,NO2用向上排气法
C.都可用向上排气法
D.NO用向上排气法,NO2用排水法
6.N2是空气的重要组成部分.因此有科学家根据蒸汽机的原理,设计制造出液氮蒸汽机,即利用液态氮的蒸发来驱动机车,从而达到环境保护的目的.其主要依据是
A.液态氮的沸点为-195.8℃,远低于常温
B.N2在空气中燃烧放热
C.N2与H2反应放热
D.N2在空气中约占78%(体积分数)
【作业】这节课学习了氮的循环和循环中涉及的物质氮气、一氧化氮、二氧化氮的性质,下一节将继续学习氮循环中的另外几种物质——氨、铵盐、硝酸,课下预习。
氮的固定
自然固氮
人工固氮
仿生固氮
高能固氮
生物固氮
合成氨
姓名:张丽
学校:肥城市第六高级中学
自然界中氮的循环
【课题】:自然界中氮的循环
【教学目标】:
(一)知识与技能目标
1、了解自然界中的氮循环及人类活动对氮循环的影响;
2、通过了解生物固氮和人工固氮形式,认识N2 、NO 、NO2的性质。
(二)过程与方法目标
培养学生通过观察实验现象,总结分析物质性质的能力。
(三)情感态度与价值观目标
通过介绍合成氨发展的艰辛历程,体会从实验室研究到工业生产的过程,渗透化学与技术关系的教育;
【教学重点、难点】
(一)知识上重点、难点:
重点:N2、氮的氧化物的主要性质;
难点:氮的氧化物的重要性质;
(二)方法上重点、难点
培养学生通过观察实验现象总结分析物质性质的能力。
【教学准备】
(一)学生准备
1、预习第二节——氮的循环
2、查找氮循环的资料,小组合作画出氮循环图示,写出短文。重点说明氮循环中涉及到哪些含氮元素的物质,它们是如何转化的?
(二)教师准备
1、教学媒体、课件;
2、补充实验。
【教学过程】
【引入】在空气中含量最多的元素是什么?这种元素在空气中的含量会不断变化吗?为什么?
氮是地球上含量丰富的一种元素。这节课我们就讲氮的循环。
【展示】图片
【联想 质疑】
雷电交加时,空气中的氮气和有关的含氮化合物发生了哪些化学反应?产生了哪些物质
这些化学反应和所产生的物质对于人类的生产和生活有什么意义
【阅读思考】阅读教材P70并思考下列问题:
1、氮元素在自然界中的存在形式;
2、氮在自然界中循环的基本过程;
3、含氮物质之间通过哪些途径进行相互之间的转化?
4、氮的循环过程中会产生哪些重要物质?
【小组交流】选取二个小组作为代表在课堂上交流。
【点评评价】教师点评并做好表现性评价
【展示】氮在自然界中的循环和存在形式:
1、氮元素在自然界中的存在形式:
自然界中氮元素存在的形式一种是游离态,如N2;一种是化合态,如铵盐、硝酸盐、氨、蛋白质等。
2、氮在自然界中的循环的基本过程:
3、主要转化
(1)游离态→化合态
①是豆科植物根部的根瘤菌,把氮气转变为硝酸盐等含氮化合物;
②放电条件下,与氧气结合为氮氧化合物,并随降水进入水体中;
③合成氨工厂、汽车发动机都可以将一部分氮气转化成化合态。
(2)化合态→游离态:硝酸盐在某些细菌作用下转化成氮气。
(3)化合态→化合态:化石燃料燃烧、森林和农作物枝叶燃烧所产生的氮氧化合物通过大气进入陆地和海洋,进入氮循环。
4、氮循环过程中的重要物质:N2、NO、NO2、NH3、铵盐、硝酸
【阅读】教材P71最后一段写出有关的化学方程式。
【过渡】像这样使空气中游离态的氮转化为化合态的氮的方法叫做氮的固定。
【阅读】教材P72
【板书】
【过渡】在氮循环中涉及到了较多重要的含氮元素的物质及其变化,下面我们一起来探讨这些物质的性质及转化。
【板书】1、氮气
【讲述】根据前面的讲解,已经知道氮气可以与氧气、氢气在一定条件下反应。
【阅读】P71知识支持
【讲述】故常温下,氮气的化学性质不活泼,很难与其它的物质发生反应。但在一定的条件下,氮气能与氧气、氢气等物质发生反应。
【结论】 在放电或高温的条件下,空气中的氮气能与氧气发生反应,生成一氧化氮,一氧化氮在空气中很不稳定,易被氧化成二氧化氮,二氧化氮与水反应生成硝酸。
【学生板书】N2+O2 2NO (有毒、无色、难溶于水)
2NO+O2=2NO2 (有毒、红棕色、与水反应)
3NO2+H2O=2HNO3+NO
【过渡】植物只能利用化合态的氮,除了闪电等自然方法外,能否用人工的方法把空气中的氮气转化为植物可吸收的含氮化合物呢?通过大量实验研究,科学家们发现在一定条件下,氮气和氢气可以直接化合生成氨。
【板书】 N2+3H2 2NH3 (可逆反应)
【阅读】P72知识支持
【指导阅读】 阅读P73——氨的合成。
【点评】目的让学生体会从实验室研究到工业生产的过程,感受化学与技术的关系。
【分析】上述有关氮气的反应方程式,判断是否属于氧化还原反应,是氧化还原反应的分析氧化剂和还原剂
【观看试验动画】1、一氧化氮和氧气与水的反应 ( http: / / www.21cnjy.com / " \o "欢迎登陆21世纪教育网 )
2、二氧化氮与水的反应 ( http: / / www.21cnjy.com / " \o "欢迎登陆21世纪教育网 )
【板书】2、NO和NO2
【学生】书写有关反应方程式,判断是否属于氧化还原反应,是氧化还原反应的分析氧化剂和还原剂。
【填表】对比NO和NO2的性质
名称 一氧化氮 二氧化氮
颜色、状态 无色气体 红棕色气体
气味 刺激性气味
溶解性 难溶 易溶
毒性 有毒 有毒
化学性质 2NO+O2=2NO2 3NO2+H2O=2HNO3+NO
【讨论】
1、现给你一试管二氧化氮,其它药品和仪器自选,根据上述反应,请你设计实验,要求尽可能多的使二氧化氮被水吸收。
2、你的设计对工业上生产硝酸有什么启示?(从原料的充分利用,减少污染物的排放等方面考虑。)
【展示答案】
实验步骤 现 象 解释(反应式)
(1) 将充满NO2的试管倒立在水槽中 红棕色逐渐消失,试管水位上升到2/3处 3NO2+H2O=2HNO3+NO
(2) 往试管通入O2 无色气体变成红棕色;水位继续上升,红棕色又消失 2NO+O2=2NO2
(3) 继续通入氧气 水逐渐充满试管 3NO2+H2O=2HNO3+NO
2、工业生产硝酸,将尾气(NO)吸收通入适量的氧气后再溶解于水,经过多次循环氧化、溶解,可充分利用原料,并减少NO的排放,保护环境。
【课堂小结】 学生自己概括·整合本节主要内容。
【展示】本节主要内容
【板书设计】
氮的循环
氮的固定
1、氮气
(1)N2+O2 2NO (有毒、无色、难溶于水)
2NO+O2=2NO2 (有毒、红棕色、与水反应)
3NO2+H2O=2HNO3+NO
(2)N2+3H2 2NH3 (可逆反应)
2、NO(有毒、无色、难溶于水)
NO2(有毒、红棕色、与水反应)
2NO+O2=2NO2 (有毒、红棕色、与水反应)
3NO2+H2O=2HNO3+NO
【课堂巩固练习】
1、氮的固定有三种途径:生物固氮、自然固氮和工业固氮。指出下列固氮方式各属于哪种类型。
⑴闪电时氮气转化为一氧化氮。
⑵豆科作物根瘤菌将氮气转化为化合态氮。
⑶在高温、高压和催化剂作用下,氮气和氢气反应合成氨。
2、雷鸣电闪是人们司空见惯的自然现象,地球上每年平均发生31560余次闪电。
(1)每当雷电交加之际,轰鸣闪电之时,空气中可能发生如下反应:
① 。
② 。
③ 。
(2)由此说明闪电对人类生活有何益处: 。
3、下图是氮元素在自然界中的循环示意图,试回答:图中 过程称为氮的固定(填写序号)
4.下列属于氮的固定的是
A.N2与H2在一定条件下反应生成NH3? B.NO与O2反应生成NO2?
C.NH3经催化氧化生成NO? D.N2蛋白质
5.收集NO和NO2两种气体
A.都可用排水法
B.NO用排水法,NO2用向上排气法
C.都可用向上排气法
D.NO用向上排气法,NO2用排水法
6.N2是空气的重要组成部分.因此有科学家根据蒸汽机的原理,设计制造出液氮蒸汽机,即利用液态氮的蒸发来驱动机车,从而达到环境保护的目的.其主要依据是
A.液态氮的沸点为-195.8℃,远低于常温
B.N2在空气中燃烧放热
C.N2与H2反应放热
D.N2在空气中约占78%(体积分数)
【作业】这节课学习了氮的循环和循环中涉及的物质氮气、一氧化氮、二氧化氮的性质,下一节将继续学习氮循环中的另外几种物质——氨、铵盐、硝酸,课下预习。
氮的固定
自然固氮
人工固氮
仿生固氮
高能固氮
生物固氮
合成氨
