人教版(五四制)八年级全一册化学 第六单元 实验活动2 二氧化碳的实验室制取与性质 课件(共24张PPT)
文档属性
| 名称 | 人教版(五四制)八年级全一册化学 第六单元 实验活动2 二氧化碳的实验室制取与性质 课件(共24张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-11 22:29:29 | ||
图片预览






文档简介
(共24张PPT)
O C O
1.练习实验室里制取二氧化碳和用向上排空气法收集气体;
2.加深对二氧化碳性质的认识。
学习目标
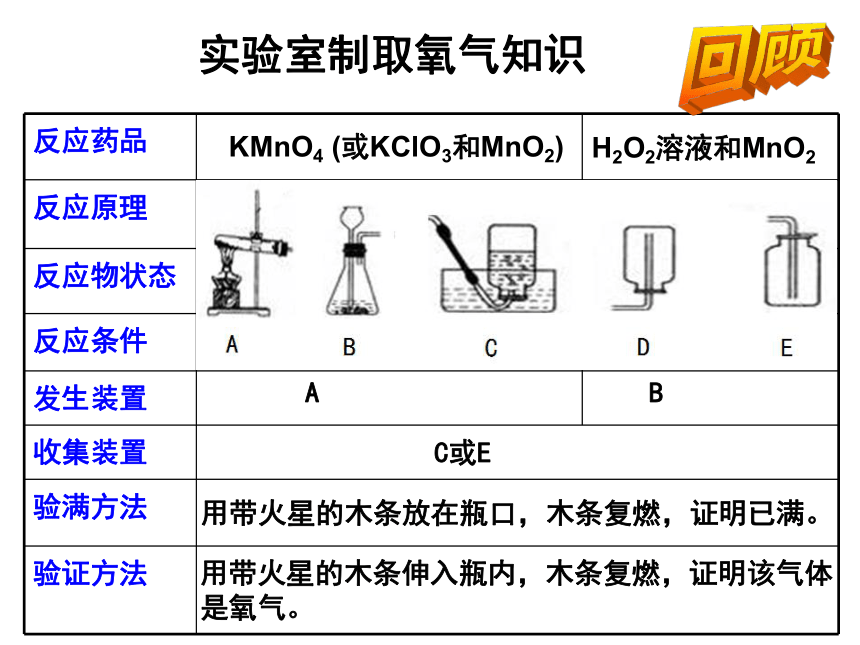
反应药品
反应原理
反应物状态
反应条件
发生装置
收集装置
验满方法
验证方法
实验室制取氧气知识
2KMnO4 ==K2MnO4 + MnO2 + O2 ↑
△
2H2O2 === 2H2O+O2↑
MnO2
固体
固体与液体
加热
不需要加热(常温)
A
B
C或E
用带火星的木条伸入瓶内,木条复燃,证明该气体是氧气。
用带火星的木条放在瓶口,木条复燃,证明已满。
KMnO4 (或KClO3和MnO2)
H2O2溶液和MnO2
实验室制取气体的一般思路和方法
制取一种气体,首先选择恰当的反应原理,然后根据反应物状态和反应条件,确定发生装置,而收集装置的选择要根据所收集气体的密度、溶解性以及是否与水反应。最后,就要依据气体的性质,来选择简便的验满方法和鉴定方法。
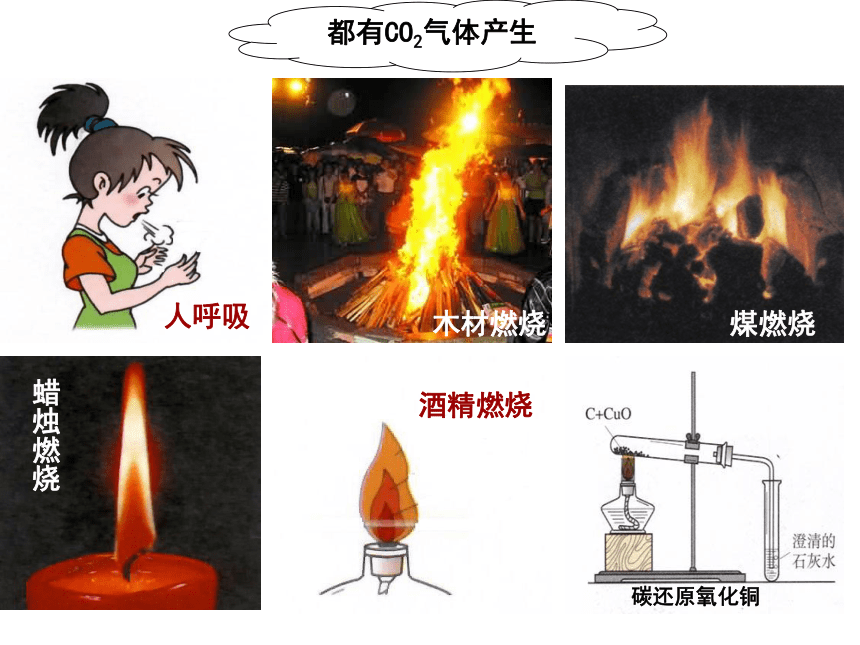
都有CO2气体产生
煤燃烧
木材燃烧
人呼吸
酒精燃烧
碳还原氧化铜
蜡烛燃烧
操作方法简单、便于收集
气体不纯、CO2含量低
原料廉价易得,操作方便
不易收集、不纯
操作方法简单
原料成本高、不易收集、不纯
气体易收集
成本高,操作不方便
方案
优点
缺点
人呼吸
木材、煤燃烧
酒精、蜡烛燃烧
碳还原氧化铜
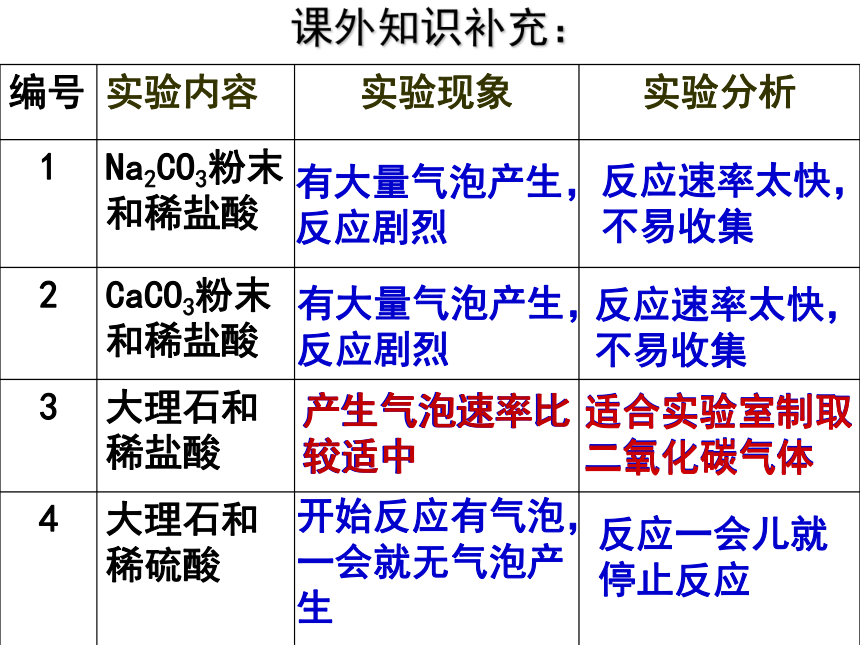
编号 实验内容 实验现象 实验分析
1 Na2CO3粉末和稀盐酸
2 CaCO3粉末和稀盐酸
3 大理石和稀盐酸
4 大理石和稀硫酸
有大量气泡产生,反应剧烈
反应速率太快,不易收集
产生气泡速率比较适中
适合实验室制取二氧化碳气体
开始反应有气泡,一会就无气泡产生
反应一会儿就停止反应
有大量气泡产生,反应剧烈
反应速率太快,不易收集
产生气泡速率比较适中
适合实验室制取二氧化碳气体
课外知识补充:
1、用浓盐酸代替稀盐酸与石灰石反应有哪些缺点?
浓盐酸易挥发,使制得的二氧化碳气体中含有较多的氯化氢气体,导致不纯。
2、实验室为何不用碳酸钙粉末跟稀盐酸反应制取
CO2?
碳酸钙粉末跟稀盐酸反应生成CO2,但反应速度太快,不利于收集,因此不用于实验室制取CO2气体。
因为开始时生成微溶于水的硫酸钙薄膜,附着在大理石的表面,使它不能接触到稀硫酸,阻止反应继续进行。
3、为什么不用硫酸代替盐酸与石灰石反应制CO2?
1、药品:
大理石或石灰石和稀盐酸
(主要成份为CaCO3)
2、反应原理:
CaCO3+2HCl==H2CO3+CaCl2
H2CO3==H2O+CO2↑
总反应:CaCO3+2HCl==CaCl2 + H2O + CO2↑
一、实验室制取二氧化碳
反应物都是固体,反应需要加热
反应物是固体和液体的混合物,
反应不需要加热
固液不加热型
固固加热型
气体发生装置
常见的气体收集方法
排水法:
向上排空气法:
向下排空气法:
气体在水中溶解少,
且不与水反应
气体密度大于
空气密度
气体密度小于
空气密度
空气的平均相对分子质量为29,如果某气体的相对分子质量大于29,则这样的气体的密度比空气大。如果小于29,则密度比空气小。(思考:CO2的密度比空气大,还是小?)
3、实验室制取二氧化碳的装置
将固体药品放入锥形瓶
从长颈漏斗处加入酸
收集二氧化碳
4、实验室制取二氧化碳的实验步骤
检验
2、检验二氧化碳
澄清石灰水
变浑浊
1、验证是否集满二氧化碳
5、检验
2、检验二氧化碳
澄清石灰水
变浑浊
1、检验是否集满二氧化碳
实验室制取二氧化碳的实验步骤
向盛有澄清石灰水试管中通入二氧化碳
CO2
将通入的二氧化碳的试管加热
实验1
蒸馏水
实验2
石蕊溶液
实验3
现象
分析
蜡烛熄灭了
二氧化碳不燃烧也不支持燃烧
且比空气密度大
CO2
1.把一支短蜡烛固定在烧杯内,点燃。拿起收集满二氧化碳的集气瓶,向烧杯内缓慢倾倒二氧化碳,如图所示观察现象。
2.向两支试管中分别加入约2mL蒸馏水,然后各滴入向1~2滴石蕊溶液,观察试管中溶液的颜色。将其中一支试管静置。向另一只试管中通入二氧化碳,观察现象,并与静置的试管中溶液的颜色进行对比。将通入二氧化碳的试管放在酒精灯的火焰上加热,观察现象。
现象
分析
通入二氧化碳的试管变红色,加热后红色消失
二氧化碳与水反应生成碳酸,
碳酸能使石蕊溶液变红色,
同时碳酸很不稳定。
二氧化碳的性质
3.取一支试管,向其中注入少量澄清石灰水,然后通入二氧化碳,观察现象。
通入澄清石灰水,变白色浑浊
CO2 + Ca(OH) 2 H2O +CaCO3
4.向一个收集满二氧化碳气体的质地较软的塑
料瓶中加入约一半体积的水,立即旋紧瓶盖,
振荡。观察现象并分析:
现象
分析
塑料瓶瘪了
二氧化碳能溶于水
小结:
1、二氧化碳能溶于水(1/1)
2、增大压强时,二氧化碳的溶解性会增强。
1.反应物的状态
2.反应条件
液体和固体反应
选择因素:
不需加热
生活处处有化学,感受化学美!
O C O
1.练习实验室里制取二氧化碳和用向上排空气法收集气体;
2.加深对二氧化碳性质的认识。
学习目标
反应药品
反应原理
反应物状态
反应条件
发生装置
收集装置
验满方法
验证方法
实验室制取氧气知识
2KMnO4 ==K2MnO4 + MnO2 + O2 ↑
△
2H2O2 === 2H2O+O2↑
MnO2
固体
固体与液体
加热
不需要加热(常温)
A
B
C或E
用带火星的木条伸入瓶内,木条复燃,证明该气体是氧气。
用带火星的木条放在瓶口,木条复燃,证明已满。
KMnO4 (或KClO3和MnO2)
H2O2溶液和MnO2
实验室制取气体的一般思路和方法
制取一种气体,首先选择恰当的反应原理,然后根据反应物状态和反应条件,确定发生装置,而收集装置的选择要根据所收集气体的密度、溶解性以及是否与水反应。最后,就要依据气体的性质,来选择简便的验满方法和鉴定方法。
都有CO2气体产生
煤燃烧
木材燃烧
人呼吸
酒精燃烧
碳还原氧化铜
蜡烛燃烧
操作方法简单、便于收集
气体不纯、CO2含量低
原料廉价易得,操作方便
不易收集、不纯
操作方法简单
原料成本高、不易收集、不纯
气体易收集
成本高,操作不方便
方案
优点
缺点
人呼吸
木材、煤燃烧
酒精、蜡烛燃烧
碳还原氧化铜
编号 实验内容 实验现象 实验分析
1 Na2CO3粉末和稀盐酸
2 CaCO3粉末和稀盐酸
3 大理石和稀盐酸
4 大理石和稀硫酸
有大量气泡产生,反应剧烈
反应速率太快,不易收集
产生气泡速率比较适中
适合实验室制取二氧化碳气体
开始反应有气泡,一会就无气泡产生
反应一会儿就停止反应
有大量气泡产生,反应剧烈
反应速率太快,不易收集
产生气泡速率比较适中
适合实验室制取二氧化碳气体
课外知识补充:
1、用浓盐酸代替稀盐酸与石灰石反应有哪些缺点?
浓盐酸易挥发,使制得的二氧化碳气体中含有较多的氯化氢气体,导致不纯。
2、实验室为何不用碳酸钙粉末跟稀盐酸反应制取
CO2?
碳酸钙粉末跟稀盐酸反应生成CO2,但反应速度太快,不利于收集,因此不用于实验室制取CO2气体。
因为开始时生成微溶于水的硫酸钙薄膜,附着在大理石的表面,使它不能接触到稀硫酸,阻止反应继续进行。
3、为什么不用硫酸代替盐酸与石灰石反应制CO2?
1、药品:
大理石或石灰石和稀盐酸
(主要成份为CaCO3)
2、反应原理:
CaCO3+2HCl==H2CO3+CaCl2
H2CO3==H2O+CO2↑
总反应:CaCO3+2HCl==CaCl2 + H2O + CO2↑
一、实验室制取二氧化碳
反应物都是固体,反应需要加热
反应物是固体和液体的混合物,
反应不需要加热
固液不加热型
固固加热型
气体发生装置
常见的气体收集方法
排水法:
向上排空气法:
向下排空气法:
气体在水中溶解少,
且不与水反应
气体密度大于
空气密度
气体密度小于
空气密度
空气的平均相对分子质量为29,如果某气体的相对分子质量大于29,则这样的气体的密度比空气大。如果小于29,则密度比空气小。(思考:CO2的密度比空气大,还是小?)
3、实验室制取二氧化碳的装置
将固体药品放入锥形瓶
从长颈漏斗处加入酸
收集二氧化碳
4、实验室制取二氧化碳的实验步骤
检验
2、检验二氧化碳
澄清石灰水
变浑浊
1、验证是否集满二氧化碳
5、检验
2、检验二氧化碳
澄清石灰水
变浑浊
1、检验是否集满二氧化碳
实验室制取二氧化碳的实验步骤
向盛有澄清石灰水试管中通入二氧化碳
CO2
将通入的二氧化碳的试管加热
实验1
蒸馏水
实验2
石蕊溶液
实验3
现象
分析
蜡烛熄灭了
二氧化碳不燃烧也不支持燃烧
且比空气密度大
CO2
1.把一支短蜡烛固定在烧杯内,点燃。拿起收集满二氧化碳的集气瓶,向烧杯内缓慢倾倒二氧化碳,如图所示观察现象。
2.向两支试管中分别加入约2mL蒸馏水,然后各滴入向1~2滴石蕊溶液,观察试管中溶液的颜色。将其中一支试管静置。向另一只试管中通入二氧化碳,观察现象,并与静置的试管中溶液的颜色进行对比。将通入二氧化碳的试管放在酒精灯的火焰上加热,观察现象。
现象
分析
通入二氧化碳的试管变红色,加热后红色消失
二氧化碳与水反应生成碳酸,
碳酸能使石蕊溶液变红色,
同时碳酸很不稳定。
二氧化碳的性质
3.取一支试管,向其中注入少量澄清石灰水,然后通入二氧化碳,观察现象。
通入澄清石灰水,变白色浑浊
CO2 + Ca(OH) 2 H2O +CaCO3
4.向一个收集满二氧化碳气体的质地较软的塑
料瓶中加入约一半体积的水,立即旋紧瓶盖,
振荡。观察现象并分析:
现象
分析
塑料瓶瘪了
二氧化碳能溶于水
小结:
1、二氧化碳能溶于水(1/1)
2、增大压强时,二氧化碳的溶解性会增强。
1.反应物的状态
2.反应条件
液体和固体反应
选择因素:
不需加热
生活处处有化学,感受化学美!
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
