【重难点突破】浙教版9年级上册科学 第7讲 金属的性质(金属材料与金属化学性质)(含答案)
文档属性
| 名称 | 【重难点突破】浙教版9年级上册科学 第7讲 金属的性质(金属材料与金属化学性质)(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-11-11 22:26:53 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
【重难点突破】浙教版9年级上册科学 第7讲 金属的性质(金属材料与金属化学性质)
一、金属材料
1.钛和钛的合金被认为是21世纪的重要材料,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,钛合金与人体有很好的“相容性”.根据它们的主要性能,下列用途不切合实际的是( )
A. 用来做保险丝 B. 用于制造航天飞机 C. 用来制造人造骨 D. 用于制造船舶
2.(2019九下·秀洲月考)我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍合金,伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢。选择铸造硬币的材料不需要考虑的因素是( )
A. 金属的耐腐蚀性 B. 金属的导电性 C. 金属的硬度 D. 金属价格与硬币面值的吻合度
3.(2017九上·浙江月考)世界卫生组织把铝确定为食品污染源之一.铝的下列应用必须加以控制的是( )
A. 用铝合金制门窗 B. 用铝合金飞机材料
C. 作金属铝制装碳酸饮料的易拉罐 D. 作金属铝制铝制电线
4.科学家发现一种新金属。根据表中信息推测其用途错误的是( )
熔点 密度 强度 导电性 导热性 抗腐蚀性
2500℃ 3g/cm3 与钢相似 良好 良好 优异
A. 用于焊接金属 B. 制造航天飞机 C. 制外科手术刀 D. 用于通讯设备
5.(2019八下·平阳月考)下图是生活中常用来固定房门的“门吸”,它由磁铁和金属块两部分组成。 该金属块能被磁铁所吸引,是因为金属块可能含有以下材料中的( )
A. 银 B. 铁 C. 铝 D. 锌
6.金属钛有银白色金属光泽,密度为4.5g/cm3 , 熔点为1725℃,具有良好的延展性和耐腐蚀性。下列物品不能用钛制作的是( )
A. 保险丝 B. 医疗器械 C. 潜艇外壳 D. 眼镜架
7.下列有关金属材料的说法不正确的是( )
A. 青铜、黄铜的硬度大于纯铜
B. 生铁和钢的性能不同,主要是由于其含碳量不同
C. 一般来说,合金的抗腐蚀性能比其成分金属强
D. 合金是由两种或两种以上金属融合而成的具有金属特性的物质
8.(2021八下·杭州期末)如图为钟表式元素周期表,该钟表的整点时间小时数与该元素的质子数相等。“时针”和“分针”指向对应的两种元素,1:00对应的两种元素各自形成的单质________、________,8:00对应的两种元素形成的化合物为________。
9.铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.
(1)在空气中________制品(填“铝”或“铁”)更耐腐蚀.
(2)人们大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能,例如________
(3)铁在空气中锈蚀,实际上是铁跟空气中的________共同作用的结果;防止金属锈蚀,常采用________的方法.
(4)若要验证铜、铁、铝的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的另外两种溶液是________.
10.小颖在地矿博物馆中看到了许多矿石标本,其中部分矿石信息如图所示:
(1)在钾长石的主要成分KAlSi3O4中,共含有________种金属元素.
(2)在上述四种矿石中,________(填序号)的主要成分属于氧化物.
(3)查阅博物馆资料,小颖了解到我们的祖先很早就掌握了炼铜工艺:他们将孔雀石和木炭一起加热就可得到红色的金属铜.(提示:孔雀石受热易分解,生成氧化铜、二氧化碳和水;高温灼烧时,用木炭作还原剂能把氧化铜中的铜还原出来.),请你从上述反应中,任选其一写出对应的化学方程式:________
(4)在赤铁矿和黄铁矿中,你认为哪一种矿石更适合炼铁?请说明理由?________.
二、金属化学性质与金属活动顺序
11.某不纯锌块6.5克,与足量盐酸完全反应放出氢气0.18克,则锌块含有的杂质可能( )
A. Mg B. Al C. Fe D. Cu
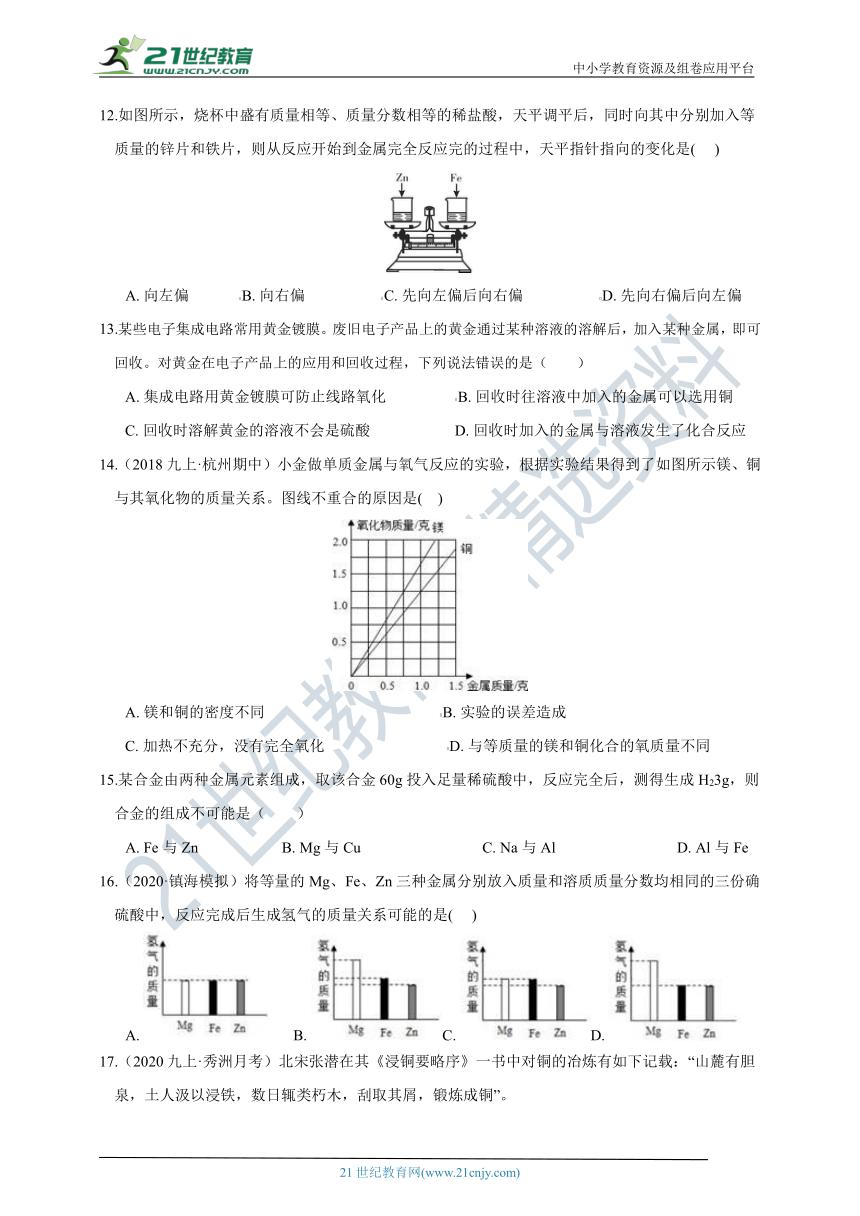
12.如图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应完的过程中,天平指针指向的变化是( )
A. 向左偏 B. 向右偏 C. 先向左偏后向右偏 D. 先向右偏后向左偏
13.某些电子集成电路常用黄金镀膜。废旧电子产品上的黄金通过某种溶液的溶解后,加入某种金属,即可回收。对黄金在电子产品上的应用和回收过程,下列说法错误的是( )
A. 集成电路用黄金镀膜可防止线路氧化 B. 回收时往溶液中加入的金属可以选用铜
C. 回收时溶解黄金的溶液不会是硫酸 D. 回收时加入的金属与溶液发生了化合反应
14.(2018九上·杭州期中)小金做单质金属与氧气反应的实验,根据实验结果得到了如图所示镁、铜与其氧化物的质量关系。图线不重合的原因是( )
A. 镁和铜的密度不同 B. 实验的误差造成
C. 加热不充分,没有完全氧化 D. 与等质量的镁和铜化合的氧质量不同
15.某合金由两种金属元素组成,取该合金60g投入足量稀硫酸中,反应完全后,测得生成H23g,则合金的组成不可能是( )
A. Fe与Zn B. Mg与Cu C. Na与Al D. Al与Fe
16.(2020·镇海模拟)将等量的Mg、Fe、Zn三种金属分别放入质量和溶质质量分数均相同的三份确硫酸中,反应完成后生成氢气的质量关系可能的是( )
A. B. C. D.
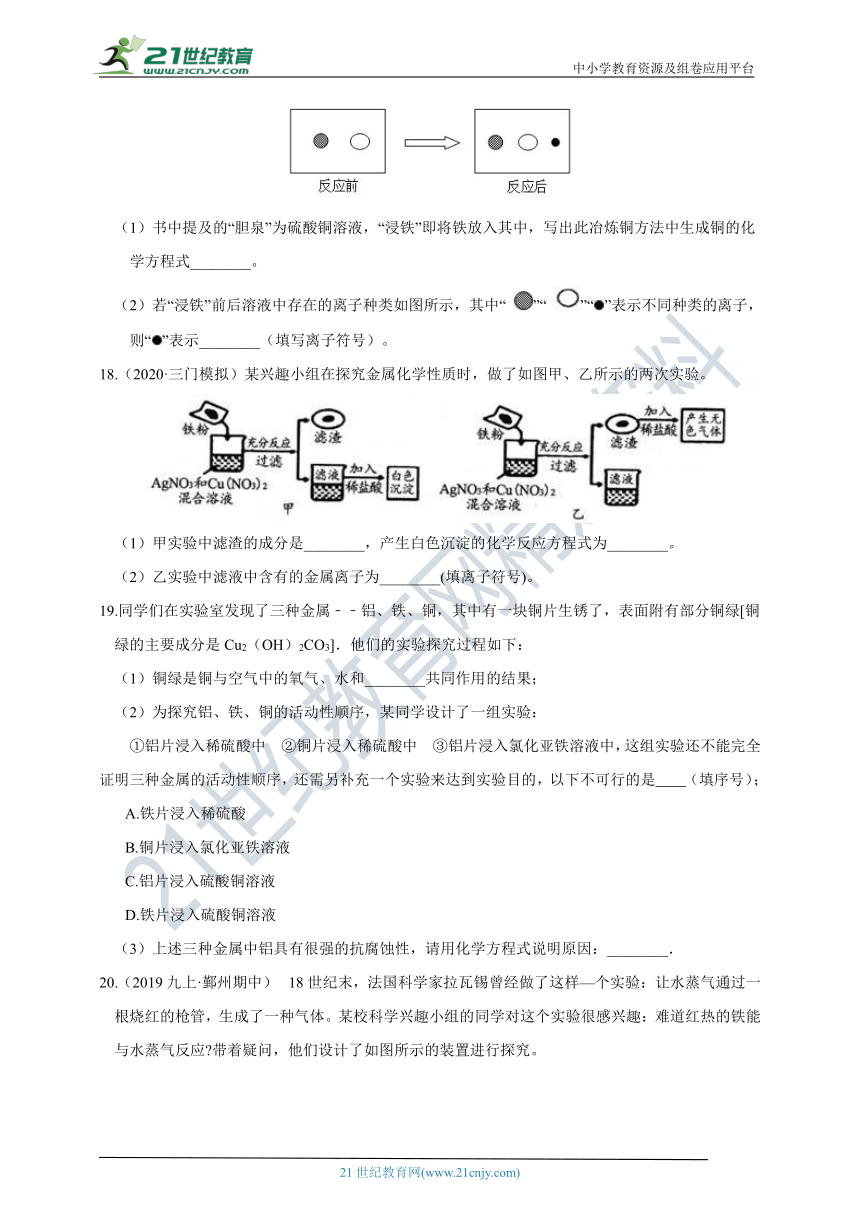
17.(2020九上·秀洲月考)北宋张潜在其《浸铜要略序》一书中对铜的冶炼有如下记载:“山麓有胆泉,土人汲以浸铁,数日辄类朽木,刮取其屑,锻炼成铜”。
(1)书中提及的“胆泉”为硫酸铜溶液,“浸铁”即将铁放入其中,写出此冶炼铜方法中生成铜的化学方程式________。
(2)若“浸铁”前后溶液中存在的离子种类如图所示,其中“ ”“ ”“”表示不同种类的离子,则“”表示________(填写离子符号)。
18.(2020·三门模拟)某兴趣小组在探究金属化学性质时,做了如图甲、乙所示的两次实验。
(1)甲实验中滤渣的成分是________,产生白色沉淀的化学反应方程式为________。
(2)乙实验中滤液中含有的金属离子为________(填离子符号)。
19.同学们在实验室发现了三种金属﹣﹣铝、铁、铜,其中有一块铜片生锈了,表面附有部分铜绿[铜绿的主要成分是Cu2(OH)2CO3].他们的实验探究过程如下:
(1)铜绿是铜与空气中的氧气、水和________共同作用的结果;
(2)为探究铝、铁、铜的活动性顺序,某同学设计了一组实验:
①铝片浸入稀硫酸中 ②铜片浸入稀硫酸中 ③铝片浸入氯化亚铁溶液中,这组实验还不能完全证明三种金属的活动性顺序,还需另补充一个实验来达到实验目的,以下不可行的是 (填序号);
A.铁片浸入稀硫酸
B.铜片浸入氯化亚铁溶液
C.铝片浸入硫酸铜溶液
D.铁片浸入硫酸铜溶液
(3)上述三种金属中铝具有很强的抗腐蚀性,请用化学方程式说明原因:________.
20.(2019九上·鄞州期中) 18世纪末,法国科学家拉瓦锡曾经做了这样—个实验:让水蒸气通过一根烧红的枪管,生成了一种气体。某校科学兴趣小组的同学对这个实验很感兴趣:难道红热的铁能与水蒸气反应 带着疑问,他们设计了如图所示的装置进行探究。
(1)已知试管内湿棉花不参加化学反应,它的作用是________;
(2)若干燥从a导管出来的气体,应从右边装置中________(选填“b”或“c”)端管口通入;
(3)其实红热的铁遇到水蒸气,反应后生成氢气和黑色固体四氧化三铁,它属于________反应(填基本反应类型),其化学方程式________。
21.(2019九上·柯桥月考)小李同学为探究影响金属与酸反应剧烈程度的因素时,进行了如下实验:
步骤 1:调节天平平衡;
步骤2:将等质量,质量分数都为10%的稀盐酸倒入烧杯内,分别放在天平的左右两盘;
步骤3:将等质量的锌粉和铁粉分别放入左,右烧杯内,观察天平的平衡情况;
步骤4:根据观察到的现象,得出结论。
(1)根据实验,我们会观察到,天平开始会向________倾斜。由此可以得出什么结论________。
(2)利用天平,我们还可以计算出,金属与酸反应产生的氢气的质量,从而建立相应的坐标关系。如图是小李做出的等质量的铁和锌与稀盐酸反应的坐标图,请帮他补充完整。
22.(2018九上·杭州期中)小杭想测定Cu-Zn合金及Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀盐酸和必要的仪器。
(1)你认为能测出其铜的质量分数的是________合金;
(2)老师又给了小杭一瓶硝酸银溶液,小杭取前一次无法测得结果的合金10g投入足量的硝酸银溶液中,充分反应后,经测定,固体质量变成了25.2g,求该合金中铜的质量分数。
23.(2020·滨江模拟)5G通讯需要大量光纤连接各种基站,在光纤的表面涂布Cu-Al合金层的金属涂层光纤是其中一种。为测定金属涂层光纤的Cu-Al合金层中铝的质量分数,小乐进行了相关实验,测得实验数据如表所示,则:
甲 乙 丙
加入Cu-Al合金层样品粉末的质量(g) 10 10 20
加入稀硫酸的质量(g) 100 50 50
烧杯中剩余物的质量(g) 109 59 69
(1)实验中Cu-Al合金层样品粉末与稀硫酸恰好完全反应的实验是_____ (选填“甲”“乙”或“丙”);
(2)该Cu-Al合金层样品粉末中铝的质量分数为多少?(写出计算过程)
答案解析部分
一、金属材料
1.【答案】 A 2.【答案】 B 3.【答案】 C 4.【答案】 A 5.【答案】 B 6.【答案】 A 7.【答案】 D
8.【答案】 Mg;H2;MgO
9.【答案】 (1)铝(2)合金比纯金属硬度大,熔点低(3)水和氧气;刷漆涂油电镀等(4)硫酸铝和硫酸铜溶液
10.【答案】 (1)2(2)A(3)2CuO+C 2Cu+CO2↑
(4)赤铁矿,黄铁矿中含有硫元素,生成的二氧化硫会污染空气
二、金属化学性质与金属活动顺序
11.【答案】 D 12.【答案】 D 13.【答案】 D 14.【答案】 D 15.【答案】 A 16.【答案】 D
17.【答案】 (1)Fe+CuSO4=FeSO4+Cu(2)Fe2+
18.【答案】 (1)Ag;AgNO3+HCl=AgCl↓+HNO3(2)Fe2+
19.【答案】 (1)二氧化碳(2)C(3)4Al+3O2=2Al2O3
20.【答案】 (1)提供水蒸气(2)c(3)置换;3Fe+4H2O Fe3O4+4H2
21.【答案】 (1)右;金属种类(活泼性)会影响金属与酸反应的剧烈程度
(2)
22.【答案】 (1)Cu-Zn
(2)设Cu-Ag合金中含银的质量为m
Cu +2AgNO3=Cu(NO3)2+ 2Ag
64 216
10g-m 25.2g-m
m=3.6g;
Cu%= ×100%= ×100%=64%
23.【答案】 (1)乙
(2)设10gCu-Al合金层样品粉末中铝的质量为x
2Al+3H2SO4=Al2(SO4)3+ 3H2↑
54 6
x 1g
x=9g
W□%= ×100%=90%
答:该合金样品粉末中铝的质量分数为90%
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
【重难点突破】浙教版9年级上册科学 第7讲 金属的性质(金属材料与金属化学性质)
一、金属材料
1.钛和钛的合金被认为是21世纪的重要材料,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工,钛合金与人体有很好的“相容性”.根据它们的主要性能,下列用途不切合实际的是( )
A. 用来做保险丝 B. 用于制造航天飞机 C. 用来制造人造骨 D. 用于制造船舶
2.(2019九下·秀洲月考)我国第四套人民币硬币从1999年开始发行,一元币为钢芯镀镍合金,伍角币为钢芯镀铜合金,一角币为铝合金或不锈钢。选择铸造硬币的材料不需要考虑的因素是( )
A. 金属的耐腐蚀性 B. 金属的导电性 C. 金属的硬度 D. 金属价格与硬币面值的吻合度
3.(2017九上·浙江月考)世界卫生组织把铝确定为食品污染源之一.铝的下列应用必须加以控制的是( )
A. 用铝合金制门窗 B. 用铝合金飞机材料
C. 作金属铝制装碳酸饮料的易拉罐 D. 作金属铝制铝制电线
4.科学家发现一种新金属。根据表中信息推测其用途错误的是( )
熔点 密度 强度 导电性 导热性 抗腐蚀性
2500℃ 3g/cm3 与钢相似 良好 良好 优异
A. 用于焊接金属 B. 制造航天飞机 C. 制外科手术刀 D. 用于通讯设备
5.(2019八下·平阳月考)下图是生活中常用来固定房门的“门吸”,它由磁铁和金属块两部分组成。 该金属块能被磁铁所吸引,是因为金属块可能含有以下材料中的( )
A. 银 B. 铁 C. 铝 D. 锌
6.金属钛有银白色金属光泽,密度为4.5g/cm3 , 熔点为1725℃,具有良好的延展性和耐腐蚀性。下列物品不能用钛制作的是( )
A. 保险丝 B. 医疗器械 C. 潜艇外壳 D. 眼镜架
7.下列有关金属材料的说法不正确的是( )
A. 青铜、黄铜的硬度大于纯铜
B. 生铁和钢的性能不同,主要是由于其含碳量不同
C. 一般来说,合金的抗腐蚀性能比其成分金属强
D. 合金是由两种或两种以上金属融合而成的具有金属特性的物质
8.(2021八下·杭州期末)如图为钟表式元素周期表,该钟表的整点时间小时数与该元素的质子数相等。“时针”和“分针”指向对应的两种元素,1:00对应的两种元素各自形成的单质________、________,8:00对应的两种元素形成的化合物为________。
9.铝、铁、铜是人类广泛使用的三种金属,与我们生活息息相关.
(1)在空气中________制品(填“铝”或“铁”)更耐腐蚀.
(2)人们大量使用的是合金而不是纯金属,这是因为合金具有更多优良性能,例如________
(3)铁在空气中锈蚀,实际上是铁跟空气中的________共同作用的结果;防止金属锈蚀,常采用________的方法.
(4)若要验证铜、铁、铝的活动性顺序,某同学已经选择了打磨过的铁丝,你认为他还需要的另外两种溶液是________.
10.小颖在地矿博物馆中看到了许多矿石标本,其中部分矿石信息如图所示:
(1)在钾长石的主要成分KAlSi3O4中,共含有________种金属元素.
(2)在上述四种矿石中,________(填序号)的主要成分属于氧化物.
(3)查阅博物馆资料,小颖了解到我们的祖先很早就掌握了炼铜工艺:他们将孔雀石和木炭一起加热就可得到红色的金属铜.(提示:孔雀石受热易分解,生成氧化铜、二氧化碳和水;高温灼烧时,用木炭作还原剂能把氧化铜中的铜还原出来.),请你从上述反应中,任选其一写出对应的化学方程式:________
(4)在赤铁矿和黄铁矿中,你认为哪一种矿石更适合炼铁?请说明理由?________.
二、金属化学性质与金属活动顺序
11.某不纯锌块6.5克,与足量盐酸完全反应放出氢气0.18克,则锌块含有的杂质可能( )
A. Mg B. Al C. Fe D. Cu
12.如图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应完的过程中,天平指针指向的变化是( )
A. 向左偏 B. 向右偏 C. 先向左偏后向右偏 D. 先向右偏后向左偏
13.某些电子集成电路常用黄金镀膜。废旧电子产品上的黄金通过某种溶液的溶解后,加入某种金属,即可回收。对黄金在电子产品上的应用和回收过程,下列说法错误的是( )
A. 集成电路用黄金镀膜可防止线路氧化 B. 回收时往溶液中加入的金属可以选用铜
C. 回收时溶解黄金的溶液不会是硫酸 D. 回收时加入的金属与溶液发生了化合反应
14.(2018九上·杭州期中)小金做单质金属与氧气反应的实验,根据实验结果得到了如图所示镁、铜与其氧化物的质量关系。图线不重合的原因是( )
A. 镁和铜的密度不同 B. 实验的误差造成
C. 加热不充分,没有完全氧化 D. 与等质量的镁和铜化合的氧质量不同
15.某合金由两种金属元素组成,取该合金60g投入足量稀硫酸中,反应完全后,测得生成H23g,则合金的组成不可能是( )
A. Fe与Zn B. Mg与Cu C. Na与Al D. Al与Fe
16.(2020·镇海模拟)将等量的Mg、Fe、Zn三种金属分别放入质量和溶质质量分数均相同的三份确硫酸中,反应完成后生成氢气的质量关系可能的是( )
A. B. C. D.
17.(2020九上·秀洲月考)北宋张潜在其《浸铜要略序》一书中对铜的冶炼有如下记载:“山麓有胆泉,土人汲以浸铁,数日辄类朽木,刮取其屑,锻炼成铜”。
(1)书中提及的“胆泉”为硫酸铜溶液,“浸铁”即将铁放入其中,写出此冶炼铜方法中生成铜的化学方程式________。
(2)若“浸铁”前后溶液中存在的离子种类如图所示,其中“ ”“ ”“”表示不同种类的离子,则“”表示________(填写离子符号)。
18.(2020·三门模拟)某兴趣小组在探究金属化学性质时,做了如图甲、乙所示的两次实验。
(1)甲实验中滤渣的成分是________,产生白色沉淀的化学反应方程式为________。
(2)乙实验中滤液中含有的金属离子为________(填离子符号)。
19.同学们在实验室发现了三种金属﹣﹣铝、铁、铜,其中有一块铜片生锈了,表面附有部分铜绿[铜绿的主要成分是Cu2(OH)2CO3].他们的实验探究过程如下:
(1)铜绿是铜与空气中的氧气、水和________共同作用的结果;
(2)为探究铝、铁、铜的活动性顺序,某同学设计了一组实验:
①铝片浸入稀硫酸中 ②铜片浸入稀硫酸中 ③铝片浸入氯化亚铁溶液中,这组实验还不能完全证明三种金属的活动性顺序,还需另补充一个实验来达到实验目的,以下不可行的是 (填序号);
A.铁片浸入稀硫酸
B.铜片浸入氯化亚铁溶液
C.铝片浸入硫酸铜溶液
D.铁片浸入硫酸铜溶液
(3)上述三种金属中铝具有很强的抗腐蚀性,请用化学方程式说明原因:________.
20.(2019九上·鄞州期中) 18世纪末,法国科学家拉瓦锡曾经做了这样—个实验:让水蒸气通过一根烧红的枪管,生成了一种气体。某校科学兴趣小组的同学对这个实验很感兴趣:难道红热的铁能与水蒸气反应 带着疑问,他们设计了如图所示的装置进行探究。
(1)已知试管内湿棉花不参加化学反应,它的作用是________;
(2)若干燥从a导管出来的气体,应从右边装置中________(选填“b”或“c”)端管口通入;
(3)其实红热的铁遇到水蒸气,反应后生成氢气和黑色固体四氧化三铁,它属于________反应(填基本反应类型),其化学方程式________。
21.(2019九上·柯桥月考)小李同学为探究影响金属与酸反应剧烈程度的因素时,进行了如下实验:
步骤 1:调节天平平衡;
步骤2:将等质量,质量分数都为10%的稀盐酸倒入烧杯内,分别放在天平的左右两盘;
步骤3:将等质量的锌粉和铁粉分别放入左,右烧杯内,观察天平的平衡情况;
步骤4:根据观察到的现象,得出结论。
(1)根据实验,我们会观察到,天平开始会向________倾斜。由此可以得出什么结论________。
(2)利用天平,我们还可以计算出,金属与酸反应产生的氢气的质量,从而建立相应的坐标关系。如图是小李做出的等质量的铁和锌与稀盐酸反应的坐标图,请帮他补充完整。
22.(2018九上·杭州期中)小杭想测定Cu-Zn合金及Cu-Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀盐酸和必要的仪器。
(1)你认为能测出其铜的质量分数的是________合金;
(2)老师又给了小杭一瓶硝酸银溶液,小杭取前一次无法测得结果的合金10g投入足量的硝酸银溶液中,充分反应后,经测定,固体质量变成了25.2g,求该合金中铜的质量分数。
23.(2020·滨江模拟)5G通讯需要大量光纤连接各种基站,在光纤的表面涂布Cu-Al合金层的金属涂层光纤是其中一种。为测定金属涂层光纤的Cu-Al合金层中铝的质量分数,小乐进行了相关实验,测得实验数据如表所示,则:
甲 乙 丙
加入Cu-Al合金层样品粉末的质量(g) 10 10 20
加入稀硫酸的质量(g) 100 50 50
烧杯中剩余物的质量(g) 109 59 69
(1)实验中Cu-Al合金层样品粉末与稀硫酸恰好完全反应的实验是_____ (选填“甲”“乙”或“丙”);
(2)该Cu-Al合金层样品粉末中铝的质量分数为多少?(写出计算过程)
答案解析部分
一、金属材料
1.【答案】 A 2.【答案】 B 3.【答案】 C 4.【答案】 A 5.【答案】 B 6.【答案】 A 7.【答案】 D
8.【答案】 Mg;H2;MgO
9.【答案】 (1)铝(2)合金比纯金属硬度大,熔点低(3)水和氧气;刷漆涂油电镀等(4)硫酸铝和硫酸铜溶液
10.【答案】 (1)2(2)A(3)2CuO+C 2Cu+CO2↑
(4)赤铁矿,黄铁矿中含有硫元素,生成的二氧化硫会污染空气
二、金属化学性质与金属活动顺序
11.【答案】 D 12.【答案】 D 13.【答案】 D 14.【答案】 D 15.【答案】 A 16.【答案】 D
17.【答案】 (1)Fe+CuSO4=FeSO4+Cu(2)Fe2+
18.【答案】 (1)Ag;AgNO3+HCl=AgCl↓+HNO3(2)Fe2+
19.【答案】 (1)二氧化碳(2)C(3)4Al+3O2=2Al2O3
20.【答案】 (1)提供水蒸气(2)c(3)置换;3Fe+4H2O Fe3O4+4H2
21.【答案】 (1)右;金属种类(活泼性)会影响金属与酸反应的剧烈程度
(2)
22.【答案】 (1)Cu-Zn
(2)设Cu-Ag合金中含银的质量为m
Cu +2AgNO3=Cu(NO3)2+ 2Ag
64 216
10g-m 25.2g-m
m=3.6g;
Cu%= ×100%= ×100%=64%
23.【答案】 (1)乙
(2)设10gCu-Al合金层样品粉末中铝的质量为x
2Al+3H2SO4=Al2(SO4)3+ 3H2↑
54 6
x 1g
x=9g
W□%= ×100%=90%
答:该合金样品粉末中铝的质量分数为90%
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
