化学必修Ⅰ人教新课标2.2离子反应课件
文档属性
| 名称 | 化学必修Ⅰ人教新课标2.2离子反应课件 |  | |
| 格式 | zip | ||
| 文件大小 | 355.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-20 16:38:08 | ||
图片预览




文档简介
(共19张PPT)
学习目标
专题考点
1.理解离子反应的概念。
2.掌握复分解型离子反应发生的条件。
3.能正确书写常见的离子方程式。
1.离子共存与离子方程式正误的判断。
2.离子检验及污水治理问题。
BaCl2溶液
CuSO4溶液
Ba2+Cl-
Cu2+ SO42-
BaCl2=Ba2++2Cl-
CuSO4=Cu2++SO42-
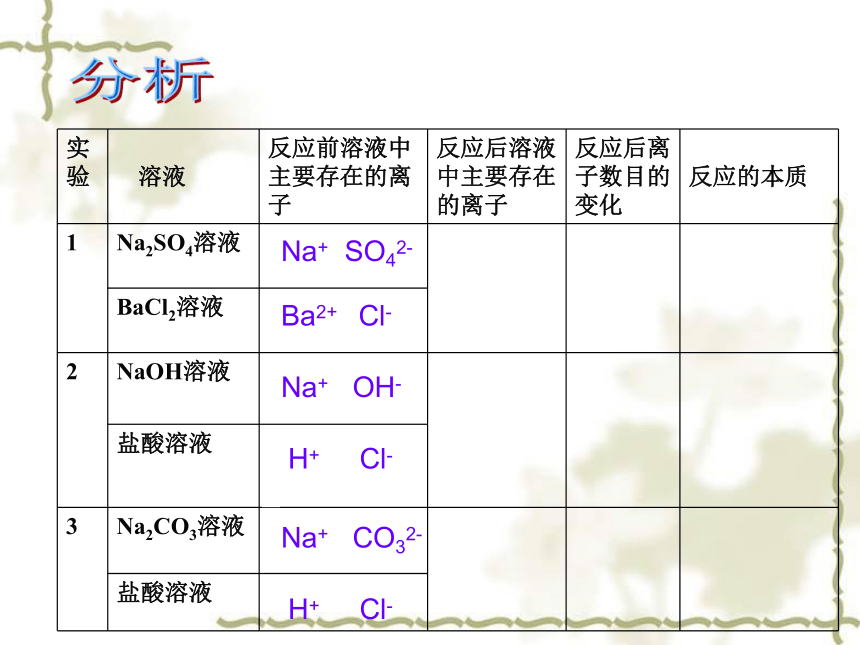
实验
溶液 反应前溶液中主要存在的离子 反应后溶液中主要存在的离子 反应后离子数目的变化
反应的本质
1 Na2SO4溶液
BaCl2溶液
2 NaOH溶液
盐酸溶液
3 Na2CO3溶液
盐酸溶液
Na+ SO42-
Ba2+ Cl-
Na+ OH-
Na+ CO32-
H+ Cl-
H+ Cl-
向盛有2mL Na2SO4溶液的试管里加入2mL BaCl2
溶液。
向盛有2mL Na2SO4溶液的试管里加入2mL BaCl2溶液。
向盛有2mL NaOH稀溶液的试管里滴入两滴酚酞
溶液,再用滴管向试管里慢慢滴入稀盐酸,至溶
液恰好变色为止。
向盛有2mL 0.1mol/L Na2CO3溶液的试管里加入
4mL 0.1mol/L盐酸。
向盛有2mL Na2SO4溶液的试管里加入2mL BaCl2溶液。
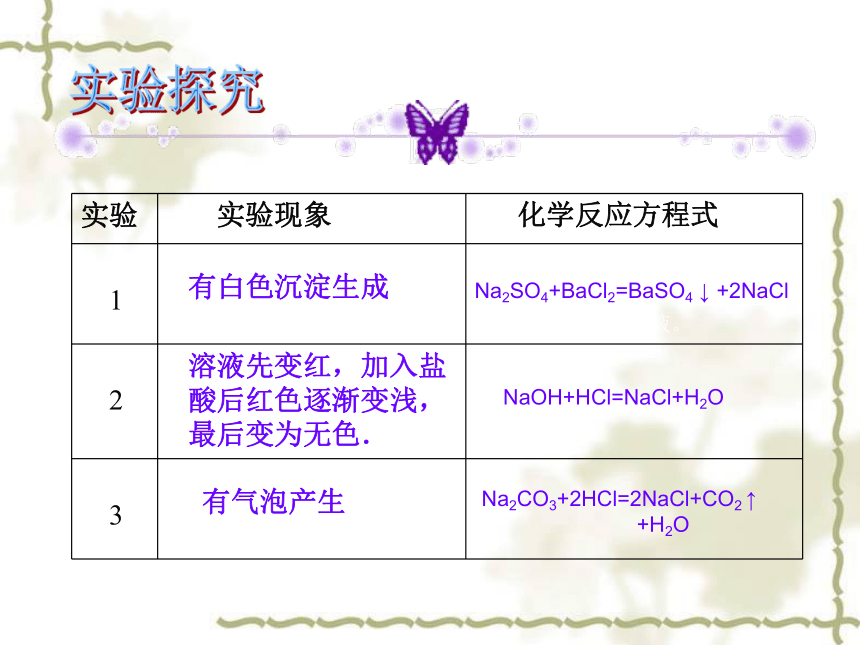
实验现象 化学反应方程式
1
2
3
实验
有白色沉淀生成
溶液先变红,加入盐酸后红色逐渐变浅,最后变为无色.
有气泡产生
Na2SO4+BaCl2=BaSO4 ↓ +2NaCl
NaOH+HCl=NaCl+H2O
Na2CO3+2HCl=2NaCl+CO2 ↑
+H2O
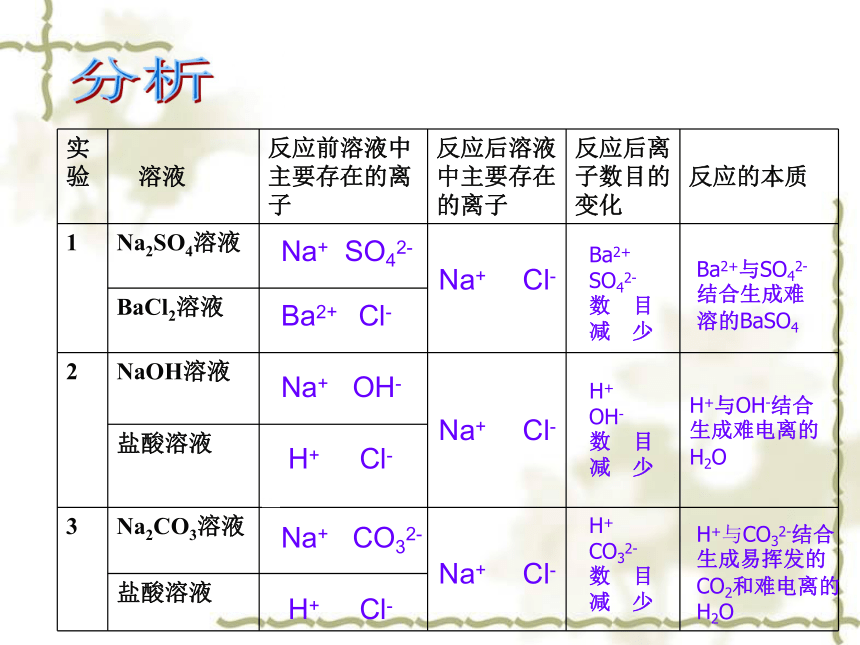
实验
溶液 反应前溶液中主要存在的离子 反应后溶液中主要存在的离子 反应后离子数目的变化
反应的本质
1 Na2SO4溶液
BaCl2溶液
2 NaOH溶液
盐酸溶液
3 Na2CO3溶液
盐酸溶液
Na+ SO42-
Ba2+ Cl-
Na+ OH-
Na+ CO32-
H+ Cl-
H+ Cl-
Na+ Cl-
Na+ Cl-
Na+ Cl-
Ba2+ SO42-
数 目
减 少
H+
OH-
数 目
减 少
Ba2+与SO42- 结合生成难溶的BaSO4
H+与OH-结合
生成难电离的
H2O
H+ CO32-
数 目
减 少
H+与CO32-结合生成易挥发的CO2和难电离的H2O
总结:电解质溶液反应的本质是 离子间的反应 ,
反应后溶液中离子数目 减少 。
一、离子反应
1.定义:有离子参加的反应。
2.复分解型离子反应发生的条件
条件
① 有难电离物质生成,如水 ;
② 有难溶物生成;
③ 有挥发性物质生成,如气体。
二、离子方程式
1、离子方程式的概念:
用实际参加反应的离子的符号来表示反应的式子叫离子方程式。
2、离子方程式的书写:
离子反应方程式的书写步骤:
1.写出化学方程式:
2.将能电离的物质拆开写成离子形式:
注:1.拆成离子形式的有:易溶且易电离的物质
写化学式的有:难溶物质、难电离物质、气体、单质、氧化物等
2.微溶物作为反应物,若是澄清溶液写离子符号,若是浊液写化学式。微溶物作为生成物,一般写化学式(标号↓)
3.删去两边相同的离子:
4.检查反应前后电荷是否守恒,质量是否守恒。
写
拆
删
查
请写出下列反应的离子方程式:
1.NaOH溶液和H2SO4溶液混合:
2.KOH溶液和HNO3溶液混合:
3.NaOH溶液和盐酸混合:
4.KOH溶液和H2SO4溶液混合:
H++OH-=H2O
H++OH-=H2O
H++OH-=H2O
H++OH-=H2O
1揭示反应的本质。
2不仅表示某一具体的
反应,还表示同一类型
的反应。
1.离子反应的概念。
2.复分解型离子反应发生的条件。
3.离子方程式的书写。
1.请写出下列反应的离子方程式:
Na2CO3溶液和盐酸混合
碳酸钠溶液与澄清石灰水反应
MgCO3和硝酸反应
2.下列离子方程式正确的是( )
A.硫酸跟氢氧化钡溶液反应:
Ba2++SO42-=BaSO4↓
B.碳酸钙与盐酸反应:
CO32-+2H+=CO2↑+H2O
C.铜片插入硝酸银溶液中:
Cu+Ag+=Cu2++Ag
D. Ca(OH)2浊液与稀盐酸反应:
Ca(OH)2 + 2H+ = Ca2+ + 2H2O
D
3.下列各组离子在无色水溶液中能大量
共存的是 ( )
A. K+ H+ CO32- Br-
B. Cu2+ Cl- OH- K+
C. Fe3+ NO3- SO42- Mg2+
D. H+ Cl- Na+ NO3-
D
1.环保部门准备检测某化工厂所排放的污水中是否含大量SO42-。如果你是一名环保工作人员,你应该怎样进行检测呢?
2.查阅资料,了解离子反应在生活、生产中的应用。
实验
溶液 反应前溶液中主要存在的离子 反应后溶液中主要存在的离子 反应后离子数目的变化
反应的本质
1 Na2SO4溶液
BaCl2溶液
2 NaOH溶液
盐酸溶液
3 Na2CO3溶液
盐酸溶液
Na+ SO42-
Ba2+ Cl-
Na+ OH-
Na+ CO32-
H+ Cl-
H+ Cl-
Na+ Cl-
Na+ Cl-
Na+ Cl-
Ba2+ SO42-
数 目
减 少
H+
OH-
数 目
减 少
Ba2+与SO42- 结合生成难溶的BaSO4
H+与OH-结合
生成难电离的
H2O
H+ CO32-
数 目
减 少
H+与CO32-结合生成易挥发的CO2和难电离的H2O
学习目标
专题考点
1.理解离子反应的概念。
2.掌握复分解型离子反应发生的条件。
3.能正确书写常见的离子方程式。
1.离子共存与离子方程式正误的判断。
2.离子检验及污水治理问题。
BaCl2溶液
CuSO4溶液
Ba2+Cl-
Cu2+ SO42-
BaCl2=Ba2++2Cl-
CuSO4=Cu2++SO42-
实验
溶液 反应前溶液中主要存在的离子 反应后溶液中主要存在的离子 反应后离子数目的变化
反应的本质
1 Na2SO4溶液
BaCl2溶液
2 NaOH溶液
盐酸溶液
3 Na2CO3溶液
盐酸溶液
Na+ SO42-
Ba2+ Cl-
Na+ OH-
Na+ CO32-
H+ Cl-
H+ Cl-
向盛有2mL Na2SO4溶液的试管里加入2mL BaCl2
溶液。
向盛有2mL Na2SO4溶液的试管里加入2mL BaCl2溶液。
向盛有2mL NaOH稀溶液的试管里滴入两滴酚酞
溶液,再用滴管向试管里慢慢滴入稀盐酸,至溶
液恰好变色为止。
向盛有2mL 0.1mol/L Na2CO3溶液的试管里加入
4mL 0.1mol/L盐酸。
向盛有2mL Na2SO4溶液的试管里加入2mL BaCl2溶液。
实验现象 化学反应方程式
1
2
3
实验
有白色沉淀生成
溶液先变红,加入盐酸后红色逐渐变浅,最后变为无色.
有气泡产生
Na2SO4+BaCl2=BaSO4 ↓ +2NaCl
NaOH+HCl=NaCl+H2O
Na2CO3+2HCl=2NaCl+CO2 ↑
+H2O
实验
溶液 反应前溶液中主要存在的离子 反应后溶液中主要存在的离子 反应后离子数目的变化
反应的本质
1 Na2SO4溶液
BaCl2溶液
2 NaOH溶液
盐酸溶液
3 Na2CO3溶液
盐酸溶液
Na+ SO42-
Ba2+ Cl-
Na+ OH-
Na+ CO32-
H+ Cl-
H+ Cl-
Na+ Cl-
Na+ Cl-
Na+ Cl-
Ba2+ SO42-
数 目
减 少
H+
OH-
数 目
减 少
Ba2+与SO42- 结合生成难溶的BaSO4
H+与OH-结合
生成难电离的
H2O
H+ CO32-
数 目
减 少
H+与CO32-结合生成易挥发的CO2和难电离的H2O
总结:电解质溶液反应的本质是 离子间的反应 ,
反应后溶液中离子数目 减少 。
一、离子反应
1.定义:有离子参加的反应。
2.复分解型离子反应发生的条件
条件
① 有难电离物质生成,如水 ;
② 有难溶物生成;
③ 有挥发性物质生成,如气体。
二、离子方程式
1、离子方程式的概念:
用实际参加反应的离子的符号来表示反应的式子叫离子方程式。
2、离子方程式的书写:
离子反应方程式的书写步骤:
1.写出化学方程式:
2.将能电离的物质拆开写成离子形式:
注:1.拆成离子形式的有:易溶且易电离的物质
写化学式的有:难溶物质、难电离物质、气体、单质、氧化物等
2.微溶物作为反应物,若是澄清溶液写离子符号,若是浊液写化学式。微溶物作为生成物,一般写化学式(标号↓)
3.删去两边相同的离子:
4.检查反应前后电荷是否守恒,质量是否守恒。
写
拆
删
查
请写出下列反应的离子方程式:
1.NaOH溶液和H2SO4溶液混合:
2.KOH溶液和HNO3溶液混合:
3.NaOH溶液和盐酸混合:
4.KOH溶液和H2SO4溶液混合:
H++OH-=H2O
H++OH-=H2O
H++OH-=H2O
H++OH-=H2O
1揭示反应的本质。
2不仅表示某一具体的
反应,还表示同一类型
的反应。
1.离子反应的概念。
2.复分解型离子反应发生的条件。
3.离子方程式的书写。
1.请写出下列反应的离子方程式:
Na2CO3溶液和盐酸混合
碳酸钠溶液与澄清石灰水反应
MgCO3和硝酸反应
2.下列离子方程式正确的是( )
A.硫酸跟氢氧化钡溶液反应:
Ba2++SO42-=BaSO4↓
B.碳酸钙与盐酸反应:
CO32-+2H+=CO2↑+H2O
C.铜片插入硝酸银溶液中:
Cu+Ag+=Cu2++Ag
D. Ca(OH)2浊液与稀盐酸反应:
Ca(OH)2 + 2H+ = Ca2+ + 2H2O
D
3.下列各组离子在无色水溶液中能大量
共存的是 ( )
A. K+ H+ CO32- Br-
B. Cu2+ Cl- OH- K+
C. Fe3+ NO3- SO42- Mg2+
D. H+ Cl- Na+ NO3-
D
1.环保部门准备检测某化工厂所排放的污水中是否含大量SO42-。如果你是一名环保工作人员,你应该怎样进行检测呢?
2.查阅资料,了解离子反应在生活、生产中的应用。
实验
溶液 反应前溶液中主要存在的离子 反应后溶液中主要存在的离子 反应后离子数目的变化
反应的本质
1 Na2SO4溶液
BaCl2溶液
2 NaOH溶液
盐酸溶液
3 Na2CO3溶液
盐酸溶液
Na+ SO42-
Ba2+ Cl-
Na+ OH-
Na+ CO32-
H+ Cl-
H+ Cl-
Na+ Cl-
Na+ Cl-
Na+ Cl-
Ba2+ SO42-
数 目
减 少
H+
OH-
数 目
减 少
Ba2+与SO42- 结合生成难溶的BaSO4
H+与OH-结合
生成难电离的
H2O
H+ CO32-
数 目
减 少
H+与CO32-结合生成易挥发的CO2和难电离的H2O
