化学必修Ⅰ人教新课标3.2铝的重要化合物课件2
文档属性
| 名称 | 化学必修Ⅰ人教新课标3.2铝的重要化合物课件2 |  | |
| 格式 | zip | ||
| 文件大小 | 70.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-20 16:59:34 | ||
图片预览



文档简介
(共24张PPT)
复习内容
考纲要求:
1.以氢氧化铝、氧化铝为例了解两性氢氧 化物和两性氧化物的性质。
2.了解氧化铝、氢氧化铝、铝盐的制备方法和主要用途,
3.了解复盐的组成和明矾的性质特征
常见题型:有关反应方程式
实验设计与评价
反应图像
框图题
本节重点:氢氧化铝的两性
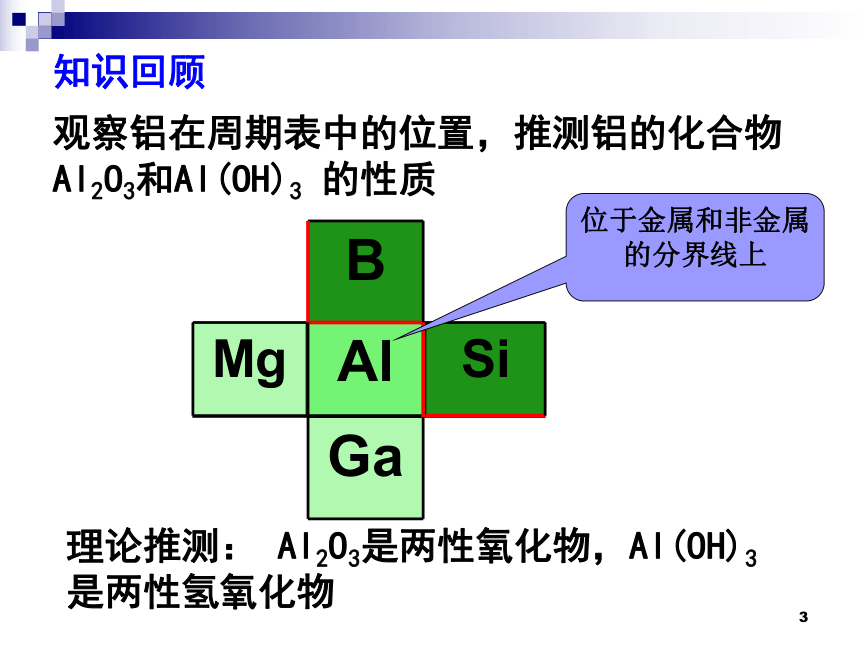
知识回顾
Mg Si
B
Al
Ga
观察铝在周期表中的位置,推测铝的化合物Al2O3和Al(OH)3 的性质
理论推测: Al2O3是两性氧化物,Al(OH)3是两性氢氧化物
位于金属和非金属的分界线上
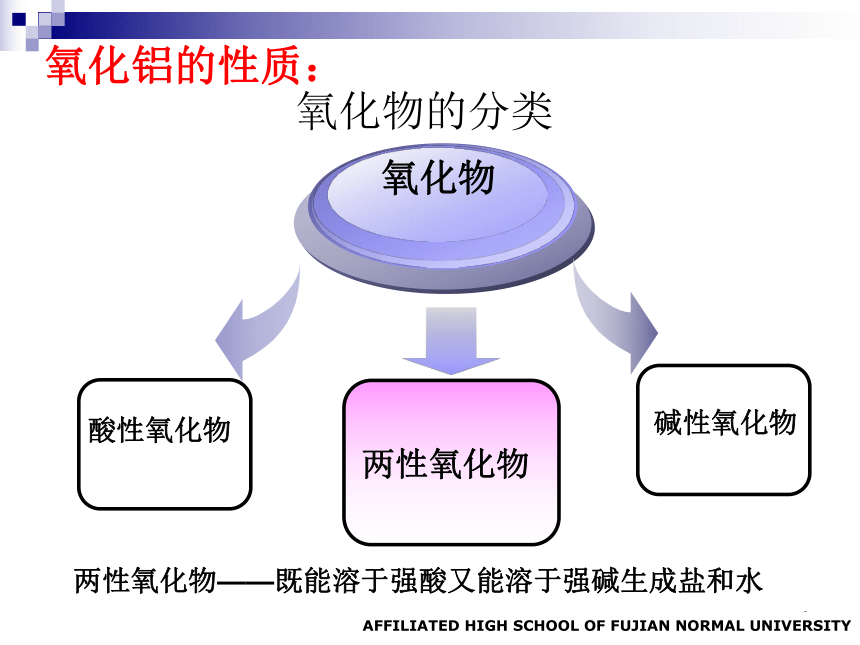
氧化物的分类
酸性氧化物
氧化物
碱性氧化物
AFFILIATED HIGH SCHOOL OF FUJIAN NORMAL UNIVERSITY
两性氧化物
两性氧化物——既能溶于强酸又能溶于强碱生成盐和水
氧化铝的性质:
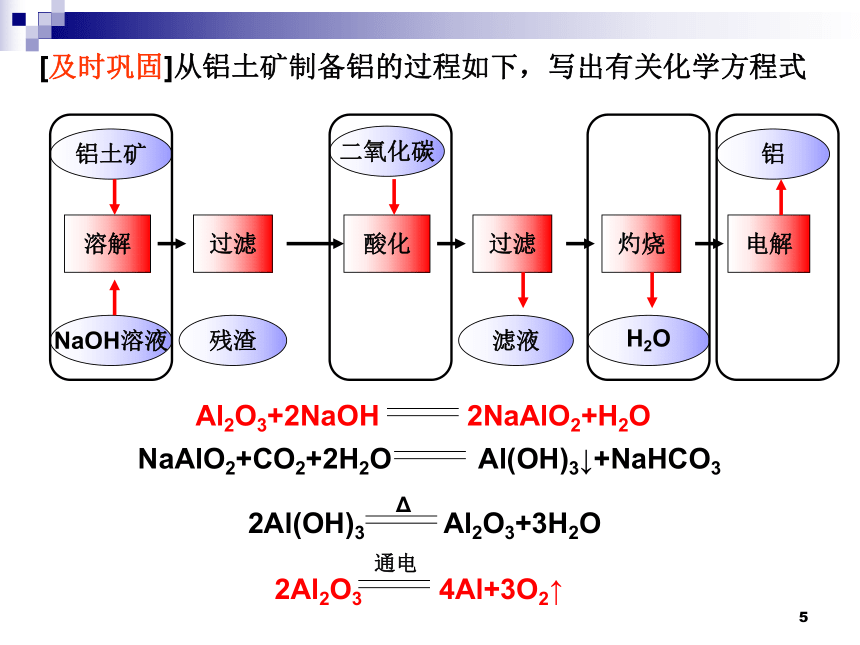
溶解
电解
灼烧
过滤
酸化
过滤
铝土矿
NaOH溶液
残渣
二氧化碳
滤液
H2O
铝
Al2O3+2NaOH 2NaAlO2+H2O
NaAlO2+CO2+2H2O Al(OH)3↓+NaHCO3
Δ
2Al(OH)3 Al2O3+3H2O
通电
2Al2O3 4Al+3O2↑
[及时巩固]从铝土矿制备铝的过程如下,写出有关化学方程式
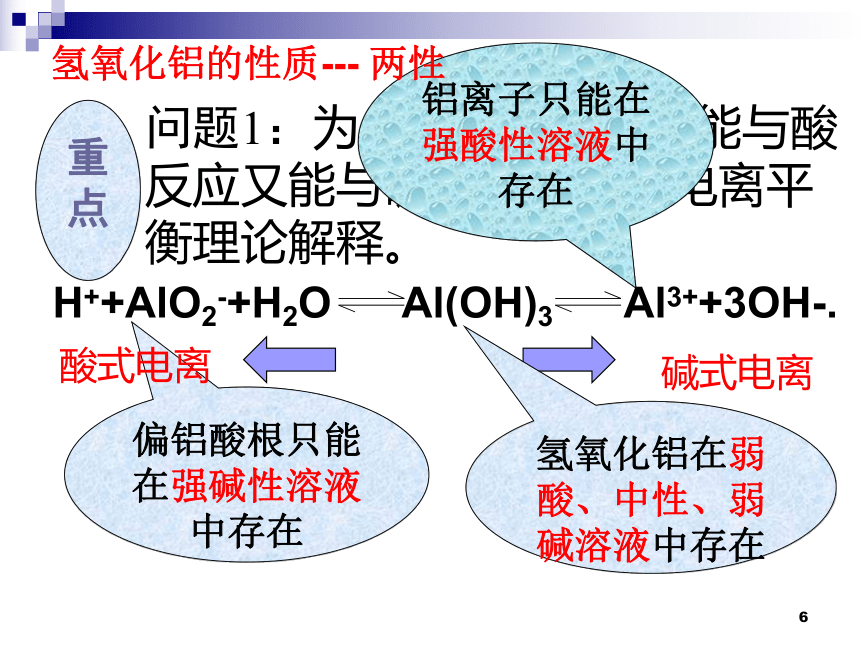
问题1:为什么氢氧化铝既能与酸反应又能与碱反应?试用电离平衡理论解释。
碱式电离
偏铝酸根只能在强碱性溶液中存在
铝离子只能在强酸性溶液中存在
氢氧化铝在弱酸、中性、弱碱溶液中存在
酸式电离
重点
氢氧化铝的性质--- 两性
H++AlO2-+H2O Al(OH)3 Al3++3OH-.
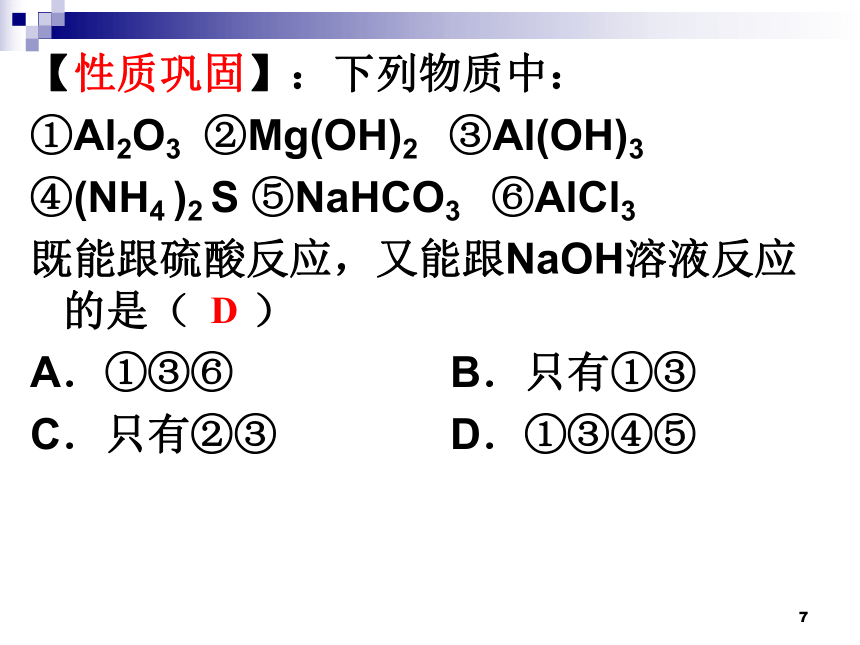
【性质巩固】:下列物质中:
①Al2O3 ②Mg(OH)2 ③Al(OH)3
④(NH4 )2 S ⑤NaHCO3 ⑥AlCl3
既能跟硫酸反应,又能跟NaOH溶液反应的是( )
A.①③⑥ B.只有①③
C.只有②③ D.①③④⑤
D
规律总结:
既能和酸反应,又能和碱反应的物质有:
Al、A12O3、Al(OH)3 、弱酸的酸式盐、
弱酸的铵盐等;
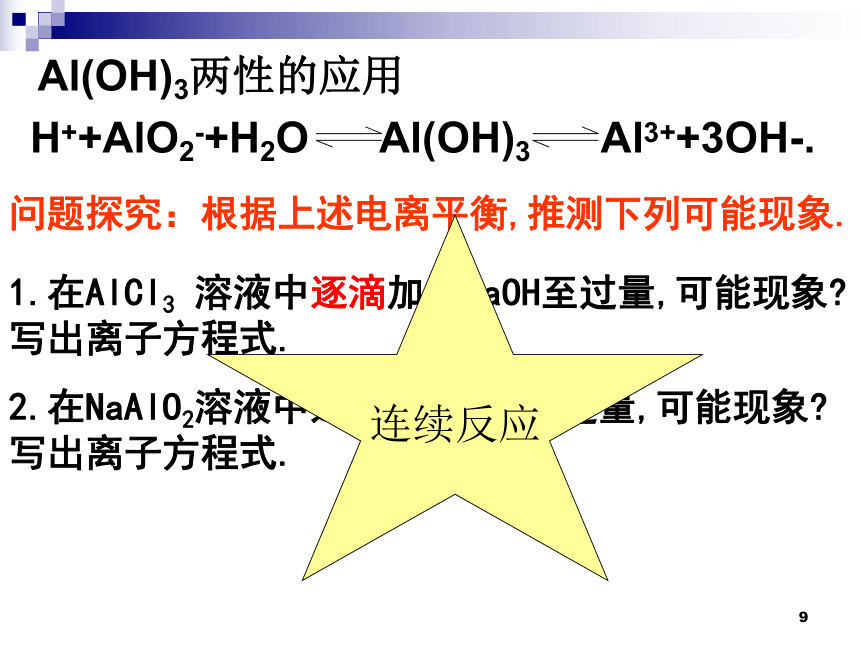
问题探究:根据上述电离平衡,推测下列可能现象.
1.在AlCl3 溶液中逐滴加入NaOH至过量,可能现象 写出离子方程式.
2.在NaAlO2溶液中逐滴加入HCl至过量,可能现象 写出离子方程式.
连续反应
Al(OH)3两性的应用
H++AlO2-+H2O Al(OH)3 Al3++3OH-.
两性的应用一:用图象来表现连续反应
请你画出:
1.向AlCl3 溶液中逐滴加入NaOH至过量的图象
1.写出相关的化学方程式
2.以被滴加物质的量为横坐标,沉淀量作为纵坐标
3.确定曲线的始点、折点和终点(注意折点和终点被滴加物质量 的确定)
考查作图、析图的能力
2.向HCl和AlCl3 溶液中逐滴加入NaOH至过量的图象
3.向AlCl3 溶液中逐滴加入氨水至过量的图象
0
m[Al(OH)3 ]
A
4
1
B
3
2
n(NaOH)/n(Al3+)
在NaAlO2溶液中逐渐通入CO2至过量
1/2
2AlO2- + CO2 +3H2O= 2Al(OH)3 + CO32-
AlO2- + CO2 +2H2O= Al(OH)3 + HCO3-
在NaAlO2溶液中逐渐通入HCl至过量
3.在NaOH溶液中逐滴加入AlCl3至过量
Al3++4OH-=AlO2-+2H2O
3AlO2-+Al3++6H2O=4Al(OH)3↓
4.在盐酸中逐滴加入NaAlO2溶液至过量
3AlO2-+Al3++6H2O=4Al(OH)3↓
AlO2-+4H+=Al3++2H2O
总:Al3++3OH- = Al(OH)3↓
1/4
1/3
n [Al(OH)3 ]
n(Al3+)/n(NaOH)
0
总:AlO2-+ H+ + H2O = Al(OH)3 ↓
1/4
1
n [Al(OH)3 ]
n(AlO2-)/n(H+)
0
m
2
14
16
VNaOH(mL)
巩固:将某质量的镁铝合金溶解在500mL盐酸中,然后取出10mL溶液用1mol/LNaOH溶液滴定,产生沉淀质量与碱溶液的关系.求:
(1)合金中镁和铝的物质的量之比.
(2)盐酸的物质的量浓度(假设反应后溶液体积不变)
3:2
1.4mol/L
请分析图像的含义
如何将Mg2+ 和Al3+分离?
0
两性的应用二:分离和鉴别
(巩2).下列各组试剂,只用试管和胶头滴管,不用任何试剂就可以鉴别的是( )
A.KOH和Al2(SO4)3 B.稀HCl和Na2CO3 C.CaCl2和Na2CO3 D.Ba(OH)2和NaHSO4
规律总结:常见的不用任何试剂,只需通过不同的
滴加顺序就能鉴别的两种一组的无色溶液有:
硫酸(或盐酸)和NaAlO2 、
AlCl3与NaOH 、
Na2CO3 与 HCl 。
A B
当按不同的滴加顺序相互滴加时发生不同的现象
两性的应用三.反应产物的判断
含amol的KOH溶液与含b molAlCl3溶液反应,若3n(OH-)/ n(Al3+)
Al(OH)3
AlO2-
Al(OH)3和AlO2-
Al(OH)3和Al3+
3
4
AlO2-和OH-
当由于两种反应物的量之比不同而生成不同的产物时,往往发生连续反应。
反应后所得物质的判断可以用数轴法
思考:哪些物质之间反应产物的判断可用数轴法?
总结:多元弱酸及其氧化物(如:CO2、 SO2 、H2S)与碱的反应
Al3+与OH-的反应
AlO2-与H+的反应
节点上是纯净物
节点间是混合物
两性的应用四:有关的框图题:
有短周期元素组成的A、B、C和甲、乙、丙、丁四种化合物有如图所示的转化关系,已知C为密度最小的气体,甲是电解质
乙
NaOH溶液
NaOH溶液
C
B
A
甲
+B
丙
乙
丁
通过量CO2
甲
失去化合物丙
据图示转化关系回答:
(1)写出A、B、乙、
丁物质的化学式。
(2)单质A在元素周
期表中的位置是
丙的电子式
(3)写出下列化学方程式:
A与NaOH溶液反应的化学方程式
乙与过量CO2反应的离子方程式
关键找突破口
两性的应用五:有关的实验探究
五位同学设计了以下由废铝屑制取纯净的氢氧化铝的方案:
H+
NH3·H2O
Al(OH)3
Al3+
③Al
OH-
H+
Al(OH)3
AlO2-
②Al
OH-
CO2
Al(OH)3
AlO2-
④Al
H+
OH-
Al(OH)3
Al3+
①Al
Al(OH)3
Al3+
H+
Al
OH-
AlO2-
⑤Al
① ③
⑤
⑤
实验方案的评价一般从原料的利用率和对环境有无污染等方面来评价
① 1Al(OH)3~3OH-~ 3H+
② 1Al(OH)3~1OH-~ 1H+
③ 1Al(OH)3~3 NH3·H2O ~ 3H+
④ 1Al(OH)3~1 CO2 ~ 1H+
要得到等量Al(OH)3, 消耗酸碱最多的是
消耗酸碱最少的是
最佳方案是
⑤ 1Al(OH)3
3/4AlO2-~ 3/4OH-
1/4Al3+~ 3/4H+
关键是熟记方程式并结合原子守恒来找关系
Al3+
AlO2-
Al(OH)3
3OH-或3NH3·H2O
OH-
4OH-
H+或CO2
3H+
4H+
铝三角关系
重要的铝盐:硫酸铝钾(KAl(SO4)2)
两种不同的金属离子和一种酸根离子组成的盐称为复盐
问题:明矾通常能用来做净水剂,以除去水中
的杂质.为什么呢
明矾水解所产生的胶状的Al(OH)3吸附能力很强,可以吸附水里的杂质,并形成沉淀,使水澄清。
Al3+ + 3 H2O Al(OH)3 + 3 H+
巩固题:选择C
当堂检测答案
3.300ml 或 700ml
4.250ml
1.C
2.(1)CO2
(2) Al3+ +4OH- = AlO2- + 2H2O
(3)2Al+3CuO = Al2O3 +3Cu
课堂小结
1.由周期表中铝的位置推测两性→理论解释氢氧化铝的两性→氢氧化铝两性的应用
2.氢氧化铝两性的应用
(1)现象和图象
(2)分离和鉴别
(3)产物的判断——数轴法
(4)有关的实验设计与评价
(5)框图推断
作业
1.整理和完善学案,熟记“铝三角”的有关离子方程式
复习内容
考纲要求:
1.以氢氧化铝、氧化铝为例了解两性氢氧 化物和两性氧化物的性质。
2.了解氧化铝、氢氧化铝、铝盐的制备方法和主要用途,
3.了解复盐的组成和明矾的性质特征
常见题型:有关反应方程式
实验设计与评价
反应图像
框图题
本节重点:氢氧化铝的两性
知识回顾
Mg Si
B
Al
Ga
观察铝在周期表中的位置,推测铝的化合物Al2O3和Al(OH)3 的性质
理论推测: Al2O3是两性氧化物,Al(OH)3是两性氢氧化物
位于金属和非金属的分界线上
氧化物的分类
酸性氧化物
氧化物
碱性氧化物
AFFILIATED HIGH SCHOOL OF FUJIAN NORMAL UNIVERSITY
两性氧化物
两性氧化物——既能溶于强酸又能溶于强碱生成盐和水
氧化铝的性质:
溶解
电解
灼烧
过滤
酸化
过滤
铝土矿
NaOH溶液
残渣
二氧化碳
滤液
H2O
铝
Al2O3+2NaOH 2NaAlO2+H2O
NaAlO2+CO2+2H2O Al(OH)3↓+NaHCO3
Δ
2Al(OH)3 Al2O3+3H2O
通电
2Al2O3 4Al+3O2↑
[及时巩固]从铝土矿制备铝的过程如下,写出有关化学方程式
问题1:为什么氢氧化铝既能与酸反应又能与碱反应?试用电离平衡理论解释。
碱式电离
偏铝酸根只能在强碱性溶液中存在
铝离子只能在强酸性溶液中存在
氢氧化铝在弱酸、中性、弱碱溶液中存在
酸式电离
重点
氢氧化铝的性质--- 两性
H++AlO2-+H2O Al(OH)3 Al3++3OH-.
【性质巩固】:下列物质中:
①Al2O3 ②Mg(OH)2 ③Al(OH)3
④(NH4 )2 S ⑤NaHCO3 ⑥AlCl3
既能跟硫酸反应,又能跟NaOH溶液反应的是( )
A.①③⑥ B.只有①③
C.只有②③ D.①③④⑤
D
规律总结:
既能和酸反应,又能和碱反应的物质有:
Al、A12O3、Al(OH)3 、弱酸的酸式盐、
弱酸的铵盐等;
问题探究:根据上述电离平衡,推测下列可能现象.
1.在AlCl3 溶液中逐滴加入NaOH至过量,可能现象 写出离子方程式.
2.在NaAlO2溶液中逐滴加入HCl至过量,可能现象 写出离子方程式.
连续反应
Al(OH)3两性的应用
H++AlO2-+H2O Al(OH)3 Al3++3OH-.
两性的应用一:用图象来表现连续反应
请你画出:
1.向AlCl3 溶液中逐滴加入NaOH至过量的图象
1.写出相关的化学方程式
2.以被滴加物质的量为横坐标,沉淀量作为纵坐标
3.确定曲线的始点、折点和终点(注意折点和终点被滴加物质量 的确定)
考查作图、析图的能力
2.向HCl和AlCl3 溶液中逐滴加入NaOH至过量的图象
3.向AlCl3 溶液中逐滴加入氨水至过量的图象
0
m[Al(OH)3 ]
A
4
1
B
3
2
n(NaOH)/n(Al3+)
在NaAlO2溶液中逐渐通入CO2至过量
1/2
2AlO2- + CO2 +3H2O= 2Al(OH)3 + CO32-
AlO2- + CO2 +2H2O= Al(OH)3 + HCO3-
在NaAlO2溶液中逐渐通入HCl至过量
3.在NaOH溶液中逐滴加入AlCl3至过量
Al3++4OH-=AlO2-+2H2O
3AlO2-+Al3++6H2O=4Al(OH)3↓
4.在盐酸中逐滴加入NaAlO2溶液至过量
3AlO2-+Al3++6H2O=4Al(OH)3↓
AlO2-+4H+=Al3++2H2O
总:Al3++3OH- = Al(OH)3↓
1/4
1/3
n [Al(OH)3 ]
n(Al3+)/n(NaOH)
0
总:AlO2-+ H+ + H2O = Al(OH)3 ↓
1/4
1
n [Al(OH)3 ]
n(AlO2-)/n(H+)
0
m
2
14
16
VNaOH(mL)
巩固:将某质量的镁铝合金溶解在500mL盐酸中,然后取出10mL溶液用1mol/LNaOH溶液滴定,产生沉淀质量与碱溶液的关系.求:
(1)合金中镁和铝的物质的量之比.
(2)盐酸的物质的量浓度(假设反应后溶液体积不变)
3:2
1.4mol/L
请分析图像的含义
如何将Mg2+ 和Al3+分离?
0
两性的应用二:分离和鉴别
(巩2).下列各组试剂,只用试管和胶头滴管,不用任何试剂就可以鉴别的是( )
A.KOH和Al2(SO4)3 B.稀HCl和Na2CO3 C.CaCl2和Na2CO3 D.Ba(OH)2和NaHSO4
规律总结:常见的不用任何试剂,只需通过不同的
滴加顺序就能鉴别的两种一组的无色溶液有:
硫酸(或盐酸)和NaAlO2 、
AlCl3与NaOH 、
Na2CO3 与 HCl 。
A B
当按不同的滴加顺序相互滴加时发生不同的现象
两性的应用三.反应产物的判断
含amol的KOH溶液与含b molAlCl3溶液反应,若3
Al(OH)3
AlO2-
Al(OH)3和AlO2-
Al(OH)3和Al3+
3
4
AlO2-和OH-
当由于两种反应物的量之比不同而生成不同的产物时,往往发生连续反应。
反应后所得物质的判断可以用数轴法
思考:哪些物质之间反应产物的判断可用数轴法?
总结:多元弱酸及其氧化物(如:CO2、 SO2 、H2S)与碱的反应
Al3+与OH-的反应
AlO2-与H+的反应
节点上是纯净物
节点间是混合物
两性的应用四:有关的框图题:
有短周期元素组成的A、B、C和甲、乙、丙、丁四种化合物有如图所示的转化关系,已知C为密度最小的气体,甲是电解质
乙
NaOH溶液
NaOH溶液
C
B
A
甲
+B
丙
乙
丁
通过量CO2
甲
失去化合物丙
据图示转化关系回答:
(1)写出A、B、乙、
丁物质的化学式。
(2)单质A在元素周
期表中的位置是
丙的电子式
(3)写出下列化学方程式:
A与NaOH溶液反应的化学方程式
乙与过量CO2反应的离子方程式
关键找突破口
两性的应用五:有关的实验探究
五位同学设计了以下由废铝屑制取纯净的氢氧化铝的方案:
H+
NH3·H2O
Al(OH)3
Al3+
③Al
OH-
H+
Al(OH)3
AlO2-
②Al
OH-
CO2
Al(OH)3
AlO2-
④Al
H+
OH-
Al(OH)3
Al3+
①Al
Al(OH)3
Al3+
H+
Al
OH-
AlO2-
⑤Al
① ③
⑤
⑤
实验方案的评价一般从原料的利用率和对环境有无污染等方面来评价
① 1Al(OH)3~3OH-~ 3H+
② 1Al(OH)3~1OH-~ 1H+
③ 1Al(OH)3~3 NH3·H2O ~ 3H+
④ 1Al(OH)3~1 CO2 ~ 1H+
要得到等量Al(OH)3, 消耗酸碱最多的是
消耗酸碱最少的是
最佳方案是
⑤ 1Al(OH)3
3/4AlO2-~ 3/4OH-
1/4Al3+~ 3/4H+
关键是熟记方程式并结合原子守恒来找关系
Al3+
AlO2-
Al(OH)3
3OH-或3NH3·H2O
OH-
4OH-
H+或CO2
3H+
4H+
铝三角关系
重要的铝盐:硫酸铝钾(KAl(SO4)2)
两种不同的金属离子和一种酸根离子组成的盐称为复盐
问题:明矾通常能用来做净水剂,以除去水中
的杂质.为什么呢
明矾水解所产生的胶状的Al(OH)3吸附能力很强,可以吸附水里的杂质,并形成沉淀,使水澄清。
Al3+ + 3 H2O Al(OH)3 + 3 H+
巩固题:选择C
当堂检测答案
3.300ml 或 700ml
4.250ml
1.C
2.(1)CO2
(2) Al3+ +4OH- = AlO2- + 2H2O
(3)2Al+3CuO = Al2O3 +3Cu
课堂小结
1.由周期表中铝的位置推测两性→理论解释氢氧化铝的两性→氢氧化铝两性的应用
2.氢氧化铝两性的应用
(1)现象和图象
(2)分离和鉴别
(3)产物的判断——数轴法
(4)有关的实验设计与评价
(5)框图推断
作业
1.整理和完善学案,熟记“铝三角”的有关离子方程式
