2021-2022学年度鲁教版九年级化学下册课件 第2节 海水“晒盐” (共36张PPT)
文档属性
| 名称 | 2021-2022学年度鲁教版九年级化学下册课件 第2节 海水“晒盐” (共36张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-01-21 15:04:36 | ||
图片预览










文档简介
(共36张PPT)
LJ九(下)
教学课件
第八单元 海水中的化学
第二节 海水“晒盐”
2000年前的汉代井盐场图
情景引入
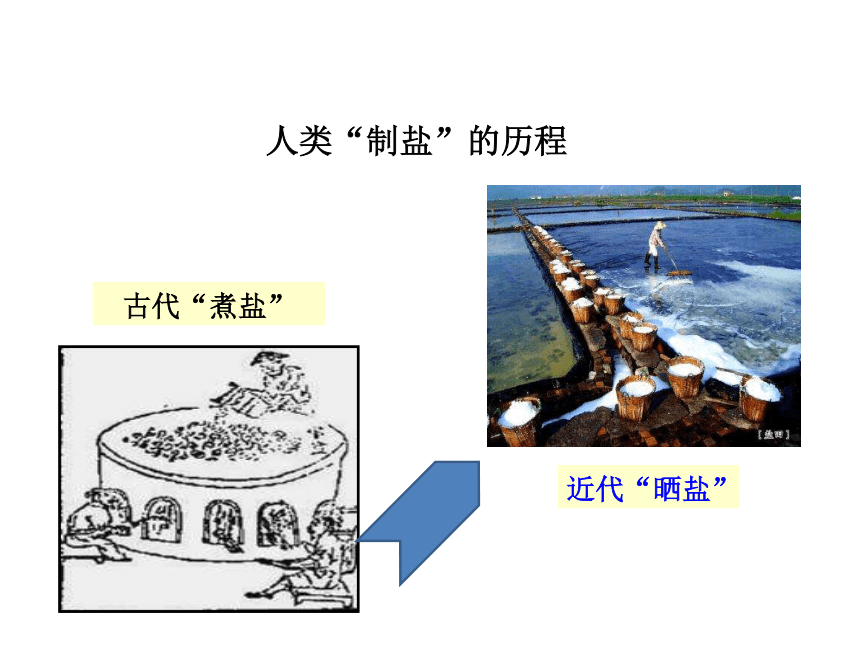
人类“制盐”的历程
古代“煮盐”
近代“晒盐”
开辟盐田 海水“晒盐”
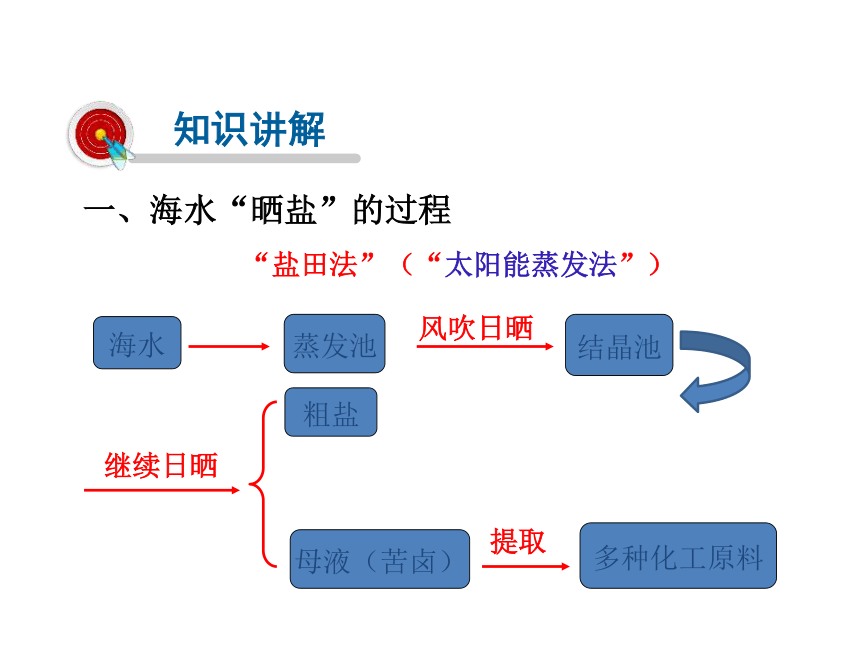
一、海水“晒盐”的过程
海水
蒸发池
结晶池
风吹日晒
继续日晒
粗盐
母液(苦卤)
提取
多种化工原料
“盐田法”(“太阳能蒸发法”)
知识讲解
食盐晶体是在海水中的水完全蒸干,还是蒸发到一定程度以后,水分再蒸发就有析出呢?
蒸发到一定程度就会有晶体析出。
结晶:
固体物质从它的饱和溶液中以晶体的形式析出的过程叫做结晶。
蒸发结晶:
结晶的途径之一。
海水
蒸发水分
食盐饱和溶液
继续蒸发
析出晶体
哪些自然条件有利于海水中的食盐蒸发结晶
阳光充足 风力大
雨量少 湿度低等
☆晶体:具有规则几何外形的固体。
食盐晶体
硫酸铜晶体
硝酸钾晶体
明矾晶体
溶解性是物质的重要物理性质,不同的物质溶解性不同。如氯化钠易溶于水,氢氧化钙微溶于水,而碳酸钙难溶于水。那么,物质的溶解性受那些因素影响呢?
二、溶解度
知识讲解
1.探究溶剂种类对物质溶解性的影响
影响物质溶解性的因素
完成下列实验并记录现象
实验探究
加入10mL水并振荡 加入10mL酒精并振荡
氯化钠 氯化钠溶解 无明显变化
碘 无明显变化 碘溶解
实验结论:物质的溶解性与溶剂的种类有关。
实验用品:托盘天平、量筒、小烧杯、试管、药匙、胶头滴管、玻璃棒、酒精灯、试管夹;蒸馏水、酒精、氯化钠、碘、硝酸钾。
2.探究温度对物质溶解性的影响
影响物质溶解性的因素
请你设计实验探究温度对硝酸钾溶解性的影响。
思路分析:
在实验中需要改变的因素是 ,需要保持不变的因素是 。
实验步骤________________________________________
________________________________________________。
实验现象:___________。
温度
溶剂的种类和溶剂的量
在常温下用试管取5mL蒸馏水,加入硝酸钾晶体至有未溶解的晶体存在,然后在酒精灯上加热
晶体溶解了
总结:溶质的溶解性除了与物质本身的性质有关以外,还受溶剂的种类和温度的影响。
实验结论:在_____________________保持不变的情况下,当升高温度时,硝酸钾晶体在水中的最大溶解量会______;当降低温度时,其最大溶解量会______。
溶剂的种类和溶剂的量
增加
减少
下图中的曲线是以温度为横坐标,以100g水中最多能溶解的硝酸钾的量(g)为纵坐标绘制成的。观察该图,可知:
20℃时,100 g水中最多溶解 g硝酸钾。
60℃时,100 g水中最多溶解 g硝酸钾。
你能用自己的语言说出什么是固体物质的溶解度吗?
31.6
110
31.6
110
做一做:
溶解度的定义:
在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
1.20℃时,100g水中溶解了31.6g硝酸钾达到饱和状态。
2.20℃时,100g水中最多能溶解31.6g硝酸钾。
“20℃时硝酸钾的溶解度为31.6g”其含义是什么?
交流讨论
已知:20℃时,100g水里最多能溶解36g氯化钠。指出下列说法的错误之处。
A.20℃时,10g水中最多能溶解3.6g氯化钠。则20℃时氯 化钠的溶解度为3.6g。
C.20℃时,在100g水中加入30g氯化钠完全溶解,则20℃时,氯化钠的溶解度为30g。
D.20℃时,100g氯化钠的饱和溶液中有27g氯化钠,则20℃时,氯化钠的溶解度为27g 。
E.氯化钠的溶解度为36g。
一定温度
100g溶剂
饱和状态
单位(g)
溶解度 四要素
B.20℃时,氯化钠的溶解度为36。
思考
思路
A
B
C
曲线上的点B:
表示物质在某温度下的溶解度,溶液恰好饱和。
曲线上面的点A:
是饱和溶液,且有未溶解的物质。
曲线下面的点C:
是不饱和溶液。
温度 /℃
溶解度 \
g
气体的溶解度
1.冬天养鱼比夏天活的时间长;
2.打开可乐瓶会有大量气体逸出。
下列信息说明气体的溶解度和哪些因素有关?
小
大
温度越高气体的溶解度越 ;
压强越大气体的溶解度越 。
;
氢氧化钙
观察几种物质的溶解度曲线,总结一下物质的溶解度随温度变化而变化的规律?
溶解度 \
g
温度 /℃
氢氧化钙的溶解度曲线
几种物质的溶解度曲线
认识溶解度曲线
固体物质溶解度的变化规律:
大多数固体物质的溶解度随着温度的升高而增大,如硝酸钾;
少数物质的溶解度受温度影响变化不大,如氯化钠;
极少数物质的溶解度随着温度的升高而减小,如氢氧化钙。
总结:
溶解度与溶解性的关系
(以20℃时的溶解度为标准)
10g
1g
0.01g
易溶物质
可溶物质
微溶物质
难溶物质
蒸发结晶:用于 ; 降温结晶:用于 。
1.算一算:分别将氯化钠和硝酸钾的饱和溶液(溶剂为100g)从100℃降到0℃,各会析出多少克晶体?
2.想一想:为什么要用蒸发结晶的方法从海水中得到食盐,而不用降温结晶的方法?
溶解度受温度影响较小的物质
溶解度受温度影响较大的物质
NaCl析出4.1g ;KNO3析出231.7g。
1.t1℃时 ,B物质的溶解度为 ;
2.点p的含义 ;
3.t3℃时,A、B溶解度的大小为 。
4.温度对A、B的溶解度有何影响?
5.若要从A的饱和溶液中析出A,应采用什
么方法?为什么?
下图是固体物质A、B的溶解度曲线,根据曲线回答以下问题:
溶解度曲线的应用
t2时A、B物质的溶解度相等
随着温度的升高,A、B物质的溶解度变大。
降温结晶,因为温度对A的影响较大。
a
A>B
1.杂质:可溶、不可溶。
2.实验室提纯:
(1)溶解
烧杯、玻璃棒。
仪器:
三、粗盐的提纯
海水“晒盐”得到的粗盐,往往含有可溶性杂质和不可溶性杂质,必须对其进行分离和提纯,才能用于工业生产和人们的日常活动。
知识讲解
(2)过滤
操作要点:
仪器:
烧杯、铁架台、漏斗、玻璃棒。
一贴、二低、三靠。
(3)蒸发
当有大量固体出现时,停止加热,利用余热蒸干剩余的水分。(不能完全蒸干)
仪器:
铁架台、蒸发皿、玻璃棒、酒精灯。
操作要点:
Na+ 、Cl-、SO42- 、Ca2+、 Mg2+
盐酸
Na+、 Cl-、 Ca2+ 、Mg2+、Ba2+
②
①
Na+、 Cl-、 Mg2+、CO32-
Na+ 、Cl-、 CO32-、OH-
过量BaCl2
Na+、 Cl-
过量Na2CO3
过滤
过量NaOH
3.除去可溶性杂质
--化学方法
③
1.结晶有哪两种途径?选择结晶途径的依据是什么?
2.固体物质溶解度的含义是什么?
蒸发结晶:用于 ; 降温结晶:用于 。
溶解度受温度影响较小的物质
溶解度受温度影响较大的物质
在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
归纳总结
4.固体物质的溶解度随温度变化而变化的规律?
固体物质溶解度的变化规律:
大多数固体物质的溶解度随着温度的升高而增大,如硝酸钾;
少数物质的溶解度受温度影响变化不大,如氯化钠;
极少数物质的溶解度随着温度的升高而减小,如氢氧化钙。
3.气体溶解度与压强和温度有关,随压强增大而增大,随温度升高而减少。
5.溶解度曲线图上的点各有哪些含义?
曲线上的点B:
表示物质在某温度下的溶解度,溶液恰好饱和。
曲线上面的点A:
是饱和溶液,且有未溶解的物质。
曲线下面的点C:
是不饱和溶液。
6.除去粗盐中的难溶性杂质的步骤有溶解、过滤和蒸发;除去可溶性杂质可利用化学方法。
C
跟进训练
1.下列关于海水晒盐原理的分析,你认为正确的是( )
A.利用阳光照射使海水升温得到食盐
B.利用海风降温析出食盐
C.利用阳光和风力使水分蒸发得到食盐
D.利用阳光分解海水得到食盐
A
2.关于饱和溶液的说法中不正确的是( )
A.饱和溶液就是不再溶解任何溶质的溶液
B.饱和溶液是有条件的,即一定温度,一定量溶剂
C.饱和溶液和不饱和溶液可以相互转化
D.改变温度或者蒸发溶剂能使不饱和溶液变成饱和溶液
⑴由此推测出温度的改变是 (填“升温”或“降温”)。
⑵同时观察到烧杯底部KNO3晶体 (填“增多”或“减少”)。
3. 一木块飘浮于50℃时KNO3的饱和溶液中,如图a所示,当温度改变时(不考虑由此引起的木块和溶液体积的变化),木块排开液体的体积(V排)随时间(t)发生了如图b所示的变化。
0
t
V排
降温
增多
b
a
LJ九(下)
教学课件
第八单元 海水中的化学
第二节 海水“晒盐”
2000年前的汉代井盐场图
情景引入
人类“制盐”的历程
古代“煮盐”
近代“晒盐”
开辟盐田 海水“晒盐”
一、海水“晒盐”的过程
海水
蒸发池
结晶池
风吹日晒
继续日晒
粗盐
母液(苦卤)
提取
多种化工原料
“盐田法”(“太阳能蒸发法”)
知识讲解
食盐晶体是在海水中的水完全蒸干,还是蒸发到一定程度以后,水分再蒸发就有析出呢?
蒸发到一定程度就会有晶体析出。
结晶:
固体物质从它的饱和溶液中以晶体的形式析出的过程叫做结晶。
蒸发结晶:
结晶的途径之一。
海水
蒸发水分
食盐饱和溶液
继续蒸发
析出晶体
哪些自然条件有利于海水中的食盐蒸发结晶
阳光充足 风力大
雨量少 湿度低等
☆晶体:具有规则几何外形的固体。
食盐晶体
硫酸铜晶体
硝酸钾晶体
明矾晶体
溶解性是物质的重要物理性质,不同的物质溶解性不同。如氯化钠易溶于水,氢氧化钙微溶于水,而碳酸钙难溶于水。那么,物质的溶解性受那些因素影响呢?
二、溶解度
知识讲解
1.探究溶剂种类对物质溶解性的影响
影响物质溶解性的因素
完成下列实验并记录现象
实验探究
加入10mL水并振荡 加入10mL酒精并振荡
氯化钠 氯化钠溶解 无明显变化
碘 无明显变化 碘溶解
实验结论:物质的溶解性与溶剂的种类有关。
实验用品:托盘天平、量筒、小烧杯、试管、药匙、胶头滴管、玻璃棒、酒精灯、试管夹;蒸馏水、酒精、氯化钠、碘、硝酸钾。
2.探究温度对物质溶解性的影响
影响物质溶解性的因素
请你设计实验探究温度对硝酸钾溶解性的影响。
思路分析:
在实验中需要改变的因素是 ,需要保持不变的因素是 。
实验步骤________________________________________
________________________________________________。
实验现象:___________。
温度
溶剂的种类和溶剂的量
在常温下用试管取5mL蒸馏水,加入硝酸钾晶体至有未溶解的晶体存在,然后在酒精灯上加热
晶体溶解了
总结:溶质的溶解性除了与物质本身的性质有关以外,还受溶剂的种类和温度的影响。
实验结论:在_____________________保持不变的情况下,当升高温度时,硝酸钾晶体在水中的最大溶解量会______;当降低温度时,其最大溶解量会______。
溶剂的种类和溶剂的量
增加
减少
下图中的曲线是以温度为横坐标,以100g水中最多能溶解的硝酸钾的量(g)为纵坐标绘制成的。观察该图,可知:
20℃时,100 g水中最多溶解 g硝酸钾。
60℃时,100 g水中最多溶解 g硝酸钾。
你能用自己的语言说出什么是固体物质的溶解度吗?
31.6
110
31.6
110
做一做:
溶解度的定义:
在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
1.20℃时,100g水中溶解了31.6g硝酸钾达到饱和状态。
2.20℃时,100g水中最多能溶解31.6g硝酸钾。
“20℃时硝酸钾的溶解度为31.6g”其含义是什么?
交流讨论
已知:20℃时,100g水里最多能溶解36g氯化钠。指出下列说法的错误之处。
A.20℃时,10g水中最多能溶解3.6g氯化钠。则20℃时氯 化钠的溶解度为3.6g。
C.20℃时,在100g水中加入30g氯化钠完全溶解,则20℃时,氯化钠的溶解度为30g。
D.20℃时,100g氯化钠的饱和溶液中有27g氯化钠,则20℃时,氯化钠的溶解度为27g 。
E.氯化钠的溶解度为36g。
一定温度
100g溶剂
饱和状态
单位(g)
溶解度 四要素
B.20℃时,氯化钠的溶解度为36。
思考
思路
A
B
C
曲线上的点B:
表示物质在某温度下的溶解度,溶液恰好饱和。
曲线上面的点A:
是饱和溶液,且有未溶解的物质。
曲线下面的点C:
是不饱和溶液。
温度 /℃
溶解度 \
g
气体的溶解度
1.冬天养鱼比夏天活的时间长;
2.打开可乐瓶会有大量气体逸出。
下列信息说明气体的溶解度和哪些因素有关?
小
大
温度越高气体的溶解度越 ;
压强越大气体的溶解度越 。
;
氢氧化钙
观察几种物质的溶解度曲线,总结一下物质的溶解度随温度变化而变化的规律?
溶解度 \
g
温度 /℃
氢氧化钙的溶解度曲线
几种物质的溶解度曲线
认识溶解度曲线
固体物质溶解度的变化规律:
大多数固体物质的溶解度随着温度的升高而增大,如硝酸钾;
少数物质的溶解度受温度影响变化不大,如氯化钠;
极少数物质的溶解度随着温度的升高而减小,如氢氧化钙。
总结:
溶解度与溶解性的关系
(以20℃时的溶解度为标准)
10g
1g
0.01g
易溶物质
可溶物质
微溶物质
难溶物质
蒸发结晶:用于 ; 降温结晶:用于 。
1.算一算:分别将氯化钠和硝酸钾的饱和溶液(溶剂为100g)从100℃降到0℃,各会析出多少克晶体?
2.想一想:为什么要用蒸发结晶的方法从海水中得到食盐,而不用降温结晶的方法?
溶解度受温度影响较小的物质
溶解度受温度影响较大的物质
NaCl析出4.1g ;KNO3析出231.7g。
1.t1℃时 ,B物质的溶解度为 ;
2.点p的含义 ;
3.t3℃时,A、B溶解度的大小为 。
4.温度对A、B的溶解度有何影响?
5.若要从A的饱和溶液中析出A,应采用什
么方法?为什么?
下图是固体物质A、B的溶解度曲线,根据曲线回答以下问题:
溶解度曲线的应用
t2时A、B物质的溶解度相等
随着温度的升高,A、B物质的溶解度变大。
降温结晶,因为温度对A的影响较大。
a
A>B
1.杂质:可溶、不可溶。
2.实验室提纯:
(1)溶解
烧杯、玻璃棒。
仪器:
三、粗盐的提纯
海水“晒盐”得到的粗盐,往往含有可溶性杂质和不可溶性杂质,必须对其进行分离和提纯,才能用于工业生产和人们的日常活动。
知识讲解
(2)过滤
操作要点:
仪器:
烧杯、铁架台、漏斗、玻璃棒。
一贴、二低、三靠。
(3)蒸发
当有大量固体出现时,停止加热,利用余热蒸干剩余的水分。(不能完全蒸干)
仪器:
铁架台、蒸发皿、玻璃棒、酒精灯。
操作要点:
Na+ 、Cl-、SO42- 、Ca2+、 Mg2+
盐酸
Na+、 Cl-、 Ca2+ 、Mg2+、Ba2+
②
①
Na+、 Cl-、 Mg2+、CO32-
Na+ 、Cl-、 CO32-、OH-
过量BaCl2
Na+、 Cl-
过量Na2CO3
过滤
过量NaOH
3.除去可溶性杂质
--化学方法
③
1.结晶有哪两种途径?选择结晶途径的依据是什么?
2.固体物质溶解度的含义是什么?
蒸发结晶:用于 ; 降温结晶:用于 。
溶解度受温度影响较小的物质
溶解度受温度影响较大的物质
在一定温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂里的溶解度。
归纳总结
4.固体物质的溶解度随温度变化而变化的规律?
固体物质溶解度的变化规律:
大多数固体物质的溶解度随着温度的升高而增大,如硝酸钾;
少数物质的溶解度受温度影响变化不大,如氯化钠;
极少数物质的溶解度随着温度的升高而减小,如氢氧化钙。
3.气体溶解度与压强和温度有关,随压强增大而增大,随温度升高而减少。
5.溶解度曲线图上的点各有哪些含义?
曲线上的点B:
表示物质在某温度下的溶解度,溶液恰好饱和。
曲线上面的点A:
是饱和溶液,且有未溶解的物质。
曲线下面的点C:
是不饱和溶液。
6.除去粗盐中的难溶性杂质的步骤有溶解、过滤和蒸发;除去可溶性杂质可利用化学方法。
C
跟进训练
1.下列关于海水晒盐原理的分析,你认为正确的是( )
A.利用阳光照射使海水升温得到食盐
B.利用海风降温析出食盐
C.利用阳光和风力使水分蒸发得到食盐
D.利用阳光分解海水得到食盐
A
2.关于饱和溶液的说法中不正确的是( )
A.饱和溶液就是不再溶解任何溶质的溶液
B.饱和溶液是有条件的,即一定温度,一定量溶剂
C.饱和溶液和不饱和溶液可以相互转化
D.改变温度或者蒸发溶剂能使不饱和溶液变成饱和溶液
⑴由此推测出温度的改变是 (填“升温”或“降温”)。
⑵同时观察到烧杯底部KNO3晶体 (填“增多”或“减少”)。
3. 一木块飘浮于50℃时KNO3的饱和溶液中,如图a所示,当温度改变时(不考虑由此引起的木块和溶液体积的变化),木块排开液体的体积(V排)随时间(t)发生了如图b所示的变化。
0
t
V排
降温
增多
b
a
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
