2021-2022学年度鲁教版九年级化学下册课件 到实验室去:探究金属的性质(17张PPT)
文档属性
| 名称 | 2021-2022学年度鲁教版九年级化学下册课件 到实验室去:探究金属的性质(17张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 623.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-12 16:08:47 | ||
图片预览





文档简介
(共17张PPT)
LJ九(下)
教学课件
第九单元 金 属
到实验室去: 探究金属的性质
1.探究金属的物理性质,认识金属材料在日常生活中的用途。
2.探究金属的化学性质,认识金属活动性顺序,了解防止金属腐蚀的简单方法。
实验探究
明确任务:
1.一些生活中常用的物品:如细铜丝、细铁丝、铁钉、铝箔、白炽灯的灯丝、订书钉、易拉罐、铝合金制品、不锈钢餐具等;电池、小灯泡、导线、磁铁、砂纸、火柴。
2.实验室中的试剂和仪器:铝粉、镁带、锌片、铁粉、稀盐酸、稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硝酸银溶液、氯化钠溶液、坩埚钳、酒精灯、药匙、试管。
实验用品:
友情提示:
1.探索金属与氧气的反应时要用坩埚钳夹持金属反应物,防止烫伤。
2.本次实验用到的液体试剂有的具有腐蚀性,应正确取用、规范操作,防止发生意外。
3.镁带燃烧时会发出耀眼的白光,要注意保护眼睛。
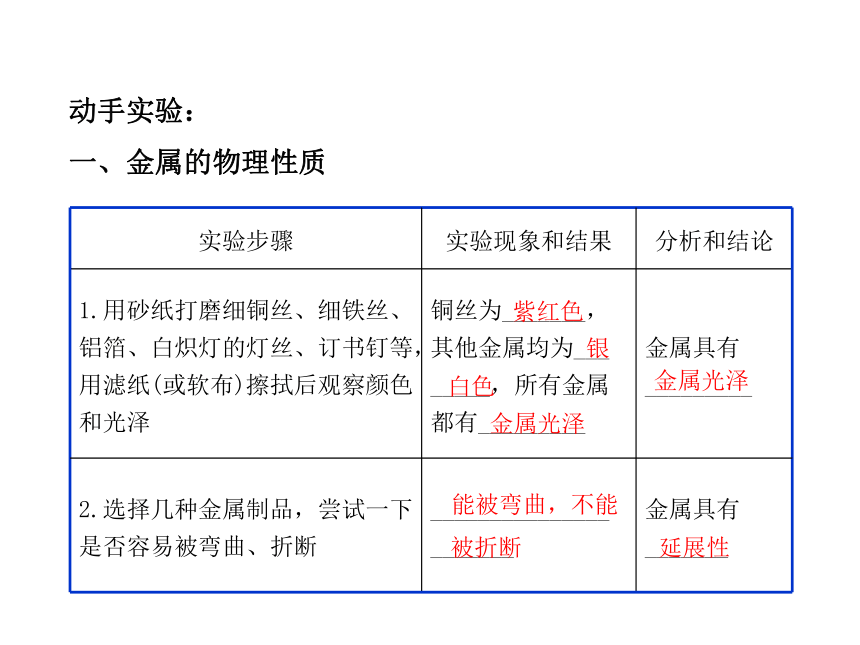
一、金属的物理性质
实验步骤 实验现象和结果 分析和结论
1.用砂纸打磨细铜丝、细铁丝、铝箔、白炽灯的灯丝、订书钉等,用滤纸(或软布)擦拭后观察颜色和光泽 铜丝为_______,
其他金属均为___
_____,所有金属
都有_________ 金属具有
_________
2.选择几种金属制品,尝试一下是否容易被弯曲、折断 _______________
_______ 金属具有
_______
紫红色
银
白色
金属光泽
金属光泽
能被弯曲,不能
被折断
延展性
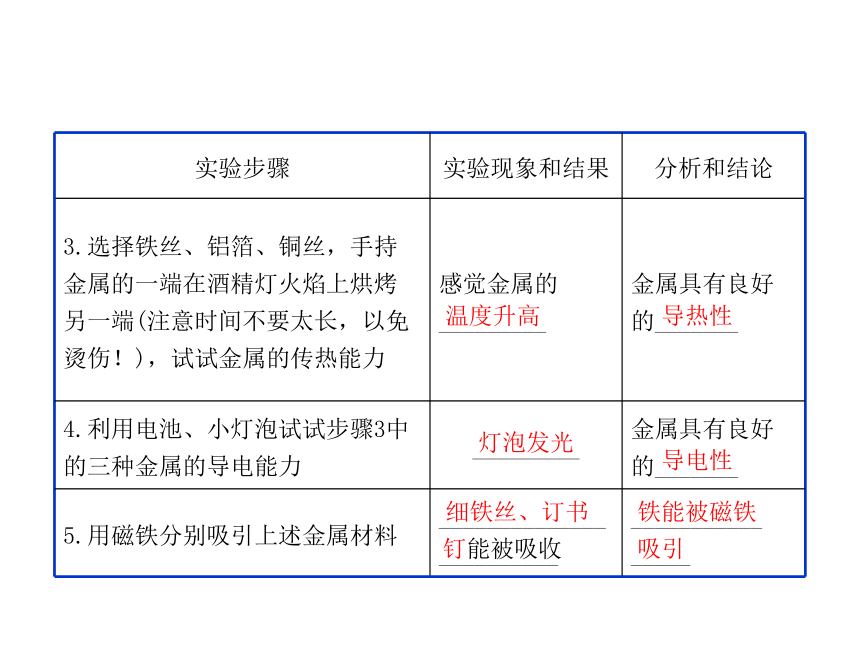
动手实验:
实验步骤 实验现象和结果 分析和结论
3.选择铁丝、铝箔、铜丝,手持
金属的一端在酒精灯火焰上烘烤
另一端(注意时间不要太长,以免
烫伤!),试试金属的传热能力 感觉金属的
_________ 金属具有良好
的_______
4.利用电池、小灯泡试试步骤3中
的三种金属的导电能力 _________ 金属具有良好
的_______
5.用磁铁分别吸引上述金属材料 ______________
__________ ___________
_____
温度升高
导热性
灯泡发光
导电性
细铁丝、订书
钉能被吸收
铁能被磁铁
吸引
二、金属的化学性质
1.金属与氧气反应
实验步骤 实验现象和结果 分析和结论
1.取少量铝粉,均匀地平摊
在滤纸上,再将滤纸小心地
卷起来,用坩埚钳夹持,在
酒精灯上点燃 _____________
___________ ___________
_________
2.用坩埚钳夹取一段用砂纸打磨过的镁带,在酒精灯上点燃 _______________
_______________
___________ ___________
_______
剧烈燃烧,生
成白色固体
铝粉能在空
气中燃烧
剧烈燃烧,发出
耀眼的强光,生
成白色固体
镁能在空气
中燃烧
2.探究锌、铁、铜三种金属的活动性顺序
实验步骤 实验现象和结果 分析和结论
1.取1 mL~2 mL 硫酸亚铁溶液放于试管中,再将锌粒放入试管中,观察现象 _______________
_______
锌粒表面有______
___________ _______________
_______________
2.取1 mL~2 mL 硫酸亚铁溶液放于试管中,再将铜丝插入溶液中,观察现象 ___________ ________________
_______________
溶液由浅绿色变
为无色
许多黑
色物质析出
锌能将铁置换出
来,锌比铁活泼
无明显现象
铜不能将铁置换出
来,铁比铜活泼
三种金属的活动性大小顺序为_________。
锌>铁>铜
1.金属有哪些共性?金属的用途与性质之间有什么关系?
提示:大多数金属都具有金属光泽,密度和硬度较大,熔、沸点较高,具有良好的延展性、导电性和导热性。性质决定用途。
交流讨论
2.我国古代就发明了湿法冶金技术,其基本原理是什么?金属与盐溶液反应有什么规律?你能想到哪些化学方法来判断金属的活动性顺序?
提示:湿法冶金术就是利用金属与盐溶液发生置换反应的原理;在金属活动性顺序中,位置在前的金属可以把位于其后的金属从其盐溶液中置换出来;根据在空气中燃烧的剧烈程度可判断其活泼性等。
1.食品包装袋中经常使用到铝箔,铝能制成铝箔是因为铝具有良好的( )
A.导电性 B.抗腐蚀性
C.导热性 D.延展性
跟进训练
D
2.冬天在公共汽车上,抓住金属把手比抓住塑料把手要冷得多,这是因为( )
A.金属易导电 B.金属易导热
C.金属有金属光泽 D.金属温度低
B
3.现有X、Y、Z三种金属,将它们分别投入到稀盐酸中,Y无反应;如果把X、Z分别插入硫酸锌溶液中,过一会儿,在X的表面有锌析出,而Z没有变化。根据以上事实,判断X、Y、Z的金属活动性顺序正确的是( )
A.Y>X>Z B.Z>X>Y
C.X>Z>Y D.X>Y>Z
C
4.向AgNO3溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列四种说法:
①向滤渣中加入稀盐酸,一定有气泡产生;
②向滤液中加入稀盐酸,一定有沉淀产生;
③滤渣中一定含有Ag;
④滤液中一定含有Fe(NO3)2,一定不含AgNO3,可能含有Al(NO3)3。
以上说法正确的个数为( )
A.0个 B.1个 C.2个 D. 3个
B
【解析】选B。三种金属活动性由强到弱的顺序:铝>铁>银,由于铝、铁的活动性都比银强,所以可以置换出银,则滤渣中一定有银,③正确;反应后得到浅绿色滤液说明铝全部与硝酸银反应生成Al(NO3)3,铁与剩余的硝酸银继续反应生成Fe(NO3)2,此时滤液中一定含有Fe(NO3)2,Al(NO3)3,可能含有AgNO3,④错误;硝酸银与盐酸反应生成沉淀,可能含有AgNO3,故滤液中加入稀盐酸,可能有沉淀产生,②错误;铝、铁都可与盐酸反应放出气体,反应后得到浅绿色滤液说明铝全部参与无剩余,铁参与反应,无法确定铁是否有剩余,故向滤渣中加入稀盐酸,可能有气泡产生,①错误。故B正确。
5.(1)铁在潮湿的空气中表面易生成一种暗红色的固体,其主要成分的化学式为________。
(2)铁丝在纯净的氧气中燃烧的化学方程式为________________________。
(3)将少量的铁粉加入到足量的硫酸铜溶液中,反应结束后,溶液中含有的金属离子是 ________,反应的化学方程式为___________________。
Fe2O3
3Fe+2O2 Fe3O4
高温
====
Fe2+、Cu2+
Fe+CuSO4==FeSO4+Cu
LJ九(下)
教学课件
第九单元 金 属
到实验室去: 探究金属的性质
1.探究金属的物理性质,认识金属材料在日常生活中的用途。
2.探究金属的化学性质,认识金属活动性顺序,了解防止金属腐蚀的简单方法。
实验探究
明确任务:
1.一些生活中常用的物品:如细铜丝、细铁丝、铁钉、铝箔、白炽灯的灯丝、订书钉、易拉罐、铝合金制品、不锈钢餐具等;电池、小灯泡、导线、磁铁、砂纸、火柴。
2.实验室中的试剂和仪器:铝粉、镁带、锌片、铁粉、稀盐酸、稀硫酸、硫酸亚铁溶液、硫酸铜溶液、硝酸银溶液、氯化钠溶液、坩埚钳、酒精灯、药匙、试管。
实验用品:
友情提示:
1.探索金属与氧气的反应时要用坩埚钳夹持金属反应物,防止烫伤。
2.本次实验用到的液体试剂有的具有腐蚀性,应正确取用、规范操作,防止发生意外。
3.镁带燃烧时会发出耀眼的白光,要注意保护眼睛。
一、金属的物理性质
实验步骤 实验现象和结果 分析和结论
1.用砂纸打磨细铜丝、细铁丝、铝箔、白炽灯的灯丝、订书钉等,用滤纸(或软布)擦拭后观察颜色和光泽 铜丝为_______,
其他金属均为___
_____,所有金属
都有_________ 金属具有
_________
2.选择几种金属制品,尝试一下是否容易被弯曲、折断 _______________
_______ 金属具有
_______
紫红色
银
白色
金属光泽
金属光泽
能被弯曲,不能
被折断
延展性
动手实验:
实验步骤 实验现象和结果 分析和结论
3.选择铁丝、铝箔、铜丝,手持
金属的一端在酒精灯火焰上烘烤
另一端(注意时间不要太长,以免
烫伤!),试试金属的传热能力 感觉金属的
_________ 金属具有良好
的_______
4.利用电池、小灯泡试试步骤3中
的三种金属的导电能力 _________ 金属具有良好
的_______
5.用磁铁分别吸引上述金属材料 ______________
__________ ___________
_____
温度升高
导热性
灯泡发光
导电性
细铁丝、订书
钉能被吸收
铁能被磁铁
吸引
二、金属的化学性质
1.金属与氧气反应
实验步骤 实验现象和结果 分析和结论
1.取少量铝粉,均匀地平摊
在滤纸上,再将滤纸小心地
卷起来,用坩埚钳夹持,在
酒精灯上点燃 _____________
___________ ___________
_________
2.用坩埚钳夹取一段用砂纸打磨过的镁带,在酒精灯上点燃 _______________
_______________
___________ ___________
_______
剧烈燃烧,生
成白色固体
铝粉能在空
气中燃烧
剧烈燃烧,发出
耀眼的强光,生
成白色固体
镁能在空气
中燃烧
2.探究锌、铁、铜三种金属的活动性顺序
实验步骤 实验现象和结果 分析和结论
1.取1 mL~2 mL 硫酸亚铁溶液放于试管中,再将锌粒放入试管中,观察现象 _______________
_______
锌粒表面有______
___________ _______________
_______________
2.取1 mL~2 mL 硫酸亚铁溶液放于试管中,再将铜丝插入溶液中,观察现象 ___________ ________________
_______________
溶液由浅绿色变
为无色
许多黑
色物质析出
锌能将铁置换出
来,锌比铁活泼
无明显现象
铜不能将铁置换出
来,铁比铜活泼
三种金属的活动性大小顺序为_________。
锌>铁>铜
1.金属有哪些共性?金属的用途与性质之间有什么关系?
提示:大多数金属都具有金属光泽,密度和硬度较大,熔、沸点较高,具有良好的延展性、导电性和导热性。性质决定用途。
交流讨论
2.我国古代就发明了湿法冶金技术,其基本原理是什么?金属与盐溶液反应有什么规律?你能想到哪些化学方法来判断金属的活动性顺序?
提示:湿法冶金术就是利用金属与盐溶液发生置换反应的原理;在金属活动性顺序中,位置在前的金属可以把位于其后的金属从其盐溶液中置换出来;根据在空气中燃烧的剧烈程度可判断其活泼性等。
1.食品包装袋中经常使用到铝箔,铝能制成铝箔是因为铝具有良好的( )
A.导电性 B.抗腐蚀性
C.导热性 D.延展性
跟进训练
D
2.冬天在公共汽车上,抓住金属把手比抓住塑料把手要冷得多,这是因为( )
A.金属易导电 B.金属易导热
C.金属有金属光泽 D.金属温度低
B
3.现有X、Y、Z三种金属,将它们分别投入到稀盐酸中,Y无反应;如果把X、Z分别插入硫酸锌溶液中,过一会儿,在X的表面有锌析出,而Z没有变化。根据以上事实,判断X、Y、Z的金属活动性顺序正确的是( )
A.Y>X>Z B.Z>X>Y
C.X>Z>Y D.X>Y>Z
C
4.向AgNO3溶液中加入一定质量的Al和Fe的混合粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列四种说法:
①向滤渣中加入稀盐酸,一定有气泡产生;
②向滤液中加入稀盐酸,一定有沉淀产生;
③滤渣中一定含有Ag;
④滤液中一定含有Fe(NO3)2,一定不含AgNO3,可能含有Al(NO3)3。
以上说法正确的个数为( )
A.0个 B.1个 C.2个 D. 3个
B
【解析】选B。三种金属活动性由强到弱的顺序:铝>铁>银,由于铝、铁的活动性都比银强,所以可以置换出银,则滤渣中一定有银,③正确;反应后得到浅绿色滤液说明铝全部与硝酸银反应生成Al(NO3)3,铁与剩余的硝酸银继续反应生成Fe(NO3)2,此时滤液中一定含有Fe(NO3)2,Al(NO3)3,可能含有AgNO3,④错误;硝酸银与盐酸反应生成沉淀,可能含有AgNO3,故滤液中加入稀盐酸,可能有沉淀产生,②错误;铝、铁都可与盐酸反应放出气体,反应后得到浅绿色滤液说明铝全部参与无剩余,铁参与反应,无法确定铁是否有剩余,故向滤渣中加入稀盐酸,可能有气泡产生,①错误。故B正确。
5.(1)铁在潮湿的空气中表面易生成一种暗红色的固体,其主要成分的化学式为________。
(2)铁丝在纯净的氧气中燃烧的化学方程式为________________________。
(3)将少量的铁粉加入到足量的硫酸铜溶液中,反应结束后,溶液中含有的金属离子是 ________,反应的化学方程式为___________________。
Fe2O3
3Fe+2O2 Fe3O4
高温
====
Fe2+、Cu2+
Fe+CuSO4==FeSO4+Cu
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
