人教版(五四制)八年级全一册化学 第五单元 课题1 质量守恒定律(课件)(31张PPT)
文档属性
| 名称 | 人教版(五四制)八年级全一册化学 第五单元 课题1 质量守恒定律(课件)(31张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-12 16:21:43 | ||
图片预览










文档简介
(共31张PPT)
质量守恒定律
狄仁杰的迷惑
1.为什么蜡烛燃烧后质量会变小了呢?
2.为什么铁刀放置一段时间后质量会增加呢?
化学反应前后:
反应物的总质量
生成物的总质量
实验1:白磷燃烧 前后 质量的测定
看书:P93页注意
思考和分析:
1、反应物、生成物的状态及变化;
2、实验中观察到的总质量变化情况。
序号 实验现象
实验1 ① 红磷燃烧,产生大量白烟;气球先胀大,后变小,最后压扁。
② 反应后,天平平衡。
② 气球的作用
P + O2 P2O5
点燃
③ 细沙的作用
—— 防止胶塞被冲开
思考:
① 气球的变化及原因
—— 防止锥形瓶受热不均而炸裂
锥形瓶
细砂
橡皮塞
玻璃管、气球
(空气)
氧气
氮气
白磷
锥形瓶
细砂
橡皮塞
玻璃管、气球
五氧化二磷
(剩余气体)
氮气
稀有气体等
稀有气体等
白磷
五氧化二磷
氧气
对比反应前后,你发现了什么?
反应前
反应后
白磷质量+氧气质量=五氧化二磷质量
实验2:铁和硫酸铜溶液反前后质量的测定
反应表达式:
铁 + 硫酸铜 → 铜 + 硫酸亚铁
Fe + CuSO4 → Cu + FeSO4
反应前的总质量m1
反应后的总质量m2
序号 实验现象
实验2 ① 铁钉表面有红色物质出现;溶液由蓝色渐渐变成浅绿色。
② 反应后,天平平衡。
溶液为蓝色
Fe + CuSO4 Cu + FeSO4
溶液为浅绿色
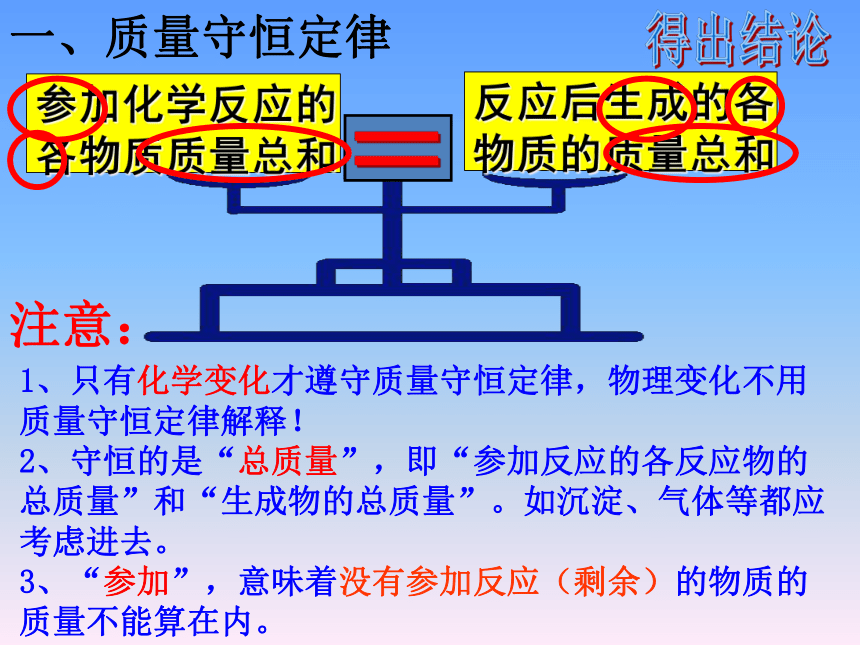
参加化学反应的
各物质质量总和
反应后生成的各
物质的质量总和
一、质量守恒定律
1、只有化学变化才遵守质量守恒定律,物理变化不用质量守恒定律解释!
2、守恒的是“总质量”,即“参加反应的各反应物的总质量”和“生成物的总质量”。如沉淀、气体等都应考虑进去。
3、“参加”,意味着没有参加反应(剩余)的物质的质量不能算在内。
注意:
想一想
你预计这个反应前后的称量结果是否会有变化?
实验3:碳酸钠与稀盐酸反应前后质量的测定
碳酸钠
粉末
盐酸
镁 + 氧气 → 氧化镁
Mg O2 MgO
点燃
镁 + 氧气 → 氧化镁
Mg O2 MgO
点燃
实验4:镁条燃烧前后质量的测定
想一想
你预计这个反应前后的称量结果是否会有变化?
看书:P95页讨论1
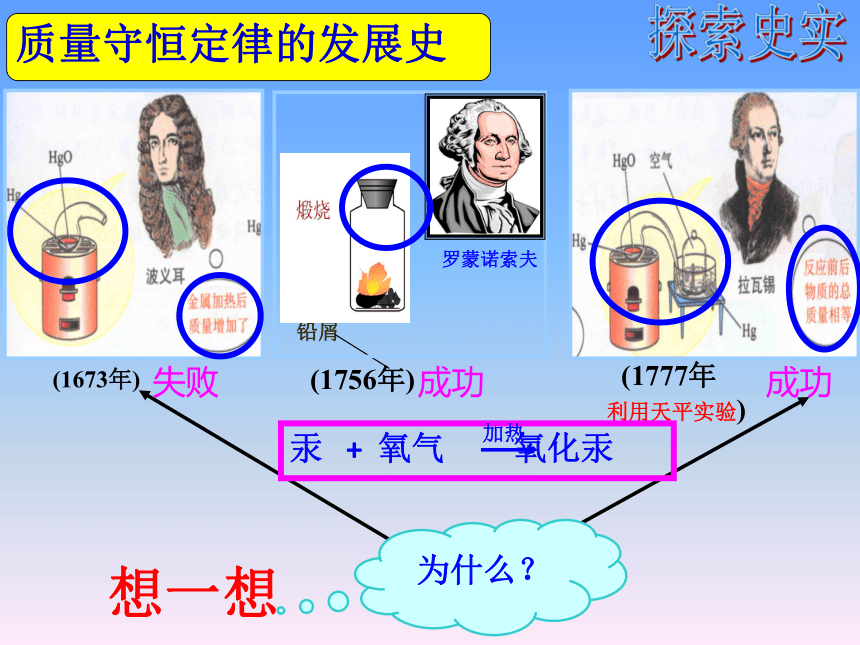
铅屑
成功
(1777年
利用天平实验)
(1673年)
失败
罗蒙诺索夫
成功
(1756年)
想一想
为什么?
汞 + 氧气 氧化汞
加热
质量守恒定律的发展史
查阅资料:
1.蜡烛燃烧后生成二氧化碳和水
2.铁放置在空气中一段时间后,它会与空气中
的氧气、水反应,生成铁锈
解释狄仁杰的迷惑
1.为什么蜡烛燃烧后质量会变小了?
2.为什么铁刀放置一段时间后质量会增加呢?
蜡烛燃烧生成的水和二氧化碳逸散到空气去了,剩余的固体的质量当然比原来的质量小。
参加化学反应的
各物质质量总和
反应后生成的各
物质的质量总和
一、质量守恒定律
1、适用于一切化学变化,物理变化不用质量守恒定律解释!
2、守恒的是“总质量”。如有沉淀、气体生成都应考虑进去。设计有气体参加或生成实验时,装置必须密闭
3、“参加”,意味着没有参加反应(剩余)的物质的质量不能算在内。
注意:
P + O2 P2O5
点燃
Fe + CuSO4 → Cu + FeSO4
盐酸 + 碳酸钠 → 氯化钠 + 水 +二氧化碳
HCl Na2CO3 NaCl H2O CO2
Mg + O2 MgO
点燃
破裂
重新组合
H2O
为什么物质在发生化学反应前后,各物质的质量总和相等呢?
原子的种类、数目、质量没有变化
宏观
原子数目不变
原子质量不变
原子种类不变
微观
物质总质量守恒
2、质量守恒的原因
元素的质量不变
元素的种类不变
注意:在化学反应中,分子的种类一定改变;而分子的数目可能发生变化。
参加化学反应的
各物质质量总和
反应后生成的各
物质的质量总和
适用于一切化学变化
课题1 质量守恒定律
内容
守恒原因
原子数目不增减
原子质量不变化
原子种类不改变
元素的质量不变
元素的种类不变
解释现象
简单的计算
推测物质的组成
应用
1、高锰酸钾受热分解后,剩余固体的质量比原反应的质量小。
答:根据质量守恒定律得:参加反应的高锰酸钾的质量等于反应后生成的锰酸钾、二氧化锰和氧气的质量之和,由于氧气逸散到空气去了,剩余的固体的质量当然比原来高锰酸钾的质量小。
KMnO4 K2MnO4 + MnO2 + O2
2、下列现象可用质量守恒定律解释的是 ( )
A. 烧烤摊上的木炭在空气中燃烧后化为灰烬,
灰烬的质量比木炭的质量减小了
B. 10 g蔗糖溶于90 g水中,总质量为100 g
C. 氯酸钾受热分解后,剩余固体的质量比反应物的
质量减少了
D. 5g水受热变成了5g水蒸汽
A C
5. 密闭容器内有A、B、C、D、四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
物 质 A B C D
反应前质量(g) 19 8 32 2
反应后质量(g) m 18 0 8
(1)、m=
(2)、该反应属于哪种基本类型?
35
分解反应
4、在反应A+B=C+D中,已知11g A与一定量B恰好完全反应,生成12g C和8gD,则在此反应参加反应的B的质量为:
9g
参加反应或生成的物质质量(g)
生成10g
参加反应32g
生成6g
生成16g
7、蜡烛在空气中完全燃烧后,生成二氧化碳和水,则蜡烛中肯定含有 元素,可能含有 元素
C 、H
O
蜡烛 + O2 CO2 + H2O
点燃
6、碳酸受热分解后生成二氧化碳和水,则碳酸中含有 元素,
C 、H、O
碳酸 CO2 + H2O
加热
8. 根据反应3NO2 + H2O = 2HNO3 + X,推断X的化学式为 ( )
A、N2 B、NO
C、N2O3 D、N2O5
B
参加化学反应的
各物质质量总和
反应后生成的各
物质的质量总和
适用于一切化学变化
课题1 质量守恒定律
1、内容
2、守恒 原因
元素的质量不变
元素的种类不变
解释现象
简单的计算
推测物质的组成
3、应用
原子数目不增减
原子质量不变化
原子种类不改变
一、质量守恒定律的应用
(2)通过对比,你认为下列哪种描述方式最好?好在哪里?
1、在点燃的条件下,碳与氧气反应生成二氧化碳。
2、碳 + 氧气 二氧化碳
点燃
3、C + O2 CO2
点燃
思考:(1)你能用哪些方式来描述碳在空气中燃烧?
(语言表达)
(文字表达式)
(符号表达式)
体现出质量守恒(即:原子种类、个数没有发生变化)
反应物
生成物
“反应条件”
点燃
( 化学方程式)
二 、化学方程式
(一) 定义:用化学式表示化学反应的式子
点燃
C + O2 CO2
如: P + O2 P2O5
点燃
4
5
2
1、标明了反应物、生成物、反应的条件
12 : 32 : 44
2、(微观)可以反应出各物质的微粒数量比
C + O2 ==== CO2
点燃
(二)、化学方程式表示的意义
3、可以反应出各物质的质量比
1 : 1 : 1
1、质的含义:表示碳和氧气在点燃条件下参加反应,生成二氧化碳。
宏观
2、表示每1个碳原子与1个氧分子恰好完全反应生成1个二氧化碳分子。
3、表示每12份质量的碳与32份质量的氧气恰好完全反应生成44份质量的二氧化碳。
即各物质的 相对分子质量(和)之比
注意:是判断反应物是否完全反应的依据
相对原子质量:C - 12 O - 16
微观
质量
练一练
1.质的含义:表示磷和氧气在点燃条件下生成五氧化二磷。
3.表示124份质量的磷与160份质量的 氧气反应生成284份质量的五氧化二磷,质量比为124∶160∶284
4P + 5O2 2P2O5
点燃
4×31 ∶ 5×32 ∶ 2×142
124 ∶ 160 ∶ 284
4 ∶ 5 ∶ 2
微粒个数比:
各物质质量比:
2.表示每4个磷原子与5个氧分子恰好完全反应生成2个五氧化二磷分子。
相对原子质量:P - 31 O - 16
(三)、化学方程式的读法
(以C + O2 ==== CO2为例)
(1)宏观:碳和氧气在点燃的条件下反应生成二氧化碳;
(2)微观:每1个碳原子和一个氧分子反应,生成一个二氧化碳分子。
(3)质量:每12份质量的碳和32份质量的氧气完全反应,生成44份质量的二氧化碳.
点燃
(一)化学方程式的定义:用化学式表示化学反应的式子。
(二)化学方程式提供的信息(意义 读法)
2、表明各物质之间的微粒数量比
3、表明各物质之间的质量比
化学方程式
1、表明了反应物、生成物、反应的条件
宏观
质量
4P + 5O2 2P2O5
点燃
微观
练一练
1、质的含义:表示过氧化氢在二氧化锰做催化剂的条件下分解生成水和氧气。
3、表示每68份质量的过氧化氢完全分解生成36份质量的水和32份质量的氧气
68 ∶ 36∶ 32
2 ∶ 2 ∶ 1
物质微粒个数比:
各物质质量比:
2H2O2 2H2O + O2
MnO2
2、物质的微粒意义:表示每2个过氧化氢分子完全分解生成2个水分子和1个氧分子。
相对原子质量:H - 1 O - 16
拓展练习
下列叙述符合质量守恒的是: ( )
A、2克氢气和18克氧气反应,生成20克水
B、18克氢气和2克氧气反应,生成20克水
C、4克氢气和36克氧气反应,生成40克水
D、4克氢气和36克氧气反应,生成36克水
4 : 32 : 36
2 ∶ 1 ∶ 2
物质微粒个数比:
各物质质量比:
2H2 + O2 2H2O
点燃
D
相对原子质量:H - 1 O - 16
讨论:书97页
质量守恒定律
狄仁杰的迷惑
1.为什么蜡烛燃烧后质量会变小了呢?
2.为什么铁刀放置一段时间后质量会增加呢?
化学反应前后:
反应物的总质量
生成物的总质量
实验1:白磷燃烧 前后 质量的测定
看书:P93页注意
思考和分析:
1、反应物、生成物的状态及变化;
2、实验中观察到的总质量变化情况。
序号 实验现象
实验1 ① 红磷燃烧,产生大量白烟;气球先胀大,后变小,最后压扁。
② 反应后,天平平衡。
② 气球的作用
P + O2 P2O5
点燃
③ 细沙的作用
—— 防止胶塞被冲开
思考:
① 气球的变化及原因
—— 防止锥形瓶受热不均而炸裂
锥形瓶
细砂
橡皮塞
玻璃管、气球
(空气)
氧气
氮气
白磷
锥形瓶
细砂
橡皮塞
玻璃管、气球
五氧化二磷
(剩余气体)
氮气
稀有气体等
稀有气体等
白磷
五氧化二磷
氧气
对比反应前后,你发现了什么?
反应前
反应后
白磷质量+氧气质量=五氧化二磷质量
实验2:铁和硫酸铜溶液反前后质量的测定
反应表达式:
铁 + 硫酸铜 → 铜 + 硫酸亚铁
Fe + CuSO4 → Cu + FeSO4
反应前的总质量m1
反应后的总质量m2
序号 实验现象
实验2 ① 铁钉表面有红色物质出现;溶液由蓝色渐渐变成浅绿色。
② 反应后,天平平衡。
溶液为蓝色
Fe + CuSO4 Cu + FeSO4
溶液为浅绿色
参加化学反应的
各物质质量总和
反应后生成的各
物质的质量总和
一、质量守恒定律
1、只有化学变化才遵守质量守恒定律,物理变化不用质量守恒定律解释!
2、守恒的是“总质量”,即“参加反应的各反应物的总质量”和“生成物的总质量”。如沉淀、气体等都应考虑进去。
3、“参加”,意味着没有参加反应(剩余)的物质的质量不能算在内。
注意:
想一想
你预计这个反应前后的称量结果是否会有变化?
实验3:碳酸钠与稀盐酸反应前后质量的测定
碳酸钠
粉末
盐酸
镁 + 氧气 → 氧化镁
Mg O2 MgO
点燃
镁 + 氧气 → 氧化镁
Mg O2 MgO
点燃
实验4:镁条燃烧前后质量的测定
想一想
你预计这个反应前后的称量结果是否会有变化?
看书:P95页讨论1
铅屑
成功
(1777年
利用天平实验)
(1673年)
失败
罗蒙诺索夫
成功
(1756年)
想一想
为什么?
汞 + 氧气 氧化汞
加热
质量守恒定律的发展史
查阅资料:
1.蜡烛燃烧后生成二氧化碳和水
2.铁放置在空气中一段时间后,它会与空气中
的氧气、水反应,生成铁锈
解释狄仁杰的迷惑
1.为什么蜡烛燃烧后质量会变小了?
2.为什么铁刀放置一段时间后质量会增加呢?
蜡烛燃烧生成的水和二氧化碳逸散到空气去了,剩余的固体的质量当然比原来的质量小。
参加化学反应的
各物质质量总和
反应后生成的各
物质的质量总和
一、质量守恒定律
1、适用于一切化学变化,物理变化不用质量守恒定律解释!
2、守恒的是“总质量”。如有沉淀、气体生成都应考虑进去。设计有气体参加或生成实验时,装置必须密闭
3、“参加”,意味着没有参加反应(剩余)的物质的质量不能算在内。
注意:
P + O2 P2O5
点燃
Fe + CuSO4 → Cu + FeSO4
盐酸 + 碳酸钠 → 氯化钠 + 水 +二氧化碳
HCl Na2CO3 NaCl H2O CO2
Mg + O2 MgO
点燃
破裂
重新组合
H2O
为什么物质在发生化学反应前后,各物质的质量总和相等呢?
原子的种类、数目、质量没有变化
宏观
原子数目不变
原子质量不变
原子种类不变
微观
物质总质量守恒
2、质量守恒的原因
元素的质量不变
元素的种类不变
注意:在化学反应中,分子的种类一定改变;而分子的数目可能发生变化。
参加化学反应的
各物质质量总和
反应后生成的各
物质的质量总和
适用于一切化学变化
课题1 质量守恒定律
内容
守恒原因
原子数目不增减
原子质量不变化
原子种类不改变
元素的质量不变
元素的种类不变
解释现象
简单的计算
推测物质的组成
应用
1、高锰酸钾受热分解后,剩余固体的质量比原反应的质量小。
答:根据质量守恒定律得:参加反应的高锰酸钾的质量等于反应后生成的锰酸钾、二氧化锰和氧气的质量之和,由于氧气逸散到空气去了,剩余的固体的质量当然比原来高锰酸钾的质量小。
KMnO4 K2MnO4 + MnO2 + O2
2、下列现象可用质量守恒定律解释的是 ( )
A. 烧烤摊上的木炭在空气中燃烧后化为灰烬,
灰烬的质量比木炭的质量减小了
B. 10 g蔗糖溶于90 g水中,总质量为100 g
C. 氯酸钾受热分解后,剩余固体的质量比反应物的
质量减少了
D. 5g水受热变成了5g水蒸汽
A C
5. 密闭容器内有A、B、C、D、四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
物 质 A B C D
反应前质量(g) 19 8 32 2
反应后质量(g) m 18 0 8
(1)、m=
(2)、该反应属于哪种基本类型?
35
分解反应
4、在反应A+B=C+D中,已知11g A与一定量B恰好完全反应,生成12g C和8gD,则在此反应参加反应的B的质量为:
9g
参加反应或生成的物质质量(g)
生成10g
参加反应32g
生成6g
生成16g
7、蜡烛在空气中完全燃烧后,生成二氧化碳和水,则蜡烛中肯定含有 元素,可能含有 元素
C 、H
O
蜡烛 + O2 CO2 + H2O
点燃
6、碳酸受热分解后生成二氧化碳和水,则碳酸中含有 元素,
C 、H、O
碳酸 CO2 + H2O
加热
8. 根据反应3NO2 + H2O = 2HNO3 + X,推断X的化学式为 ( )
A、N2 B、NO
C、N2O3 D、N2O5
B
参加化学反应的
各物质质量总和
反应后生成的各
物质的质量总和
适用于一切化学变化
课题1 质量守恒定律
1、内容
2、守恒 原因
元素的质量不变
元素的种类不变
解释现象
简单的计算
推测物质的组成
3、应用
原子数目不增减
原子质量不变化
原子种类不改变
一、质量守恒定律的应用
(2)通过对比,你认为下列哪种描述方式最好?好在哪里?
1、在点燃的条件下,碳与氧气反应生成二氧化碳。
2、碳 + 氧气 二氧化碳
点燃
3、C + O2 CO2
点燃
思考:(1)你能用哪些方式来描述碳在空气中燃烧?
(语言表达)
(文字表达式)
(符号表达式)
体现出质量守恒(即:原子种类、个数没有发生变化)
反应物
生成物
“反应条件”
点燃
( 化学方程式)
二 、化学方程式
(一) 定义:用化学式表示化学反应的式子
点燃
C + O2 CO2
如: P + O2 P2O5
点燃
4
5
2
1、标明了反应物、生成物、反应的条件
12 : 32 : 44
2、(微观)可以反应出各物质的微粒数量比
C + O2 ==== CO2
点燃
(二)、化学方程式表示的意义
3、可以反应出各物质的质量比
1 : 1 : 1
1、质的含义:表示碳和氧气在点燃条件下参加反应,生成二氧化碳。
宏观
2、表示每1个碳原子与1个氧分子恰好完全反应生成1个二氧化碳分子。
3、表示每12份质量的碳与32份质量的氧气恰好完全反应生成44份质量的二氧化碳。
即各物质的 相对分子质量(和)之比
注意:是判断反应物是否完全反应的依据
相对原子质量:C - 12 O - 16
微观
质量
练一练
1.质的含义:表示磷和氧气在点燃条件下生成五氧化二磷。
3.表示124份质量的磷与160份质量的 氧气反应生成284份质量的五氧化二磷,质量比为124∶160∶284
4P + 5O2 2P2O5
点燃
4×31 ∶ 5×32 ∶ 2×142
124 ∶ 160 ∶ 284
4 ∶ 5 ∶ 2
微粒个数比:
各物质质量比:
2.表示每4个磷原子与5个氧分子恰好完全反应生成2个五氧化二磷分子。
相对原子质量:P - 31 O - 16
(三)、化学方程式的读法
(以C + O2 ==== CO2为例)
(1)宏观:碳和氧气在点燃的条件下反应生成二氧化碳;
(2)微观:每1个碳原子和一个氧分子反应,生成一个二氧化碳分子。
(3)质量:每12份质量的碳和32份质量的氧气完全反应,生成44份质量的二氧化碳.
点燃
(一)化学方程式的定义:用化学式表示化学反应的式子。
(二)化学方程式提供的信息(意义 读法)
2、表明各物质之间的微粒数量比
3、表明各物质之间的质量比
化学方程式
1、表明了反应物、生成物、反应的条件
宏观
质量
4P + 5O2 2P2O5
点燃
微观
练一练
1、质的含义:表示过氧化氢在二氧化锰做催化剂的条件下分解生成水和氧气。
3、表示每68份质量的过氧化氢完全分解生成36份质量的水和32份质量的氧气
68 ∶ 36∶ 32
2 ∶ 2 ∶ 1
物质微粒个数比:
各物质质量比:
2H2O2 2H2O + O2
MnO2
2、物质的微粒意义:表示每2个过氧化氢分子完全分解生成2个水分子和1个氧分子。
相对原子质量:H - 1 O - 16
拓展练习
下列叙述符合质量守恒的是: ( )
A、2克氢气和18克氧气反应,生成20克水
B、18克氢气和2克氧气反应,生成20克水
C、4克氢气和36克氧气反应,生成40克水
D、4克氢气和36克氧气反应,生成36克水
4 : 32 : 36
2 ∶ 1 ∶ 2
物质微粒个数比:
各物质质量比:
2H2 + O2 2H2O
点燃
D
相对原子质量:H - 1 O - 16
讨论:书97页
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
