《硫酸的性质》市观摩课PPT课件
图片预览







文档简介
(共29张PPT)
硫 酸 的 性 质
新 闻 回 放
2008年7月14日14:45分,上三高速上虞境内,一辆橘红色的大货车与一辆满载浓硫酸的红色槽车发生追尾相撞。铝制槽车尾部阀门被撞掉,黏稠的浓硫酸喷涌而出,在路面上四处流淌,地面焦黑一片,当硫酸流入路旁沟渠,沟渠中的水顿时泛起水泡,产生大量白雾。一股呛鼻的怪味在空气中渐渐弥散开去。路过司机见此状况,束手无策,不知如何应对才好。
硫酸标签
硫 酸
500毫升
相对分子质量98
溶质质量分数98%
性状:
无色透明粘稠油状液体,能与水或乙醇任意比混溶,
同时放出大量热,暴露在空气中迅速吸水;
密度(20℃)为1.84克/毫升;密封保存
探究一:浓硫酸的物理性质
(实验与思考):
实验1 用手分别将盛浓硫酸和稀硫
酸的试剂瓶提起,比较两者的质量。
实验2 将两个试剂瓶轻轻摇动,感受液体流动的情况。
实验3 分别打开它们的盖子,观察瓶口的现象。
无色油状液体,密度比水大,难挥发
一、硫酸的物理性质
颜色: 状态:
沸点: 密度(与水相比):
在水中的溶解性:
无色
油状液体
高,难挥发
比水大
以任意比与水互溶
如何稀释浓硫酸
质量分数为98%的浓硫酸,密度为1.84g/cm3,物质的量浓度为18.4mol/L。
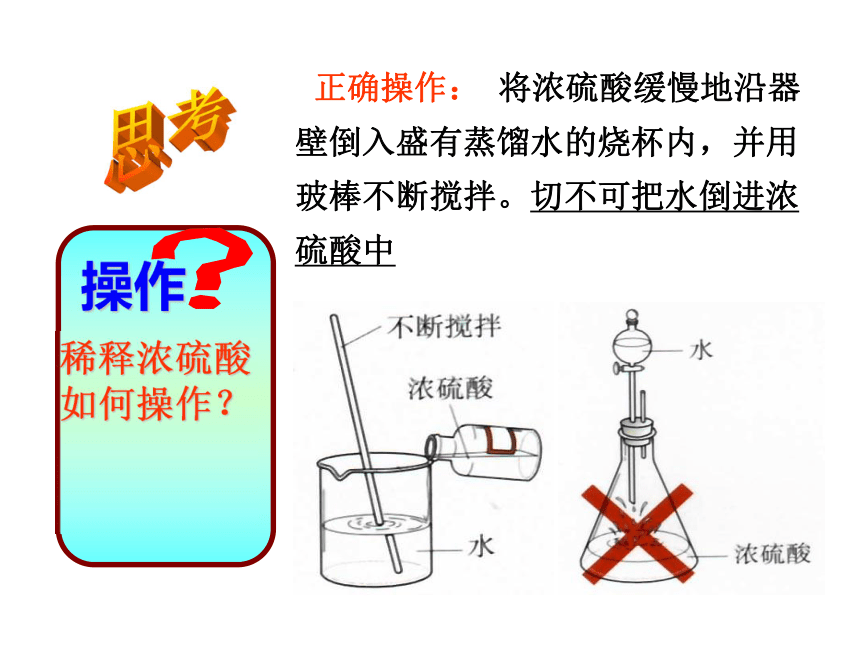
正确操作: 将浓硫酸缓慢地沿器壁倒入盛有蒸馏水的烧杯内,并用玻棒不断搅拌。切不可把水倒进浓硫酸中
操作
稀释浓硫酸如何操作?
稀硫酸具有酸的通性
二、稀硫酸的化学性质
H2SO4=2H++SO42-
(1)可以使紫色石蕊试液变红
(2)与活泼金属反应:
Fe + 2H+ = Fe2+ + H2
(3)与金属氧化物:
CuO + 2H+==Cu2+ + H2O
(4)与碱反应:
Cu(OH)2+2H+==Cu2++2H2O
(5)与某些盐反应:CO32-+2H+=H2O+CO2
硫酸是强酸,在水中
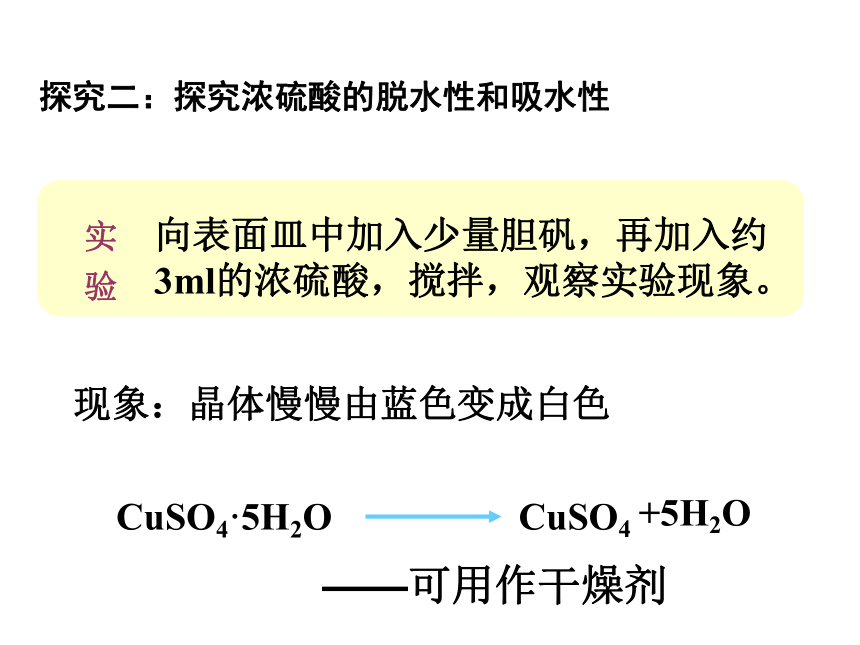
向表面皿中加入少量胆矾,再加入约3ml的浓硫酸,搅拌,观察实验现象。
实 验
CuSO4·5H2O
CuSO4
浓硫酸
(1)、吸水性
——可用作干燥剂
现象:晶体慢慢由蓝色变成白色
探究二:探究浓硫酸的脱水性和吸水性
+5H2O
实 验
黑面包的制取
在小烧杯中放入约10g 蔗糖 ,加几滴水调成 糊状再加入10ml浓硫酸,用玻璃棒搅拌,观察物质的颜色、体积变化并闻气味。
浓硫酸的脱水性
现 象:
蔗糖由白变黑
蔗糖体积显著膨胀,呈疏松海绵状
放出大量的热
产生大量刺激性气体
黑面包的制取
C12H22O11
浓硫酸
12C + 11H2O
浓硫酸的吸水性是指浓硫酸具有吸收原有水分子的性能。它不仅能吸收空气中、物质中的水分,还能夺取结晶水合物中的结晶水。
浓硫酸的脱水性是指浓硫酸能按2:1的比例夺取许多有机化合物分子中的氢原子和氧原子的性质,常见的如炭化现象。
浓硫酸具有吸水性和脱水性
有水为吸 无水则脱
查阅资料得知反应方程式,
并判断氧化剂、还原剂 :
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
被氧化,失4e-
被还原,得4e-
C —— 还原剂 H2SO4(浓)—— 氧化剂
探究三:浓硫酸和金属的反应(强氧化性)
(观察与思考)
Cu与浓硫酸的反应
[实验]将一小块铜片放入试管中,然后加入2mL浓硫酸,用如图所示的实验装置进行实验,观察实验现象.
1、实验现象
2、通过现象判断可能生成物
生成的气体使品红褪色
溶液显蓝色
Cu + 2H2SO4(浓)
=====
CuSO4+ SO2↑ + H2O
思考:比较稀、浓H2SO4的氧化性
稀H2SO4 浓H2SO4
表现氧化性的元素
还原产物
氧化能力
+1
H
H2
SO2等
较弱
强
+6
S
结论:浓硫酸具有独特的性质,浓硫酸中存在的主要的是硫酸分子
浓硫酸与金属反应的规律:
1、不产生H2浓硫酸一般被还原为SO2
2、加热时
与绝大多数金属反应
3、常温下
加热后:会剧烈反应
表面生成
Al、Fe与浓硫酸接触
发生钝化
致密的氧化物薄膜
应用?
浓硫酸的特性小结:
1、吸水性
2、脱水性
3、强氧化性
强烈的腐蚀性
灼伤皮肤
正确处理
规范使用,妥善保存
用途:可用作干燥剂,干燥O2 、Cl2 CO2 、SO2、HCl 、H2等气体
后续报道
接到报警后,上虞市110指挥中心立即派遣出上虞市消防大队赶赴现场。消防大队官兵穿着防护服赶到现场后,立即展开工作。他们首先阻止了浓硫酸流向附近水域,接着向路面以及水渠喷洒石灰和液碱,中和了泄露的硫酸,同时消防大队三支高压水枪组成一面水幕,有效防止了呛鼻的SO2气体的扩散。到15时许,上三高速交通已恢复正常。
三、硫酸的用途
讨 论
如何鉴别失去标签的稀硫酸和浓硫酸?请同学们提出尽可能多的方案
1、硫酸在下列用途或反应中各表现的性质是:
A、强酸性 B、难挥发性 C、吸水性
D、脱水性 E、强氧化性
(1)干燥H2、SO2等气体________;
(2)用铝槽车装运浓硫酸________;
(3)清洗镀件表面氧化物________;
(4)浓硫酸使湿润石蕊试纸变红,后来又变黑________
C
A
AD
E
及时巩固
2、用废铜屑与硫酸反应制CuSO4,以下两种方法哪个好?为什么? (1)Cu+2H2SO4(浓) = CuSO4+2H2O+SO2↑ (2)2Cu+O2 = 2CuO CuO+H2SO4=CuSO4+H2O
3、向50mL18mol/L的硫酸中加入足量的铜片并加热, 被还原的硫酸的物质的量( ) A、等于0.9mol B、大于0.45mol,小于0.9mol C、等于0.45mol
D、小于0.45mol
D
4、 一块铁片放入浓硫酸中充分加热,刚开始看现象是________________ _______ ; ,产生的气体是________; ,反应一段时间产生的气体是否一样________; ,若不同是________气体;
溶液变黄,有刺激性气味气体产生
二氧化硫
不一样
氢气
5、下列物质长久露置在空气中质量会变小的有________,浓度会变小的有____________
A、浓硫酸,B、浓盐酸 C、浓硝酸 D、浓氨水
BCD
ABCD
C12H22O11
浓硫酸
12C + 11H2O
蔗糖
黑面包体积为什么会变大?
气体是怎么产生的?产生的是什么气体呢?
黑面包实验中生成的黑色物质是什么?
实验中滴几滴水作用是什么?
思考:
请你设计实验方案证明木炭与浓硫酸反应的产物?
提供以下试剂与装置(装置可多次使用):
澄清石灰水
饱和NaHCO3
无水硫酸铜
品红
KMnO4溶液
无水硫酸铜
品红
品红
KMnO4
石灰水
硫 酸 的 性 质
新 闻 回 放
2008年7月14日14:45分,上三高速上虞境内,一辆橘红色的大货车与一辆满载浓硫酸的红色槽车发生追尾相撞。铝制槽车尾部阀门被撞掉,黏稠的浓硫酸喷涌而出,在路面上四处流淌,地面焦黑一片,当硫酸流入路旁沟渠,沟渠中的水顿时泛起水泡,产生大量白雾。一股呛鼻的怪味在空气中渐渐弥散开去。路过司机见此状况,束手无策,不知如何应对才好。
硫酸标签
硫 酸
500毫升
相对分子质量98
溶质质量分数98%
性状:
无色透明粘稠油状液体,能与水或乙醇任意比混溶,
同时放出大量热,暴露在空气中迅速吸水;
密度(20℃)为1.84克/毫升;密封保存
探究一:浓硫酸的物理性质
(实验与思考):
实验1 用手分别将盛浓硫酸和稀硫
酸的试剂瓶提起,比较两者的质量。
实验2 将两个试剂瓶轻轻摇动,感受液体流动的情况。
实验3 分别打开它们的盖子,观察瓶口的现象。
无色油状液体,密度比水大,难挥发
一、硫酸的物理性质
颜色: 状态:
沸点: 密度(与水相比):
在水中的溶解性:
无色
油状液体
高,难挥发
比水大
以任意比与水互溶
如何稀释浓硫酸
质量分数为98%的浓硫酸,密度为1.84g/cm3,物质的量浓度为18.4mol/L。
正确操作: 将浓硫酸缓慢地沿器壁倒入盛有蒸馏水的烧杯内,并用玻棒不断搅拌。切不可把水倒进浓硫酸中
操作
稀释浓硫酸如何操作?
稀硫酸具有酸的通性
二、稀硫酸的化学性质
H2SO4=2H++SO42-
(1)可以使紫色石蕊试液变红
(2)与活泼金属反应:
Fe + 2H+ = Fe2+ + H2
(3)与金属氧化物:
CuO + 2H+==Cu2+ + H2O
(4)与碱反应:
Cu(OH)2+2H+==Cu2++2H2O
(5)与某些盐反应:CO32-+2H+=H2O+CO2
硫酸是强酸,在水中
向表面皿中加入少量胆矾,再加入约3ml的浓硫酸,搅拌,观察实验现象。
实 验
CuSO4·5H2O
CuSO4
浓硫酸
(1)、吸水性
——可用作干燥剂
现象:晶体慢慢由蓝色变成白色
探究二:探究浓硫酸的脱水性和吸水性
+5H2O
实 验
黑面包的制取
在小烧杯中放入约10g 蔗糖 ,加几滴水调成 糊状再加入10ml浓硫酸,用玻璃棒搅拌,观察物质的颜色、体积变化并闻气味。
浓硫酸的脱水性
现 象:
蔗糖由白变黑
蔗糖体积显著膨胀,呈疏松海绵状
放出大量的热
产生大量刺激性气体
黑面包的制取
C12H22O11
浓硫酸
12C + 11H2O
浓硫酸的吸水性是指浓硫酸具有吸收原有水分子的性能。它不仅能吸收空气中、物质中的水分,还能夺取结晶水合物中的结晶水。
浓硫酸的脱水性是指浓硫酸能按2:1的比例夺取许多有机化合物分子中的氢原子和氧原子的性质,常见的如炭化现象。
浓硫酸具有吸水性和脱水性
有水为吸 无水则脱
查阅资料得知反应方程式,
并判断氧化剂、还原剂 :
C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O
被氧化,失4e-
被还原,得4e-
C —— 还原剂 H2SO4(浓)—— 氧化剂
探究三:浓硫酸和金属的反应(强氧化性)
(观察与思考)
Cu与浓硫酸的反应
[实验]将一小块铜片放入试管中,然后加入2mL浓硫酸,用如图所示的实验装置进行实验,观察实验现象.
1、实验现象
2、通过现象判断可能生成物
生成的气体使品红褪色
溶液显蓝色
Cu + 2H2SO4(浓)
=====
CuSO4+ SO2↑ + H2O
思考:比较稀、浓H2SO4的氧化性
稀H2SO4 浓H2SO4
表现氧化性的元素
还原产物
氧化能力
+1
H
H2
SO2等
较弱
强
+6
S
结论:浓硫酸具有独特的性质,浓硫酸中存在的主要的是硫酸分子
浓硫酸与金属反应的规律:
1、不产生H2浓硫酸一般被还原为SO2
2、加热时
与绝大多数金属反应
3、常温下
加热后:会剧烈反应
表面生成
Al、Fe与浓硫酸接触
发生钝化
致密的氧化物薄膜
应用?
浓硫酸的特性小结:
1、吸水性
2、脱水性
3、强氧化性
强烈的腐蚀性
灼伤皮肤
正确处理
规范使用,妥善保存
用途:可用作干燥剂,干燥O2 、Cl2 CO2 、SO2、HCl 、H2等气体
后续报道
接到报警后,上虞市110指挥中心立即派遣出上虞市消防大队赶赴现场。消防大队官兵穿着防护服赶到现场后,立即展开工作。他们首先阻止了浓硫酸流向附近水域,接着向路面以及水渠喷洒石灰和液碱,中和了泄露的硫酸,同时消防大队三支高压水枪组成一面水幕,有效防止了呛鼻的SO2气体的扩散。到15时许,上三高速交通已恢复正常。
三、硫酸的用途
讨 论
如何鉴别失去标签的稀硫酸和浓硫酸?请同学们提出尽可能多的方案
1、硫酸在下列用途或反应中各表现的性质是:
A、强酸性 B、难挥发性 C、吸水性
D、脱水性 E、强氧化性
(1)干燥H2、SO2等气体________;
(2)用铝槽车装运浓硫酸________;
(3)清洗镀件表面氧化物________;
(4)浓硫酸使湿润石蕊试纸变红,后来又变黑________
C
A
AD
E
及时巩固
2、用废铜屑与硫酸反应制CuSO4,以下两种方法哪个好?为什么? (1)Cu+2H2SO4(浓) = CuSO4+2H2O+SO2↑ (2)2Cu+O2 = 2CuO CuO+H2SO4=CuSO4+H2O
3、向50mL18mol/L的硫酸中加入足量的铜片并加热, 被还原的硫酸的物质的量( ) A、等于0.9mol B、大于0.45mol,小于0.9mol C、等于0.45mol
D、小于0.45mol
D
4、 一块铁片放入浓硫酸中充分加热,刚开始看现象是________________ _______ ; ,产生的气体是________; ,反应一段时间产生的气体是否一样________; ,若不同是________气体;
溶液变黄,有刺激性气味气体产生
二氧化硫
不一样
氢气
5、下列物质长久露置在空气中质量会变小的有________,浓度会变小的有____________
A、浓硫酸,B、浓盐酸 C、浓硝酸 D、浓氨水
BCD
ABCD
C12H22O11
浓硫酸
12C + 11H2O
蔗糖
黑面包体积为什么会变大?
气体是怎么产生的?产生的是什么气体呢?
黑面包实验中生成的黑色物质是什么?
实验中滴几滴水作用是什么?
思考:
请你设计实验方案证明木炭与浓硫酸反应的产物?
提供以下试剂与装置(装置可多次使用):
澄清石灰水
饱和NaHCO3
无水硫酸铜
品红
KMnO4溶液
无水硫酸铜
品红
品红
KMnO4
石灰水
