第一章第二节(物质的量)
图片预览




文档简介
(共16张PPT)
物质的量(n)
一箱啤酒
一打铅笔
一双筷子
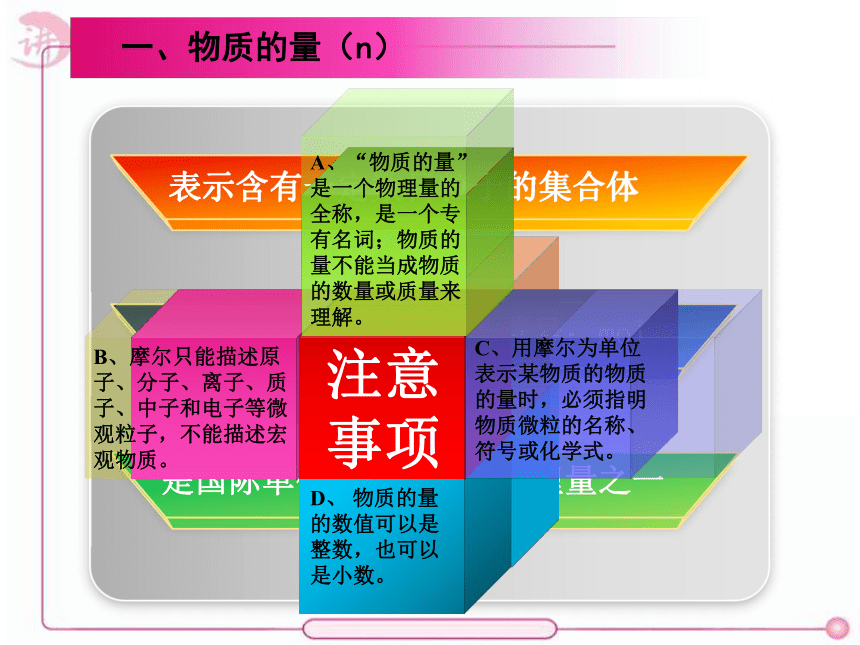
一、物质的量(n)
表示含有一定数目粒子的集合体
单位是摩尔、简称摩,符号:mol
是国际单位制七个基本物理量之一
A、“物质的量”是一个物理量的全称,是一个专有名词;物质的量不能当成物质的数量或质量来理解。
B、摩尔只能描述原子、分子、离子、质子、中子和电子等微观粒子,不能描述宏观物质。
C、用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。
D、 物质的量的数值可以是整数,也可以是小数。
注意事项
一、物质的量(n)
1 摩尔的标准:1 mol粒子集体所含的粒子数= 0.012 kg12C中所含的碳原子数
≈ 6.02×1023
二、阿伏加德罗常数
二、阿伏伽德罗常数
定义:用12g12C所含的碳原子数叫
阿伏加德罗常数,符号为NA.
12g C :
0.012kg
1.993×10-26 kg/个
= 6.02×1023个
阿伏加德罗常数的近似值是:
6.02×1023mol-1
二、阿伏伽德罗常数
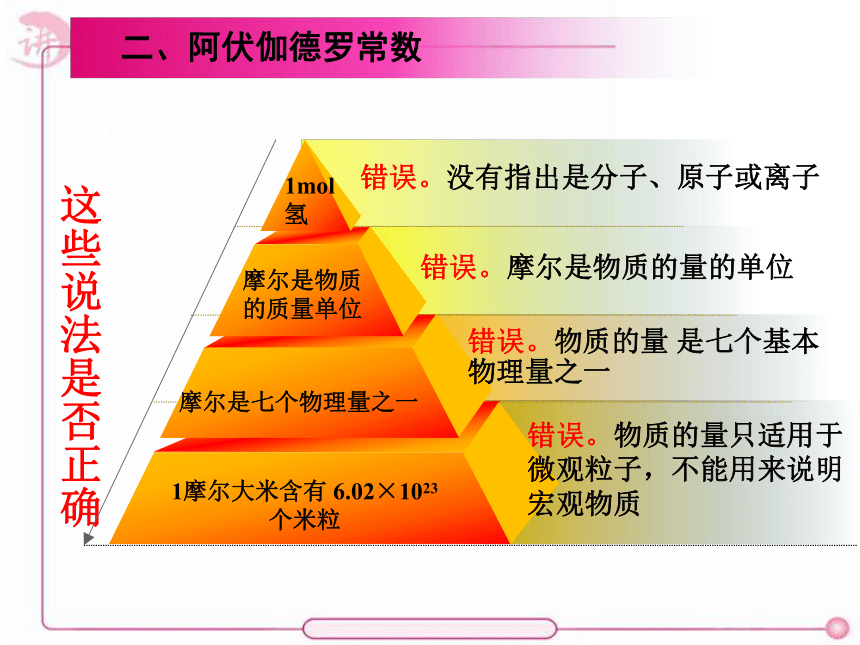
这些说法是否正确
1摩尔大米含有 6.02×1023个米粒
摩尔是七个物理量之一
摩尔是物质的质量单位
1mol氢
错误。没有指出是分子、原子或离子
错误。摩尔是物质的量的单位
错误。物质的量 是七个基本
物理量之一
错误。物质的量只适用于
微观粒子,不能用来说明
宏观物质
二、阿伏伽德罗常数
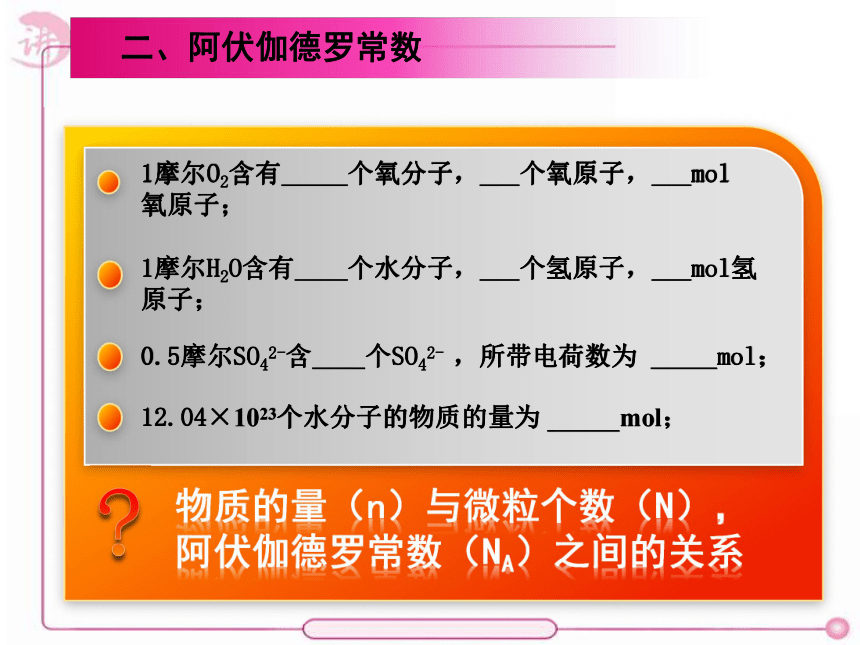
1摩尔O2含有 个氧分子, 个氧原子, mol
氧原子;
1摩尔H2O含有 个水分子, 个氢原子, mol氢原子;
0.5摩尔SO42-含 个SO42- ,所带电荷数为 mol;
12.04×1023个水分子的物质的量为 mol;
三、物质的量、阿伏加德罗常数与粒子数间的关系
三、物质的量、阿伏加德罗常数与粒子数间的关系
物质的量是表示微粒的集体,可以用分数或小数表示。
物质的量(n)=
微粒数目(N)
阿伏加德罗常数(NA)
三、物质的量、阿伏加德罗常数与粒子数间的关系
1摩尔的任何物质所含的微粒个数都是相等的,那它们的质量也相等吗?为什么?
思考
四、摩尔质量
四、摩尔质量
单位物质的量
的物质所具有
的质量
M
g/mol
符号
常用单位
定义
1摩尔任何粒子或物质的质量以克为单位时其数值=
该粒子的相对原子质量或者相对分子质量
四、物质的量
9.8g的H2SO4的物质的量为 mol
10.6g的NaCO3的物质的量为 mol
2.0mol的水的质量为 g
0.25mol的CaCO3的质量为 g
五、物质的量、物质的质量与摩尔质量的关系
五、物质的量、物质的质量与摩尔质量的关系
= 物质的量(n)=
微粒数目(N)
阿伏加德罗
常数(NA)
物质的质量(m)
摩尔质量(M)
微观粒子
宏观物质
五、物质的量、物质的质量与摩尔质量的关系
2H2 + O2 = 2H2O
△
微粒个数
物质的量
2个
1个
2个
2mol
1mol
2mol
2NA
NA
2NA
微粒集体
结论
化学反应方程式中,系数之比即反应中各物质的物质的量之比
五、物质的量、物质的质量与摩尔质量的关系
例1、已知1mL水的质量为1g,约为25小滴水,试计算1滴水中大约含有多少个水分子?
例2、28.6gNa2CO3 10H2O中所含有的钠离子和碳酸根粒子的物质的量各是多少?所含水分子的数目是多少?
物质的量是国际单位制中的基本物理量之一,用来计算大量微粒的集合体中微粒的多少
摩尔是物质的量的单位,每摩尔物质含有阿伏伽德罗常数个微粒
1摩尔任何物质的质量称为该物质的摩尔质量,以g/mol为单位时,数值上等于该物质的相对分子质量或相对原子质量
m/M=n=N/NA
化学方程式前的系数比等于反应物、生成物物质的量之比
1、0.5 mol H2O中含有_____________个水分子。
2、2 mol H2O中含有_____________个水分子,_________个氢原子,_____________个氧原子。
3、1 mol H2SO4中含有_____________个H2SO4分子,_____________个硫酸根离子。
4、1 mol HCl溶于水,水中存在的溶质粒子是_____________,它们的物质的量各是___________
5、1个水分子中有_____________个电子,1 mol H2O中有_____________个电子
物质的量(n)
一箱啤酒
一打铅笔
一双筷子
一、物质的量(n)
表示含有一定数目粒子的集合体
单位是摩尔、简称摩,符号:mol
是国际单位制七个基本物理量之一
A、“物质的量”是一个物理量的全称,是一个专有名词;物质的量不能当成物质的数量或质量来理解。
B、摩尔只能描述原子、分子、离子、质子、中子和电子等微观粒子,不能描述宏观物质。
C、用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。
D、 物质的量的数值可以是整数,也可以是小数。
注意事项
一、物质的量(n)
1 摩尔的标准:1 mol粒子集体所含的粒子数= 0.012 kg12C中所含的碳原子数
≈ 6.02×1023
二、阿伏加德罗常数
二、阿伏伽德罗常数
定义:用12g12C所含的碳原子数叫
阿伏加德罗常数,符号为NA.
12g C :
0.012kg
1.993×10-26 kg/个
= 6.02×1023个
阿伏加德罗常数的近似值是:
6.02×1023mol-1
二、阿伏伽德罗常数
这些说法是否正确
1摩尔大米含有 6.02×1023个米粒
摩尔是七个物理量之一
摩尔是物质的质量单位
1mol氢
错误。没有指出是分子、原子或离子
错误。摩尔是物质的量的单位
错误。物质的量 是七个基本
物理量之一
错误。物质的量只适用于
微观粒子,不能用来说明
宏观物质
二、阿伏伽德罗常数
1摩尔O2含有 个氧分子, 个氧原子, mol
氧原子;
1摩尔H2O含有 个水分子, 个氢原子, mol氢原子;
0.5摩尔SO42-含 个SO42- ,所带电荷数为 mol;
12.04×1023个水分子的物质的量为 mol;
三、物质的量、阿伏加德罗常数与粒子数间的关系
三、物质的量、阿伏加德罗常数与粒子数间的关系
物质的量是表示微粒的集体,可以用分数或小数表示。
物质的量(n)=
微粒数目(N)
阿伏加德罗常数(NA)
三、物质的量、阿伏加德罗常数与粒子数间的关系
1摩尔的任何物质所含的微粒个数都是相等的,那它们的质量也相等吗?为什么?
思考
四、摩尔质量
四、摩尔质量
单位物质的量
的物质所具有
的质量
M
g/mol
符号
常用单位
定义
1摩尔任何粒子或物质的质量以克为单位时其数值=
该粒子的相对原子质量或者相对分子质量
四、物质的量
9.8g的H2SO4的物质的量为 mol
10.6g的NaCO3的物质的量为 mol
2.0mol的水的质量为 g
0.25mol的CaCO3的质量为 g
五、物质的量、物质的质量与摩尔质量的关系
五、物质的量、物质的质量与摩尔质量的关系
= 物质的量(n)=
微粒数目(N)
阿伏加德罗
常数(NA)
物质的质量(m)
摩尔质量(M)
微观粒子
宏观物质
五、物质的量、物质的质量与摩尔质量的关系
2H2 + O2 = 2H2O
△
微粒个数
物质的量
2个
1个
2个
2mol
1mol
2mol
2NA
NA
2NA
微粒集体
结论
化学反应方程式中,系数之比即反应中各物质的物质的量之比
五、物质的量、物质的质量与摩尔质量的关系
例1、已知1mL水的质量为1g,约为25小滴水,试计算1滴水中大约含有多少个水分子?
例2、28.6gNa2CO3 10H2O中所含有的钠离子和碳酸根粒子的物质的量各是多少?所含水分子的数目是多少?
物质的量是国际单位制中的基本物理量之一,用来计算大量微粒的集合体中微粒的多少
摩尔是物质的量的单位,每摩尔物质含有阿伏伽德罗常数个微粒
1摩尔任何物质的质量称为该物质的摩尔质量,以g/mol为单位时,数值上等于该物质的相对分子质量或相对原子质量
m/M=n=N/NA
化学方程式前的系数比等于反应物、生成物物质的量之比
1、0.5 mol H2O中含有_____________个水分子。
2、2 mol H2O中含有_____________个水分子,_________个氢原子,_____________个氧原子。
3、1 mol H2SO4中含有_____________个H2SO4分子,_____________个硫酸根离子。
4、1 mol HCl溶于水,水中存在的溶质粒子是_____________,它们的物质的量各是___________
5、1个水分子中有_____________个电子,1 mol H2O中有_____________个电子
