【2021-2022学年】高中化学选修4 新人教版4.4金属的电化学腐蚀与防护 课后培优练(含解析)
文档属性
| 名称 | 【2021-2022学年】高中化学选修4 新人教版4.4金属的电化学腐蚀与防护 课后培优练(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-15 10:24:02 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
选修4第四章第四节金属的电化学腐蚀与防护同步练习
第I卷(选择题)
一、单选题
1.下列事实与电化学无关的是( )
A.暖宝宝(含铁粉、碳、氯化钠等)发热 B.海沙比河沙混凝土更易使钢筋生锈 C.家用铁锅生锈 D.铁罐运输浓硫酸
2.下列说法中不正确的是( )
A.需要加热才能发生的反应不一定是吸热反应
B.轮船底部镶嵌锌块,可以防止船体被腐蚀
C.钢铁腐蚀的负极反应为:
D.常温时,向纯水中加入酸或碱一定会影响水的电离程度
3.炒过菜的铁锅未及时洗净(残液中含),不久便会因被腐蚀而出现红褐色锈斑,腐蚀原理如图所示,下列说法正确的是( )
A.腐蚀过程中,负极是,发生电极反应:
B.失去电子经电解质溶液转移给C
C.正极的电极反应式为
D.C是正极,在C表面上发生还原反应
4.下列叙述与电化学腐蚀有关的是( )
A.切过菜的菜刀不及时清洗易生锈
B.在空气中金属镁、铝都具有较好的抗腐蚀性
C.红热的铁丝与水接触时,表面形成了蓝黑色的物质
D.把铁片投入到氯化铜的溶液中,在铁表面上附着一层红色的铜
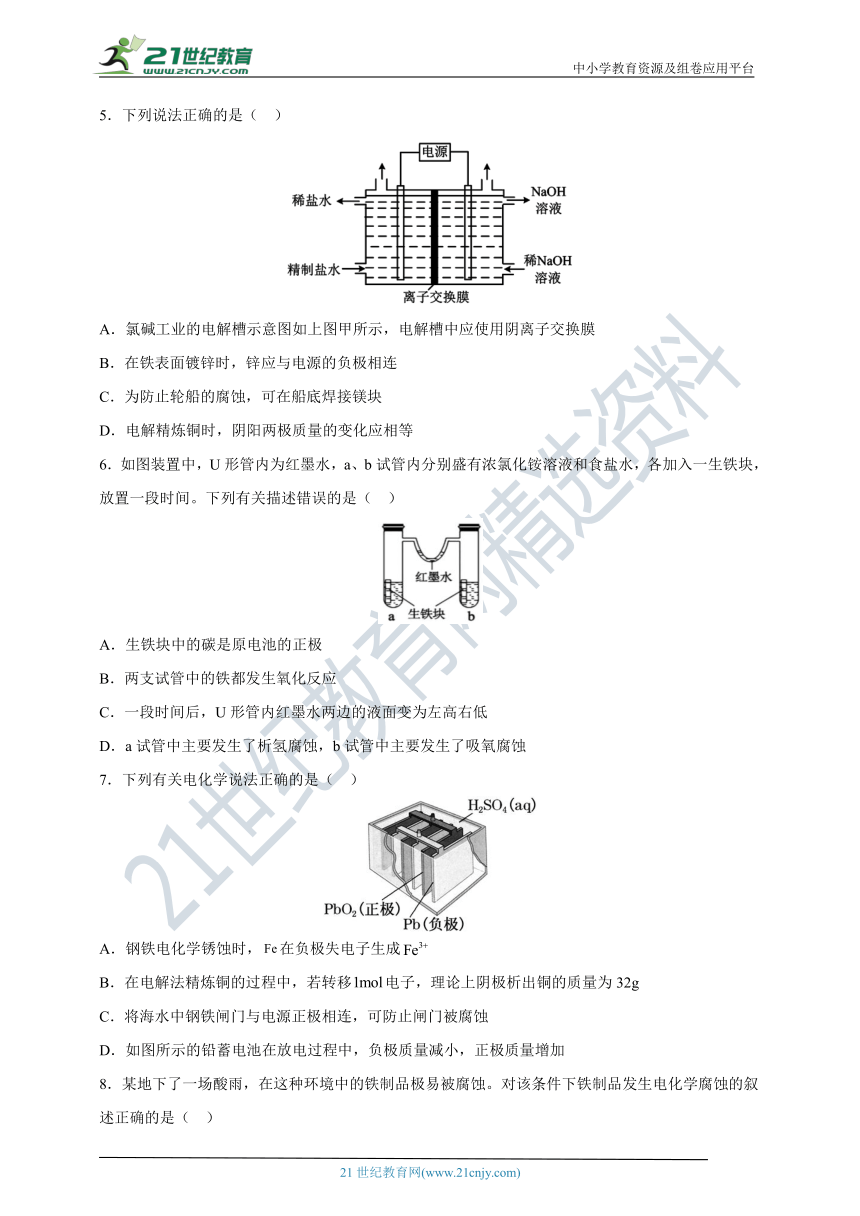
5.下列说法正确的是( )
A.氯碱工业的电解槽示意图如上图甲所示,电解槽中应使用阴离子交换膜
B.在铁表面镀锌时,锌应与电源的负极相连
C.为防止轮船的腐蚀,可在船底焊接镁块
D.电解精炼铜时,阴阳两极质量的变化应相等
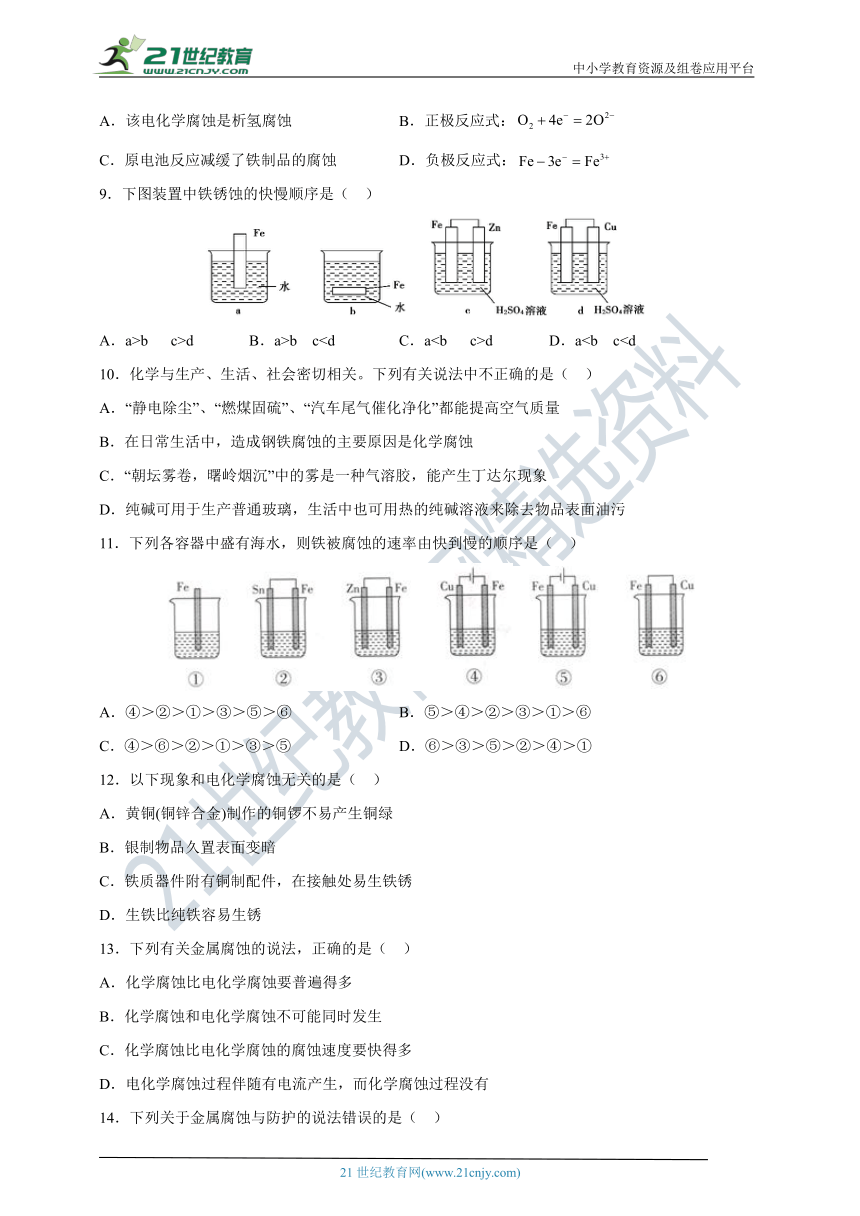
6.如图装置中,U形管内为红墨水,a、b试管内分别盛有浓氯化铵溶液和食盐水,各加入一生铁块,放置一段时间。下列有关描述错误的是( )
A.生铁块中的碳是原电池的正极
B.两支试管中的铁都发生氧化反应
C.一段时间后,U形管内红墨水两边的液面变为左高右低
D.a试管中主要发生了析氢腐蚀,b试管中主要发生了吸氧腐蚀
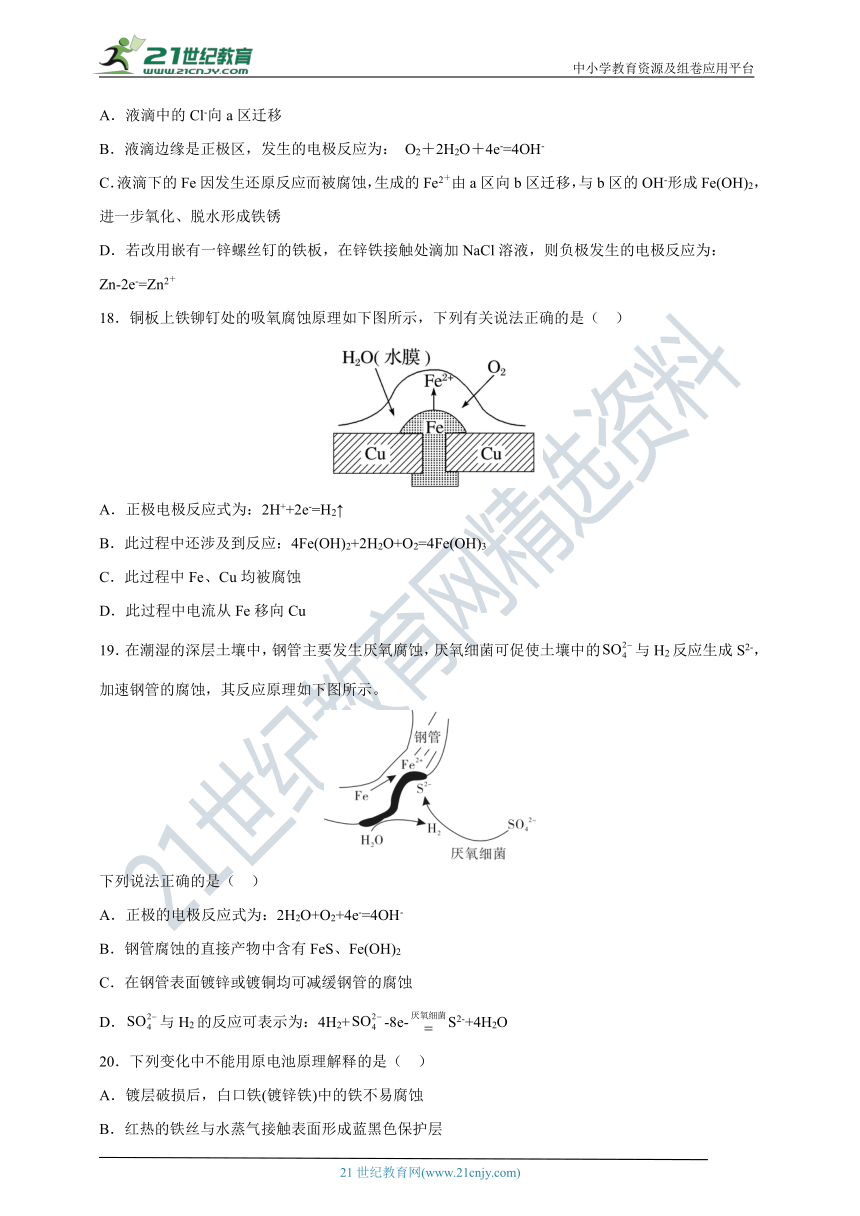
7.下列有关电化学说法正确的是( )
A.钢铁电化学锈蚀时,在负极失电子生成
B.在电解法精炼铜的过程中,若转移电子,理论上阴极析出铜的质量为32g
C.将海水中钢铁闸门与电源正极相连,可防止闸门被腐蚀
D.如图所示的铅蓄电池在放电过程中,负极质量减小,正极质量增加
8.某地下了一场酸雨,在这种环境中的铁制品极易被腐蚀。对该条件下铁制品发生电化学腐蚀的叙述正确的是( )
A.该电化学腐蚀是析氢腐蚀 B.正极反应式:
C.原电池反应减缓了铁制品的腐蚀 D.负极反应式:
9.下图装置中铁锈蚀的快慢顺序是( )
A.a>b c>d B.a>b cd D.a10.化学与生产、生活、社会密切相关。下列有关说法中不正确的是( )
A.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量
B.在日常生活中,造成钢铁腐蚀的主要原因是化学腐蚀
C.“朝坛雾卷,曙岭烟沉”中的雾是一种气溶胶,能产生丁达尔现象
D.纯碱可用于生产普通玻璃,生活中也可用热的纯碱溶液来除去物品表面油污
11.下列各容器中盛有海水,则铁被腐蚀的速率由快到慢的顺序是( )
A.④>②>①>③>⑤>⑥ B.⑤>④>②>③>①>⑥
C.④>⑥>②>①>③>⑤ D.⑥>③>⑤>②>④>①
12.以下现象和电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.银制物品久置表面变暗
C.铁质器件附有铜制配件,在接触处易生铁锈
D.生铁比纯铁容易生锈
13.下列有关金属腐蚀的说法,正确的是( )
A.化学腐蚀比电化学腐蚀要普遍得多
B.化学腐蚀和电化学腐蚀不可能同时发生
C.化学腐蚀比电化学腐蚀的腐蚀速度要快得多
D.电化学腐蚀过程伴随有电流产生,而化学腐蚀过程没有
14.下列关于金属腐蚀与防护的说法错误的是( )
A.图①中的铁钉不易生锈
B.图②中,若将钢闸门与电源的正极相连,可防止钢闸门被腐蚀
C.图②中,若断开电源,钢闸门将发生吸氧腐蚀
D.图③中,若金属M比Fe活泼,可防止输水管腐蚀
15.利用下图装置,可以模拟铁的电化学防护。下列说法正确的是( )
A.若X为铝,开关K置于M处,该电化学防护法称为牺牲阳极的阴极保护法
B.若X为碳棒,为减缓铁的腐蚀,开关K应该置于M处
C.若X为碳棒,K与M连接时,一段时间后溶液的pH减小
D.若X为铝,K与N连接时,X电极产生气泡
16.根据所学习的电化学知识,下列说法正确的是( )
A.酸雨后钢铁易发生析氢腐蚀、铁锅存留盐液时易发生吸氧腐蚀
B.太阳能电池板的主要材料为二氧化硅
C.水库的钢闸门与电源正极连接可实现电化学保护
D.智能手机常用的锂离子电池属于一次电池
17.将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘处少。下列说法不正确的是( )
A.液滴中的Cl-向a区迁移
B.液滴边缘是正极区,发生的电极反应为: O2+2H2O+4e-=4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一锌螺丝钉的铁板,在锌铁接触处滴加NaCl溶液,则负极发生的电极反应为:Zn-2e-=Zn2+
18.铜板上铁铆钉处的吸氧腐蚀原理如下图所示,下列有关说法正确的是( )
A.正极电极反应式为:2H++2e-=H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中Fe、Cu均被腐蚀
D.此过程中电流从Fe移向Cu
19.在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,厌氧细菌可促使土壤中的与H2反应生成S2-,加速钢管的腐蚀,其反应原理如下图所示。
下列说法正确的是( )
A.正极的电极反应式为:2H2O+O2+4e-=4OH-
B.钢管腐蚀的直接产物中含有FeS、Fe(OH)2
C.在钢管表面镀锌或镀铜均可减缓钢管的腐蚀
D.与H2的反应可表示为:4H2+-8e-S2-+4H2O
20.下列变化中不能用原电池原理解释的是( )
A.镀层破损后,白口铁(镀锌铁)中的铁不易腐蚀
B.红热的铁丝与水蒸气接触表面形成蓝黑色保护层
C.暖宝宝中的炭粉、铁粉、食盐、水混合暴露在空气中放热
D.相同条件下,久置在潮湿的空气中,生铁比纯铁更易生锈
第II卷(非选择题)
二、填空题
21.(1)依据反应:设计的原电池如图所示。
①电极X的材料是________;Y溶液可以是________溶液。
②电池放电过程中,盛有饱和琼脂溶胶的盐桥中,向溶液扩散的离子是________(填离子符号)。
(2)钢铁发生电化学腐蚀可分为析氢腐蚀和吸氧腐蚀,可以采用电化学手段进行防护。
①写出钢铁在酸性较强的环境中发生电化学腐蚀的正极反应式:_______________________。
②为了减缓水库铁闸门被腐蚀的速率,可以采用下图所示的方案:
其中连接在铁闸门上的固体材料R可以采用________(填写字母序号)。
a.铜 b.钠 c.锌 d.石墨
(3)电解原理在工业上有着广泛的用途,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
①若X、Y都是惰性电极,a是饱和溶液,则电解的总反应式为________________。
②当电路中流通电子时,整个装置共放出气体________L(标准状况下)。
22.钢铁工业是国家工业的基础。请回答下列钢铁腐蚀、防护过程中的有关问题:
(1)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式是___________________________________。
(2)下列装置可防止铁棒被腐蚀的是______________。
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀,装置如图所示。
①A电极对应的金属是_______(填元素名称),B电极的电极反应是____________________________。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为_______mol。
③镀层破损后,镀铜铁和镀锌铁,_______更易被腐蚀。
23.如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中。请回答:
(1)金属腐蚀主要分为________腐蚀和________腐蚀两种。
(2)铁被腐蚀的速率由快到慢的顺序是________(填序号)。
(3)请你为以下钢铁制品选择适当的防锈方法。
A.健身器材__________________________________________;
B.自行车的链条、齿轮________________________________;
C.海水中的轮船______________________________________。
24.(1)材料是人类生活的物质基础,新型材料的制造则是科技快速发展的重要标志。
①钢铁是制造铁路、桥梁、轮船等的主要材料,钢铁在潮湿的空气中主要发生___________腐蚀(填“吸氧”或“析氢”),腐蚀时Fe作为原电池的___________极。
②目前,很多地方使用的泡沫塑料快餐具的主要成分是聚苯乙烯(简称EPS),聚苯乙烯属于___________(请用相应的字母填空)。
A.无机非金属材料B.金属材料C.有机高分子材料
③工业上生产玻璃、水泥都要用到的原料是___________。
(2)垃圾是放错了位置的资源,必须对垃圾进行分类回收。某住宅小区清理出一些垃圾:A.废纸 B.剩菜剩饭、瓜果皮 C.废旧电池 D.废玻璃瓶 E.废橡胶手套 F.一次性塑料饭盒。请用相应的字母填空:
①其中可投入有标志垃圾箱的是___________。
②其中适宜堆肥处理的垃圾是___________。
③随意丢弃___________,会造成白色污染。
25.电化学知识在生产、科技研究中应用广泛。
(1)可采用电化学防护技术减缓海水中钢铁设施的腐蚀,下图是钢铁桥墩部分防护原理示意图。
①K 与 M 连接时钢铁桥墩的电化学防护方法为______。
②K与N连接时,钢铁桥墩为______极(填"正"、"负"、"阴"或"阳"),电极反应式为__________________________________。
(2)燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示。
电池工作时,A极区 NaOH浓度不变,则离子交换膜为______(填"阳离子交换膜"或"阴离子交换膜");电极 B的电极反应式为____________________;电池工作时参加反应的=______。
参考答案
1.D
解析:
A.暖宝宝中铁粉、碳在氯化钠溶液中构成原电池,铁发生吸氧腐蚀放出热量,与电化学有关,故A不符合题意;
B.海沙中电解质的量大于河沙,钢筋在海沙中构成原电池时,由于电解质溶液浓度大,腐蚀速率快,则海沙比河沙混凝土更易使钢筋生锈与电化学有关,故B不符合题意;
C.家用铁锅生锈是因为铁锅与锅中残留溶液构成原电池,发生吸氧腐蚀,则家用铁锅生锈与电化学有关,故C不符合题意;
D.铁在冷的浓硫酸中发生钝化,则铁罐运输浓硫酸与铁的钝化有关,与电化学有无关,故D符合题意;
故选D。
2.C
解析:
A.需要加热才能发生的反应不一定是吸热反应,如铁和硫反应需要加热,但铁和硫的反应是放热反应,故A正确;
B.轮船底部镶嵌锌块,锌和铁以及海水构成原电池的两极,锌做负极被腐蚀,铁做正极被保护,可以防止船体被腐蚀,故B正确;
C.钢铁腐蚀的负极反应为: Fe-2e-= Fe2+,故C错误;
D.常温时,向纯水中加入酸或碱,增大了H+或OH-浓度,使水电离程度减小,影响了水的电离程度,故D正确;
故选C。
3.D
解析:
该原电池中,Fe易失电子作负极、C作正极,负极上铁失电子生成亚铁离子,正极上氧气得电子发生还原反应,负极反应式为Fe- 2e- = Fe2+,正极反应式为O2 + 2H2O+4e -= 4OH-;
A.腐蚀过程中,负极是,发生电极反应:Fe- 2e- = Fe2+,故A错误;
B.原电池中电子沿外导线从负极流向正极,不能通过电解质溶液,电解质溶液中是离子的定向移动形成闭合回路,故B错误;
C.正极电极反应是溶液中氧气得到电子发生还原反应,电极反应O2 + 2H2O+4e -= 4OH-,故C错误;
D.C是正极,正极电极反应是溶液中氧气得到电子发生还原反应,故D正确;
故选D。
4.A
解析:
A.切过菜的菜刀不及时清洗,在菜刀上就会以NaCl为电解质溶液形成原电池,发生电化学腐蚀,A正确;
B.金属镁、铝都具有较好的抗腐蚀性,是因为它们在空气中容易氧化,在金属表面生成一层致密的氧化物薄膜,阻止继续被氧化,B错误;
C.红热的铁丝与水蒸气接触,生成四氧化三铁,属于化学腐蚀,C错误;
D.铁片投入到氯化铜的溶液中是直接发生化学反应,将铜置换,D错误;
答案选A。
5.C
解析:
A.氯碱工业中阳极氯离子被氧化生成氯气,阴极水电离出的氢离子放电生成氢气,同时产生氢氧根,所以NaOH在阴极生成,即右侧为阴极区,左侧为阳极区,为了防止生成的氯气与NaOH反应,一般采用阳离子交换膜阻止阴极生成的氢氧根进入阳极区与氯气反应,同时可以钠离子进入阴极区,A错误;
B.在铁表面镀锌时,则需要锌离子在铁表面被还原,所以铁为阴极,与电源负极相连,B错误;
C.镁比铁活泼,发生电化学腐蚀时,镁为负极被氧化,铁为正极被保护,C正确;
D.电解精炼铜时,阴极铜离子放电生成铜单质,但阳极除了铜放电外,比通活泼的金属如Fe、Zn等会先于铜放电,且还有阳极泥的生成,所以阴阳两极质量的变化不相等,D错误;
综上所述答案为C。
6.C
解析:
A.生铁中含有铁和碳,铁、碳和电解质溶液构成了原电池,较活泼的金属铁作负极,碳作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,故A正确;
B.生铁中含有铁和碳,铁、碳和电解质溶液构成了原电池,较活泼的金属铁作负极,碳作正极,负极上铁失电子发生氧化反应,故B正确;
C.左试管中是酸性溶液,主要发生了析氢腐蚀,右试管中是中性溶液,主要发生了吸氧腐蚀,所以右试管内气体氧气减小,左试管内气体压强不大,导致U形管内红墨水两边的液面变为左低右高,故C错误;
D.a试管中是酸性溶液,主要发生了析氢腐蚀,b试管中是中性溶液,主要发生了吸氧腐蚀,故D正确;
故选C。
7.B
解析:
A.钢铁电化学腐蚀时,Fe在负极上失电子生成Fe2+,故A错误;
B.精炼铜过程中,阴极上电极反应式为Cu2++2e-=Cu,转移1mol电子,理论上阴极析出铜的质量为32g,故B正确;
C.根据电解原理,活动性金属作阳极,活动性金属先失电子,因此钢铁闸门应于电源的负极相连,可防止闸门被腐蚀,故C错误;
D.负极电极反应式为Pb-2e-+=PbSO4,电极质量增大,正极反应式为PbO2+2e-++4H+=PbSO4+2H2O,正极质量增大,故D错误;
答案为B。
8.A
解析:
A.铁制品中含有铁和碳,酸雨使水膜呈酸性,构成了原电池,会发生析氢腐蚀,故A正确;
B.酸性环境中发生析氢腐蚀,正极反应为氢离子得电子生成氢气:2H++2e-=H2,故B错误;
C.原电池反应会加快铁制品的腐蚀,故C错误;
D.发生电化学腐蚀时金属铁被氧化为Fe2+,负极反应式为︰Fe-2e-=Fe2+,故D错误;
故选A。
9.B
解析:
a与b比较,a中Fe与空气接触,b中Fe不与空气接触,故铁锈蚀的速率a>b;c与d比较,c、d都形成原电池。c中Zn活泼性强于Fe,Zn失去电子作原电池负极:Zn-2e-=Zn2+,溶液中H+在Fe极上得电子:2H++2e-=H2↑(正极),Fe得到保护;d中Fe活泼性强于Cu,失去电子被氧化,故铁锈蚀的速率d>c。综上所述故选B。
10.B
解析:
A.“静电除尘”能减少粉尘排放、“燃煤固硫”可减少二氧化硫的排放、“汽车尾气催化净化”能减少氮的氧化物排放,都能提高空气质量,故A正确;
B.在日常生活中,造成钢铁腐蚀的主要原因是电化学腐蚀,故B错误;
C.雾是一种气溶胶,具有胶体的性质,能产生丁达尔现象,故C正确;
D.生产普通玻璃的原料为石英、石灰石和纯碱,碳酸钠在溶液中水解使溶液呈碱性,热的纯碱溶液可除去物品表面油污,故D正确;
故选B。
11.C
解析:
由题图可知,④中铁作电解池的阳极,被腐蚀的速率最快;②、⑥中铁作原电池的负极,铁被腐蚀,且两电极金属的活泼性相差越大,负极金属越容易被腐蚀,则铁被腐蚀的速率:⑥>②;①中铁发生化学腐蚀;⑤中铁作电解池的阴极,铁被保护,被腐蚀的速率最慢;③中铁作原电池的正极,铁被保护,但被腐蚀的速率大于⑤。综上所述,铁被腐蚀的速率由快到慢的原序为④>⑥>②>①>③>⑤,C项符合题意。
故选C。
12.B
解析:
A.黄铜(铜锌合金)制作的铜锣中,金属锌为负极,金属铜做正极,Cu被保护,不易腐蚀,和电化学腐蚀有关,A项不选;
B.银制物品久置表面变暗,是金属银和空气中的成分发生反应的结果,属于化学腐蚀,与电化学腐蚀无关,B项选;
C.铁质器件附有铜质配件,在接触处形成原电池装置,其中金属铁为负极,易生铁锈,和电化学腐蚀有关,C项不选;
D.生铁中金属铁、碳、潮湿的空气能构成原电池,金属铁为负极,易被腐蚀而生锈,和电化学腐蚀有关,D项不选。
答案选B。
13.D
解析:
化学腐蚀是金属与接触到的干燥气体或非电解质液体等直接发生反应而引起的腐蚀;不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化,这种腐蚀叫做电化学腐蚀。
A. 金属一般都不纯,电化学腐蚀比化学腐蚀要普遍得多,故A错误;
B. 化学腐蚀和电化学腐蚀可能同时发生,故B错误;
C. 电化学腐蚀比化学腐蚀的腐蚀速度要快得多,故C错误;
D. 电化学腐蚀过程伴随有电流产生,而化学腐蚀过程没有,故D正确;
故选D。
14.B
解析:
A.碱石灰能干燥试管中的空气,即铁钉与水不接触,不易生锈,A项正确;
B.将钢闸门与电源的正极相连,则钢闸门作为阳极,失电子发生氧化反应,加速了钢闸门的腐蚀,B项错误;
C.断开电源,图②装置为原电池,海水为弱碱性电解质溶液,钢闸门将发生吸氧腐蚀,C项正确;
D.图③中,若金属M比铁活泼,则金属M作负极,失电子发生氧化反应,可保护输水管不被腐蚀,D项正确。
故选B。
15.A
解析:
若X为碳棒,开关K置于N处,形成电解池,此时金属铁为阴极,铁被保护,开关K置于M处,形成原电池,金属铁是负极,碳棒是正极,正极上是氧气得电子的还原反应;若X是铝棒,将K与M连接,形成原电池,金属铝是负极,铁是正极,则铁不易受腐蚀,将K与N连接,形成电解池,铝棒是阳极,电极本身发生失电子的氧化反应。
A. 若X为铝,开关K置于M处,形成原电池,金属铝是负极,铁是正极,则铁不易受腐蚀,该电化学防护法称为牺牲阳极的阴极保护法,故A正确;
B. 若X为碳棒,开关K应该置于M处,形成原电池,金属铁是负极,碳棒是正极,正极上是氧气得电子的还原反应,加快铁的腐蚀,故B错误;
C. 若X为碳棒,K与M连接时,形成原电池,金属铁是负极,碳棒是正极,正极上是氧气得电子的还原反应,O2+4e-+2H2O=4OH-,一段时间后溶液的pH增大,故C错误;
D. 若X为铝,K与N连接时,形成电解池,此时金属铁为阴极,铁被保护,X电极无气泡产生,发生Al-3e-=Al3+,故D错误;
故选A。
16.A
解析:
A.酸雨后钢铁易发生析氢腐蚀、铁锅存留盐液时易发生吸氧腐蚀,A项正确;
B.太阳能电池板的主要材料为Si,B项错误;
C.水库的钢闸门与电源负极连接可实现电化学保护,为外加电流的阴极保护法,C项错误;
D.智能手机常用的锂离子电池属于二次电池,D项错误;
答案选A。
17.C
解析:
a区、b区的铁板与NaCl溶液形成原电池。因为中心a区含氧量减少,b区附近含氧量较高,故b区发生的电极反应为:O2+2H2O+4e-=4OH-;a区发生的电极反应为:Fe-2e-=Fe2+,即a区是负极,b区是正极。溶液中的阳离子移向正极b区,阴离子移向负极a区。
A.由分析可知,Cl-向a区迁移,A正确;
B.由分析可知,b区是正极,电极反应为: O2+2H2O+4e-=4OH-,B正确;
C.液滴下的Fe发生氧化反应而被腐蚀,C错误;
D.铁板上嵌Zn之后,负极为Zn,发生的电极反应为:Zn-2e-=Zn2+,D正确。
故选C。
18.B
解析:
铆钉处吸氧腐蚀的正极电极反应式为:O2+2H2O+4e-=4OH-,铜作正极不被腐蚀,电子从负极铁通过导线流向正极铜,据此分析解题。
A.正极电极反应式为:O2+2H2O+4e-=4OH-,故A错误;
B.电化学腐蚀过程中生成的Fe(OH)2易被氧化成Fe(OH)3,故B正确;
C.铜为正极,被保护起来了,故C错误;
D.此过程中电子从负极Fe移向正极Cu,电流从Cu移向Fe,故D错误;
故选B。
19.B
解析:
A.由图知,钢铁发生析氢腐蚀,正极反应式为: ,A错误;
B.铁发生析氢腐蚀时,负极反应式是,正极反应式为: ,亚铁离子和氢氧根离子反应生成氢氧化亚铁沉淀,厌氧细菌可促使土壤中的与H2反应生成S2-,亚铁离子和硫离子反应生成FeS,则钢管腐蚀的直接产物中含有、Fe(OH)2,B正确;
C.原电池中,作负极的金属加速被腐蚀,作正极的金属被保护,Fe、Zn和电解质溶液构成原电池时,锌易失电子作负极,Fe作正极,所以Fe被保护,在钢管表面镀锌可以防止腐蚀,但在钢管表面镀铜,铁易失电子作负极,铜作正极,铁腐蚀得更快, C错误;
D. 与H2发生氧化还原反应,反应可表示为:4H2+S2-+4H2O,D错误;
答案选B。
20.B
解析:
A.镀层破损后,白口铁(镀锌铁)中,锌、铁和金属表面的水膜形成原电池,锌比铁活泼,锌为负极,则铁不易腐蚀,能用原电池原理解释,故A与题意不符;
B.红热的铁丝与水蒸气接触生成四氧化三铁和氢气,则表面形成四氧化三铁蓝黑色保护层,与原电池无关,故B符合题意;
C.暖宝宝中的炭粉、铁粉、食盐、水混合暴露在空气中,炭粉、铁粉、食盐水形成原电池,铁粉被氧化放热,能用原电池原理解释,故C与题意不符;
D. 生铁是铁碳合金,在潮湿的环境中容易形成原电池,生锈较快,而纯铁形不成原电池生锈较慢,能用原电池原理解释,故D与题意不符;
故答案为:B
21.Zn(锌) CuSO4(硫酸铜) 2H++2e-=H2↑ c 2NaCl+2H2O2NaOH+Cl2↑+H2↑ 4.48L
解析:
(1)①依据反应:可知,该装置为铜锌原电池,Zn作负极,Cu作正极,则电极X的材料是Zn(锌);Y溶液可以是CuSO4(硫酸铜)溶液;
②电池放电过程中,盛有饱和琼脂溶胶的盐桥中,溶液在负极区,原电池中,阴离子向负极移动,则向溶液扩散的离子是;
(2)①钢铁在酸性较强的环境中发生析氢腐蚀,正极反应式:2H++2e-=H2↑;
②为了减缓水库铁闸门被腐蚀的速率,可以采用图示中的牺牲阳极的阴极保护法,即在铁闸门上的固体材料R的活泼性要强于铁,
a.铜的活泼性比铁弱,不能减缓水库铁闸门被腐蚀的速率,故a不符合题意;
b.钠的活泼性比铁强,但钠可与水反应,故b不符合题意;
c.锌的活泼性比铁强,可代替铁作负极,能减缓水库铁闸门被腐蚀的速率,故c符合题意;
d.石墨活泼性比铁弱,不能代替铁作负极,不能减缓水库铁闸门被腐蚀的速率,故d不符合题意;
答案选c;
(3)①根据图示,该装置为电解质, X、Y都是惰性电极,根据电源电极可知,X作阴极,Y作阳极,若a是饱和溶液,则该装置为电解饱和食盐水,生成氯气、氢气和氢氧化钠,电解的总反应式为2NaCl+2H2O2NaOH+Cl2↑+H2↑;
②根据①中电解总反应,生成1mol氯气和1mol氢气时电路中转移2mol电子,当电路中流通电子时,生成0.1mol氯气和0.1mol氢气,则整个装置共放出标准状况下气体体积为0.2×22.4L/mol=4.48L。
22.2FeCl3+Fe=3FeCl2 BD Cu Cu2++2e-=Cu 0.08 镀铜铁
解析:
(1)铁锈的成分是Fe2O3 xH2O,能和盐酸反应生成氯化铁和水,氯化铁具有氧化性,能和铁发生化合反应生成氯化亚铁,反应方程式为2FeCl3+Fe=3FeCl2;
(2) A.Fe是金属,比石墨活泼,作为原电池的负极,被腐蚀,A不符合题意;
B.Zn比Fe活泼,作为原电池的负极,被腐蚀,可以保护Fe棒,B符合题意;
C.Fe棒浸入水中,水中溶解的氧气会使Fe发生吸氧腐蚀,C不符合题意;
D.Fe棒作为电解池的阴极,属于外加电源的阴极保护法,可以保护Fe棒,D符合题意;
故选BD;
(3)①电镀池中,铁上镀铜,待镀金属为铁,做阴极,镀层铜做阳极,故A极的材料为Cu;B极连接电源负极为阴极,所以B极上铜离子得电子生成铜单质:Cu2++2e-=Cu。
②根据电极反应:阳极Cu-2e-=Cu2+,阴极Cu2++2e-=Cu,可知阳极被氧化的铜和阴极析出的铜相等,两极相差5.12g时,两极的质量变化均为2.56 g,转移电子的物质的量为×2=0.08 mol;
③根据金属活动性:Zn>Fe>Cu,铁比铜活泼,镀铜铁的镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀,而镀锌铁的镀层破坏后,Zn为原电池的负极,被腐蚀,正极的Fe不会被腐蚀,综上所述镀铜铁更易被腐蚀。
23.化学 电化学 ①>③>② 涂油漆 涂油脂 焊接锌块
解析:
金属和化学物质直接反应的腐蚀是化学腐蚀,金属和电解质溶液构成原电池的腐蚀是电化学腐蚀;在原电池中作负极的金属腐蚀速率加快,结合常见的金属防腐的方法分析解答。
(1)金属的腐蚀分为:与化学物质直接反应的腐蚀和构成原电池而产生电流的腐蚀,分为化学腐蚀和电化学腐蚀,故答案为:化学;电化学;
(2)①中铁作原电池负极,加快了铁的腐蚀,②中铁作原电池正极而被保护,不被腐蚀,所以铁被腐蚀的速率由快到慢的顺序是①>③>②,故答案为:①>③>②;
(3)A.健身器材是用涂油漆的方法来防锈的,故答案为:涂油漆;
B.防止自行车的链条、齿轮腐蚀,可通过涂油脂的方法防锈,故答案为:涂油脂;
C.为防止海水中的轮船被腐蚀,常常是在轮船底部焊接锌块的方法防锈,故答案为:焊接锌块。
24.吸氧 负 C 石灰石(或CaCO3) B B F
解析:
(1)①铁在空气中与氧气、水共同作用而生锈,铁锈的主要成分是铁的氧化物氧化铁,钢铁在空气中发生电化学腐蚀时主要发生吸氧腐蚀,铁易失电子发生氧化反应而作负极,负极上电极反应式为:Fe- 2e- =Fe2+;
②聚苯乙烯是由苯乙烯经加聚反应而得来,属于高分子化合物,而不是金属材料,而无机非金属材料是以某些元素的氧化物、碳化物、氮化物、卤素化合物、硼化物以及硅酸盐、铝酸盐、磷酸盐、硼酸盐等物质组成的材料是除有机高分子材料和金属材料以外的所有材料的统称,故选C;
③生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥,所以在玻璃工业、水泥工业中都要用到的原料是石灰石(或CaCO3);
(2)①剩菜剩饭、瓜果皮属于其他垃圾,故可投入有标志垃圾箱,故选B;
②剩菜剩饭、瓜果皮腐烂变质会变成肥料,适宜堆肥处理,故选B;
③白色污染是难降解的塑料垃圾(多指塑料袋)对环境造成的污染,故选F。
25.外加电流的阴极保护法 正 O2+4e-+2H2O=4OH- 阴离子交换膜 N2H4-4e-+4OH-=N2↑+4H2O 8:17
解析:
(1)①K 与 M 连接时构成了电解池,钢铁桥墩的电化学防护方法为外加电流的阴极保护法。
②K与N连接时构成了原电池,钢铁桥墩为正极被保护,锌板做负极被腐蚀,是牺牲阳极的阴极保护法,在钢铁桥墩(即正极)上,溶解在海水中的氧气得电子,电极反应式为:O2+4e-+2H2O=4OH-。
(2)N2H4—H2O2 燃料电池中,通入N2H4的电极B为负极,N2H4在负极上失去电子生成氮气,电极反应式为:N2H4-4e-+4OH-=N2↑+4H2O;通入H2O2的电极A为正极,在正极上H2O2得到电子生成OH-:H2O2+2e-=2OH-,OH-通过离子交换膜进入负极区,所以离子交换膜为阴离子交换膜;根据电子守恒,当有1molN2H4参加反应时,消耗的H2O2为2mol,所以N2H4和H2O2的物质的量之比为1:2,质量比为1×32:2×34=8:17。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
选修4第四章第四节金属的电化学腐蚀与防护同步练习
第I卷(选择题)
一、单选题
1.下列事实与电化学无关的是( )
A.暖宝宝(含铁粉、碳、氯化钠等)发热 B.海沙比河沙混凝土更易使钢筋生锈 C.家用铁锅生锈 D.铁罐运输浓硫酸
2.下列说法中不正确的是( )
A.需要加热才能发生的反应不一定是吸热反应
B.轮船底部镶嵌锌块,可以防止船体被腐蚀
C.钢铁腐蚀的负极反应为:
D.常温时,向纯水中加入酸或碱一定会影响水的电离程度
3.炒过菜的铁锅未及时洗净(残液中含),不久便会因被腐蚀而出现红褐色锈斑,腐蚀原理如图所示,下列说法正确的是( )
A.腐蚀过程中,负极是,发生电极反应:
B.失去电子经电解质溶液转移给C
C.正极的电极反应式为
D.C是正极,在C表面上发生还原反应
4.下列叙述与电化学腐蚀有关的是( )
A.切过菜的菜刀不及时清洗易生锈
B.在空气中金属镁、铝都具有较好的抗腐蚀性
C.红热的铁丝与水接触时,表面形成了蓝黑色的物质
D.把铁片投入到氯化铜的溶液中,在铁表面上附着一层红色的铜
5.下列说法正确的是( )
A.氯碱工业的电解槽示意图如上图甲所示,电解槽中应使用阴离子交换膜
B.在铁表面镀锌时,锌应与电源的负极相连
C.为防止轮船的腐蚀,可在船底焊接镁块
D.电解精炼铜时,阴阳两极质量的变化应相等
6.如图装置中,U形管内为红墨水,a、b试管内分别盛有浓氯化铵溶液和食盐水,各加入一生铁块,放置一段时间。下列有关描述错误的是( )
A.生铁块中的碳是原电池的正极
B.两支试管中的铁都发生氧化反应
C.一段时间后,U形管内红墨水两边的液面变为左高右低
D.a试管中主要发生了析氢腐蚀,b试管中主要发生了吸氧腐蚀
7.下列有关电化学说法正确的是( )
A.钢铁电化学锈蚀时,在负极失电子生成
B.在电解法精炼铜的过程中,若转移电子,理论上阴极析出铜的质量为32g
C.将海水中钢铁闸门与电源正极相连,可防止闸门被腐蚀
D.如图所示的铅蓄电池在放电过程中,负极质量减小,正极质量增加
8.某地下了一场酸雨,在这种环境中的铁制品极易被腐蚀。对该条件下铁制品发生电化学腐蚀的叙述正确的是( )
A.该电化学腐蚀是析氢腐蚀 B.正极反应式:
C.原电池反应减缓了铁制品的腐蚀 D.负极反应式:
9.下图装置中铁锈蚀的快慢顺序是( )
A.a>b c>d B.a>b c
A.“静电除尘”、“燃煤固硫”、“汽车尾气催化净化”都能提高空气质量
B.在日常生活中,造成钢铁腐蚀的主要原因是化学腐蚀
C.“朝坛雾卷,曙岭烟沉”中的雾是一种气溶胶,能产生丁达尔现象
D.纯碱可用于生产普通玻璃,生活中也可用热的纯碱溶液来除去物品表面油污
11.下列各容器中盛有海水,则铁被腐蚀的速率由快到慢的顺序是( )
A.④>②>①>③>⑤>⑥ B.⑤>④>②>③>①>⑥
C.④>⑥>②>①>③>⑤ D.⑥>③>⑤>②>④>①
12.以下现象和电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.银制物品久置表面变暗
C.铁质器件附有铜制配件,在接触处易生铁锈
D.生铁比纯铁容易生锈
13.下列有关金属腐蚀的说法,正确的是( )
A.化学腐蚀比电化学腐蚀要普遍得多
B.化学腐蚀和电化学腐蚀不可能同时发生
C.化学腐蚀比电化学腐蚀的腐蚀速度要快得多
D.电化学腐蚀过程伴随有电流产生,而化学腐蚀过程没有
14.下列关于金属腐蚀与防护的说法错误的是( )
A.图①中的铁钉不易生锈
B.图②中,若将钢闸门与电源的正极相连,可防止钢闸门被腐蚀
C.图②中,若断开电源,钢闸门将发生吸氧腐蚀
D.图③中,若金属M比Fe活泼,可防止输水管腐蚀
15.利用下图装置,可以模拟铁的电化学防护。下列说法正确的是( )
A.若X为铝,开关K置于M处,该电化学防护法称为牺牲阳极的阴极保护法
B.若X为碳棒,为减缓铁的腐蚀,开关K应该置于M处
C.若X为碳棒,K与M连接时,一段时间后溶液的pH减小
D.若X为铝,K与N连接时,X电极产生气泡
16.根据所学习的电化学知识,下列说法正确的是( )
A.酸雨后钢铁易发生析氢腐蚀、铁锅存留盐液时易发生吸氧腐蚀
B.太阳能电池板的主要材料为二氧化硅
C.水库的钢闸门与电源正极连接可实现电化学保护
D.智能手机常用的锂离子电池属于一次电池
17.将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘处少。下列说法不正确的是( )
A.液滴中的Cl-向a区迁移
B.液滴边缘是正极区,发生的电极反应为: O2+2H2O+4e-=4OH-
C.液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH-形成Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一锌螺丝钉的铁板,在锌铁接触处滴加NaCl溶液,则负极发生的电极反应为:Zn-2e-=Zn2+
18.铜板上铁铆钉处的吸氧腐蚀原理如下图所示,下列有关说法正确的是( )
A.正极电极反应式为:2H++2e-=H2↑
B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
C.此过程中Fe、Cu均被腐蚀
D.此过程中电流从Fe移向Cu
19.在潮湿的深层土壤中,钢管主要发生厌氧腐蚀,厌氧细菌可促使土壤中的与H2反应生成S2-,加速钢管的腐蚀,其反应原理如下图所示。
下列说法正确的是( )
A.正极的电极反应式为:2H2O+O2+4e-=4OH-
B.钢管腐蚀的直接产物中含有FeS、Fe(OH)2
C.在钢管表面镀锌或镀铜均可减缓钢管的腐蚀
D.与H2的反应可表示为:4H2+-8e-S2-+4H2O
20.下列变化中不能用原电池原理解释的是( )
A.镀层破损后,白口铁(镀锌铁)中的铁不易腐蚀
B.红热的铁丝与水蒸气接触表面形成蓝黑色保护层
C.暖宝宝中的炭粉、铁粉、食盐、水混合暴露在空气中放热
D.相同条件下,久置在潮湿的空气中,生铁比纯铁更易生锈
第II卷(非选择题)
二、填空题
21.(1)依据反应:设计的原电池如图所示。
①电极X的材料是________;Y溶液可以是________溶液。
②电池放电过程中,盛有饱和琼脂溶胶的盐桥中,向溶液扩散的离子是________(填离子符号)。
(2)钢铁发生电化学腐蚀可分为析氢腐蚀和吸氧腐蚀,可以采用电化学手段进行防护。
①写出钢铁在酸性较强的环境中发生电化学腐蚀的正极反应式:_______________________。
②为了减缓水库铁闸门被腐蚀的速率,可以采用下图所示的方案:
其中连接在铁闸门上的固体材料R可以采用________(填写字母序号)。
a.铜 b.钠 c.锌 d.石墨
(3)电解原理在工业上有着广泛的用途,如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。
①若X、Y都是惰性电极,a是饱和溶液,则电解的总反应式为________________。
②当电路中流通电子时,整个装置共放出气体________L(标准状况下)。
22.钢铁工业是国家工业的基础。请回答下列钢铁腐蚀、防护过程中的有关问题:
(1)生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式是___________________________________。
(2)下列装置可防止铁棒被腐蚀的是______________。
(3)在实际生产中,可在铁件的表面镀铜防止铁被腐蚀,装置如图所示。
①A电极对应的金属是_______(填元素名称),B电极的电极反应是____________________________。
②若电镀前铁、铜两片金属质量相同,电镀完成后将它们取出洗净、烘干、称量,二者质量差为5.12g,则电镀时电路中通过的电子为_______mol。
③镀层破损后,镀铜铁和镀锌铁,_______更易被腐蚀。
23.如何防止铁的锈蚀是工业上研究的重点内容。为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中。请回答:
(1)金属腐蚀主要分为________腐蚀和________腐蚀两种。
(2)铁被腐蚀的速率由快到慢的顺序是________(填序号)。
(3)请你为以下钢铁制品选择适当的防锈方法。
A.健身器材__________________________________________;
B.自行车的链条、齿轮________________________________;
C.海水中的轮船______________________________________。
24.(1)材料是人类生活的物质基础,新型材料的制造则是科技快速发展的重要标志。
①钢铁是制造铁路、桥梁、轮船等的主要材料,钢铁在潮湿的空气中主要发生___________腐蚀(填“吸氧”或“析氢”),腐蚀时Fe作为原电池的___________极。
②目前,很多地方使用的泡沫塑料快餐具的主要成分是聚苯乙烯(简称EPS),聚苯乙烯属于___________(请用相应的字母填空)。
A.无机非金属材料B.金属材料C.有机高分子材料
③工业上生产玻璃、水泥都要用到的原料是___________。
(2)垃圾是放错了位置的资源,必须对垃圾进行分类回收。某住宅小区清理出一些垃圾:A.废纸 B.剩菜剩饭、瓜果皮 C.废旧电池 D.废玻璃瓶 E.废橡胶手套 F.一次性塑料饭盒。请用相应的字母填空:
①其中可投入有标志垃圾箱的是___________。
②其中适宜堆肥处理的垃圾是___________。
③随意丢弃___________,会造成白色污染。
25.电化学知识在生产、科技研究中应用广泛。
(1)可采用电化学防护技术减缓海水中钢铁设施的腐蚀,下图是钢铁桥墩部分防护原理示意图。
①K 与 M 连接时钢铁桥墩的电化学防护方法为______。
②K与N连接时,钢铁桥墩为______极(填"正"、"负"、"阴"或"阳"),电极反应式为__________________________________。
(2)燃料电池由于其较高的能量密度而备受关注,其工作原理如图所示。
电池工作时,A极区 NaOH浓度不变,则离子交换膜为______(填"阳离子交换膜"或"阴离子交换膜");电极 B的电极反应式为____________________;电池工作时参加反应的=______。
参考答案
1.D
解析:
A.暖宝宝中铁粉、碳在氯化钠溶液中构成原电池,铁发生吸氧腐蚀放出热量,与电化学有关,故A不符合题意;
B.海沙中电解质的量大于河沙,钢筋在海沙中构成原电池时,由于电解质溶液浓度大,腐蚀速率快,则海沙比河沙混凝土更易使钢筋生锈与电化学有关,故B不符合题意;
C.家用铁锅生锈是因为铁锅与锅中残留溶液构成原电池,发生吸氧腐蚀,则家用铁锅生锈与电化学有关,故C不符合题意;
D.铁在冷的浓硫酸中发生钝化,则铁罐运输浓硫酸与铁的钝化有关,与电化学有无关,故D符合题意;
故选D。
2.C
解析:
A.需要加热才能发生的反应不一定是吸热反应,如铁和硫反应需要加热,但铁和硫的反应是放热反应,故A正确;
B.轮船底部镶嵌锌块,锌和铁以及海水构成原电池的两极,锌做负极被腐蚀,铁做正极被保护,可以防止船体被腐蚀,故B正确;
C.钢铁腐蚀的负极反应为: Fe-2e-= Fe2+,故C错误;
D.常温时,向纯水中加入酸或碱,增大了H+或OH-浓度,使水电离程度减小,影响了水的电离程度,故D正确;
故选C。
3.D
解析:
该原电池中,Fe易失电子作负极、C作正极,负极上铁失电子生成亚铁离子,正极上氧气得电子发生还原反应,负极反应式为Fe- 2e- = Fe2+,正极反应式为O2 + 2H2O+4e -= 4OH-;
A.腐蚀过程中,负极是,发生电极反应:Fe- 2e- = Fe2+,故A错误;
B.原电池中电子沿外导线从负极流向正极,不能通过电解质溶液,电解质溶液中是离子的定向移动形成闭合回路,故B错误;
C.正极电极反应是溶液中氧气得到电子发生还原反应,电极反应O2 + 2H2O+4e -= 4OH-,故C错误;
D.C是正极,正极电极反应是溶液中氧气得到电子发生还原反应,故D正确;
故选D。
4.A
解析:
A.切过菜的菜刀不及时清洗,在菜刀上就会以NaCl为电解质溶液形成原电池,发生电化学腐蚀,A正确;
B.金属镁、铝都具有较好的抗腐蚀性,是因为它们在空气中容易氧化,在金属表面生成一层致密的氧化物薄膜,阻止继续被氧化,B错误;
C.红热的铁丝与水蒸气接触,生成四氧化三铁,属于化学腐蚀,C错误;
D.铁片投入到氯化铜的溶液中是直接发生化学反应,将铜置换,D错误;
答案选A。
5.C
解析:
A.氯碱工业中阳极氯离子被氧化生成氯气,阴极水电离出的氢离子放电生成氢气,同时产生氢氧根,所以NaOH在阴极生成,即右侧为阴极区,左侧为阳极区,为了防止生成的氯气与NaOH反应,一般采用阳离子交换膜阻止阴极生成的氢氧根进入阳极区与氯气反应,同时可以钠离子进入阴极区,A错误;
B.在铁表面镀锌时,则需要锌离子在铁表面被还原,所以铁为阴极,与电源负极相连,B错误;
C.镁比铁活泼,发生电化学腐蚀时,镁为负极被氧化,铁为正极被保护,C正确;
D.电解精炼铜时,阴极铜离子放电生成铜单质,但阳极除了铜放电外,比通活泼的金属如Fe、Zn等会先于铜放电,且还有阳极泥的生成,所以阴阳两极质量的变化不相等,D错误;
综上所述答案为C。
6.C
解析:
A.生铁中含有铁和碳,铁、碳和电解质溶液构成了原电池,较活泼的金属铁作负极,碳作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,故A正确;
B.生铁中含有铁和碳,铁、碳和电解质溶液构成了原电池,较活泼的金属铁作负极,碳作正极,负极上铁失电子发生氧化反应,故B正确;
C.左试管中是酸性溶液,主要发生了析氢腐蚀,右试管中是中性溶液,主要发生了吸氧腐蚀,所以右试管内气体氧气减小,左试管内气体压强不大,导致U形管内红墨水两边的液面变为左低右高,故C错误;
D.a试管中是酸性溶液,主要发生了析氢腐蚀,b试管中是中性溶液,主要发生了吸氧腐蚀,故D正确;
故选C。
7.B
解析:
A.钢铁电化学腐蚀时,Fe在负极上失电子生成Fe2+,故A错误;
B.精炼铜过程中,阴极上电极反应式为Cu2++2e-=Cu,转移1mol电子,理论上阴极析出铜的质量为32g,故B正确;
C.根据电解原理,活动性金属作阳极,活动性金属先失电子,因此钢铁闸门应于电源的负极相连,可防止闸门被腐蚀,故C错误;
D.负极电极反应式为Pb-2e-+=PbSO4,电极质量增大,正极反应式为PbO2+2e-++4H+=PbSO4+2H2O,正极质量增大,故D错误;
答案为B。
8.A
解析:
A.铁制品中含有铁和碳,酸雨使水膜呈酸性,构成了原电池,会发生析氢腐蚀,故A正确;
B.酸性环境中发生析氢腐蚀,正极反应为氢离子得电子生成氢气:2H++2e-=H2,故B错误;
C.原电池反应会加快铁制品的腐蚀,故C错误;
D.发生电化学腐蚀时金属铁被氧化为Fe2+,负极反应式为︰Fe-2e-=Fe2+,故D错误;
故选A。
9.B
解析:
a与b比较,a中Fe与空气接触,b中Fe不与空气接触,故铁锈蚀的速率a>b;c与d比较,c、d都形成原电池。c中Zn活泼性强于Fe,Zn失去电子作原电池负极:Zn-2e-=Zn2+,溶液中H+在Fe极上得电子:2H++2e-=H2↑(正极),Fe得到保护;d中Fe活泼性强于Cu,失去电子被氧化,故铁锈蚀的速率d>c。综上所述故选B。
10.B
解析:
A.“静电除尘”能减少粉尘排放、“燃煤固硫”可减少二氧化硫的排放、“汽车尾气催化净化”能减少氮的氧化物排放,都能提高空气质量,故A正确;
B.在日常生活中,造成钢铁腐蚀的主要原因是电化学腐蚀,故B错误;
C.雾是一种气溶胶,具有胶体的性质,能产生丁达尔现象,故C正确;
D.生产普通玻璃的原料为石英、石灰石和纯碱,碳酸钠在溶液中水解使溶液呈碱性,热的纯碱溶液可除去物品表面油污,故D正确;
故选B。
11.C
解析:
由题图可知,④中铁作电解池的阳极,被腐蚀的速率最快;②、⑥中铁作原电池的负极,铁被腐蚀,且两电极金属的活泼性相差越大,负极金属越容易被腐蚀,则铁被腐蚀的速率:⑥>②;①中铁发生化学腐蚀;⑤中铁作电解池的阴极,铁被保护,被腐蚀的速率最慢;③中铁作原电池的正极,铁被保护,但被腐蚀的速率大于⑤。综上所述,铁被腐蚀的速率由快到慢的原序为④>⑥>②>①>③>⑤,C项符合题意。
故选C。
12.B
解析:
A.黄铜(铜锌合金)制作的铜锣中,金属锌为负极,金属铜做正极,Cu被保护,不易腐蚀,和电化学腐蚀有关,A项不选;
B.银制物品久置表面变暗,是金属银和空气中的成分发生反应的结果,属于化学腐蚀,与电化学腐蚀无关,B项选;
C.铁质器件附有铜质配件,在接触处形成原电池装置,其中金属铁为负极,易生铁锈,和电化学腐蚀有关,C项不选;
D.生铁中金属铁、碳、潮湿的空气能构成原电池,金属铁为负极,易被腐蚀而生锈,和电化学腐蚀有关,D项不选。
答案选B。
13.D
解析:
化学腐蚀是金属与接触到的干燥气体或非电解质液体等直接发生反应而引起的腐蚀;不纯的金属跟电解质溶液接触时,会发生原电池反应,比较活泼的金属失去电子而被氧化,这种腐蚀叫做电化学腐蚀。
A. 金属一般都不纯,电化学腐蚀比化学腐蚀要普遍得多,故A错误;
B. 化学腐蚀和电化学腐蚀可能同时发生,故B错误;
C. 电化学腐蚀比化学腐蚀的腐蚀速度要快得多,故C错误;
D. 电化学腐蚀过程伴随有电流产生,而化学腐蚀过程没有,故D正确;
故选D。
14.B
解析:
A.碱石灰能干燥试管中的空气,即铁钉与水不接触,不易生锈,A项正确;
B.将钢闸门与电源的正极相连,则钢闸门作为阳极,失电子发生氧化反应,加速了钢闸门的腐蚀,B项错误;
C.断开电源,图②装置为原电池,海水为弱碱性电解质溶液,钢闸门将发生吸氧腐蚀,C项正确;
D.图③中,若金属M比铁活泼,则金属M作负极,失电子发生氧化反应,可保护输水管不被腐蚀,D项正确。
故选B。
15.A
解析:
若X为碳棒,开关K置于N处,形成电解池,此时金属铁为阴极,铁被保护,开关K置于M处,形成原电池,金属铁是负极,碳棒是正极,正极上是氧气得电子的还原反应;若X是铝棒,将K与M连接,形成原电池,金属铝是负极,铁是正极,则铁不易受腐蚀,将K与N连接,形成电解池,铝棒是阳极,电极本身发生失电子的氧化反应。
A. 若X为铝,开关K置于M处,形成原电池,金属铝是负极,铁是正极,则铁不易受腐蚀,该电化学防护法称为牺牲阳极的阴极保护法,故A正确;
B. 若X为碳棒,开关K应该置于M处,形成原电池,金属铁是负极,碳棒是正极,正极上是氧气得电子的还原反应,加快铁的腐蚀,故B错误;
C. 若X为碳棒,K与M连接时,形成原电池,金属铁是负极,碳棒是正极,正极上是氧气得电子的还原反应,O2+4e-+2H2O=4OH-,一段时间后溶液的pH增大,故C错误;
D. 若X为铝,K与N连接时,形成电解池,此时金属铁为阴极,铁被保护,X电极无气泡产生,发生Al-3e-=Al3+,故D错误;
故选A。
16.A
解析:
A.酸雨后钢铁易发生析氢腐蚀、铁锅存留盐液时易发生吸氧腐蚀,A项正确;
B.太阳能电池板的主要材料为Si,B项错误;
C.水库的钢闸门与电源负极连接可实现电化学保护,为外加电流的阴极保护法,C项错误;
D.智能手机常用的锂离子电池属于二次电池,D项错误;
答案选A。
17.C
解析:
a区、b区的铁板与NaCl溶液形成原电池。因为中心a区含氧量减少,b区附近含氧量较高,故b区发生的电极反应为:O2+2H2O+4e-=4OH-;a区发生的电极反应为:Fe-2e-=Fe2+,即a区是负极,b区是正极。溶液中的阳离子移向正极b区,阴离子移向负极a区。
A.由分析可知,Cl-向a区迁移,A正确;
B.由分析可知,b区是正极,电极反应为: O2+2H2O+4e-=4OH-,B正确;
C.液滴下的Fe发生氧化反应而被腐蚀,C错误;
D.铁板上嵌Zn之后,负极为Zn,发生的电极反应为:Zn-2e-=Zn2+,D正确。
故选C。
18.B
解析:
铆钉处吸氧腐蚀的正极电极反应式为:O2+2H2O+4e-=4OH-,铜作正极不被腐蚀,电子从负极铁通过导线流向正极铜,据此分析解题。
A.正极电极反应式为:O2+2H2O+4e-=4OH-,故A错误;
B.电化学腐蚀过程中生成的Fe(OH)2易被氧化成Fe(OH)3,故B正确;
C.铜为正极,被保护起来了,故C错误;
D.此过程中电子从负极Fe移向正极Cu,电流从Cu移向Fe,故D错误;
故选B。
19.B
解析:
A.由图知,钢铁发生析氢腐蚀,正极反应式为: ,A错误;
B.铁发生析氢腐蚀时,负极反应式是,正极反应式为: ,亚铁离子和氢氧根离子反应生成氢氧化亚铁沉淀,厌氧细菌可促使土壤中的与H2反应生成S2-,亚铁离子和硫离子反应生成FeS,则钢管腐蚀的直接产物中含有、Fe(OH)2,B正确;
C.原电池中,作负极的金属加速被腐蚀,作正极的金属被保护,Fe、Zn和电解质溶液构成原电池时,锌易失电子作负极,Fe作正极,所以Fe被保护,在钢管表面镀锌可以防止腐蚀,但在钢管表面镀铜,铁易失电子作负极,铜作正极,铁腐蚀得更快, C错误;
D. 与H2发生氧化还原反应,反应可表示为:4H2+S2-+4H2O,D错误;
答案选B。
20.B
解析:
A.镀层破损后,白口铁(镀锌铁)中,锌、铁和金属表面的水膜形成原电池,锌比铁活泼,锌为负极,则铁不易腐蚀,能用原电池原理解释,故A与题意不符;
B.红热的铁丝与水蒸气接触生成四氧化三铁和氢气,则表面形成四氧化三铁蓝黑色保护层,与原电池无关,故B符合题意;
C.暖宝宝中的炭粉、铁粉、食盐、水混合暴露在空气中,炭粉、铁粉、食盐水形成原电池,铁粉被氧化放热,能用原电池原理解释,故C与题意不符;
D. 生铁是铁碳合金,在潮湿的环境中容易形成原电池,生锈较快,而纯铁形不成原电池生锈较慢,能用原电池原理解释,故D与题意不符;
故答案为:B
21.Zn(锌) CuSO4(硫酸铜) 2H++2e-=H2↑ c 2NaCl+2H2O2NaOH+Cl2↑+H2↑ 4.48L
解析:
(1)①依据反应:可知,该装置为铜锌原电池,Zn作负极,Cu作正极,则电极X的材料是Zn(锌);Y溶液可以是CuSO4(硫酸铜)溶液;
②电池放电过程中,盛有饱和琼脂溶胶的盐桥中,溶液在负极区,原电池中,阴离子向负极移动,则向溶液扩散的离子是;
(2)①钢铁在酸性较强的环境中发生析氢腐蚀,正极反应式:2H++2e-=H2↑;
②为了减缓水库铁闸门被腐蚀的速率,可以采用图示中的牺牲阳极的阴极保护法,即在铁闸门上的固体材料R的活泼性要强于铁,
a.铜的活泼性比铁弱,不能减缓水库铁闸门被腐蚀的速率,故a不符合题意;
b.钠的活泼性比铁强,但钠可与水反应,故b不符合题意;
c.锌的活泼性比铁强,可代替铁作负极,能减缓水库铁闸门被腐蚀的速率,故c符合题意;
d.石墨活泼性比铁弱,不能代替铁作负极,不能减缓水库铁闸门被腐蚀的速率,故d不符合题意;
答案选c;
(3)①根据图示,该装置为电解质, X、Y都是惰性电极,根据电源电极可知,X作阴极,Y作阳极,若a是饱和溶液,则该装置为电解饱和食盐水,生成氯气、氢气和氢氧化钠,电解的总反应式为2NaCl+2H2O2NaOH+Cl2↑+H2↑;
②根据①中电解总反应,生成1mol氯气和1mol氢气时电路中转移2mol电子,当电路中流通电子时,生成0.1mol氯气和0.1mol氢气,则整个装置共放出标准状况下气体体积为0.2×22.4L/mol=4.48L。
22.2FeCl3+Fe=3FeCl2 BD Cu Cu2++2e-=Cu 0.08 镀铜铁
解析:
(1)铁锈的成分是Fe2O3 xH2O,能和盐酸反应生成氯化铁和水,氯化铁具有氧化性,能和铁发生化合反应生成氯化亚铁,反应方程式为2FeCl3+Fe=3FeCl2;
(2) A.Fe是金属,比石墨活泼,作为原电池的负极,被腐蚀,A不符合题意;
B.Zn比Fe活泼,作为原电池的负极,被腐蚀,可以保护Fe棒,B符合题意;
C.Fe棒浸入水中,水中溶解的氧气会使Fe发生吸氧腐蚀,C不符合题意;
D.Fe棒作为电解池的阴极,属于外加电源的阴极保护法,可以保护Fe棒,D符合题意;
故选BD;
(3)①电镀池中,铁上镀铜,待镀金属为铁,做阴极,镀层铜做阳极,故A极的材料为Cu;B极连接电源负极为阴极,所以B极上铜离子得电子生成铜单质:Cu2++2e-=Cu。
②根据电极反应:阳极Cu-2e-=Cu2+,阴极Cu2++2e-=Cu,可知阳极被氧化的铜和阴极析出的铜相等,两极相差5.12g时,两极的质量变化均为2.56 g,转移电子的物质的量为×2=0.08 mol;
③根据金属活动性:Zn>Fe>Cu,铁比铜活泼,镀铜铁的镀层破坏后,在潮湿环境中形成原电池,铁为负极,加速铁的腐蚀,而镀锌铁的镀层破坏后,Zn为原电池的负极,被腐蚀,正极的Fe不会被腐蚀,综上所述镀铜铁更易被腐蚀。
23.化学 电化学 ①>③>② 涂油漆 涂油脂 焊接锌块
解析:
金属和化学物质直接反应的腐蚀是化学腐蚀,金属和电解质溶液构成原电池的腐蚀是电化学腐蚀;在原电池中作负极的金属腐蚀速率加快,结合常见的金属防腐的方法分析解答。
(1)金属的腐蚀分为:与化学物质直接反应的腐蚀和构成原电池而产生电流的腐蚀,分为化学腐蚀和电化学腐蚀,故答案为:化学;电化学;
(2)①中铁作原电池负极,加快了铁的腐蚀,②中铁作原电池正极而被保护,不被腐蚀,所以铁被腐蚀的速率由快到慢的顺序是①>③>②,故答案为:①>③>②;
(3)A.健身器材是用涂油漆的方法来防锈的,故答案为:涂油漆;
B.防止自行车的链条、齿轮腐蚀,可通过涂油脂的方法防锈,故答案为:涂油脂;
C.为防止海水中的轮船被腐蚀,常常是在轮船底部焊接锌块的方法防锈,故答案为:焊接锌块。
24.吸氧 负 C 石灰石(或CaCO3) B B F
解析:
(1)①铁在空气中与氧气、水共同作用而生锈,铁锈的主要成分是铁的氧化物氧化铁,钢铁在空气中发生电化学腐蚀时主要发生吸氧腐蚀,铁易失电子发生氧化反应而作负极,负极上电极反应式为:Fe- 2e- =Fe2+;
②聚苯乙烯是由苯乙烯经加聚反应而得来,属于高分子化合物,而不是金属材料,而无机非金属材料是以某些元素的氧化物、碳化物、氮化物、卤素化合物、硼化物以及硅酸盐、铝酸盐、磷酸盐、硼酸盐等物质组成的材料是除有机高分子材料和金属材料以外的所有材料的统称,故选C;
③生产玻璃的原料是纯碱、石灰石和石英,高温下,碳酸钠、碳酸钙和二氧化硅反应分别生成硅酸钠、硅酸钙;生产水泥以黏土和石灰石为主要原料,经研磨、混合后在水泥回转窑中煅烧,再加入适量石膏,并研成细粉就得到普通水泥,所以在玻璃工业、水泥工业中都要用到的原料是石灰石(或CaCO3);
(2)①剩菜剩饭、瓜果皮属于其他垃圾,故可投入有标志垃圾箱,故选B;
②剩菜剩饭、瓜果皮腐烂变质会变成肥料,适宜堆肥处理,故选B;
③白色污染是难降解的塑料垃圾(多指塑料袋)对环境造成的污染,故选F。
25.外加电流的阴极保护法 正 O2+4e-+2H2O=4OH- 阴离子交换膜 N2H4-4e-+4OH-=N2↑+4H2O 8:17
解析:
(1)①K 与 M 连接时构成了电解池,钢铁桥墩的电化学防护方法为外加电流的阴极保护法。
②K与N连接时构成了原电池,钢铁桥墩为正极被保护,锌板做负极被腐蚀,是牺牲阳极的阴极保护法,在钢铁桥墩(即正极)上,溶解在海水中的氧气得电子,电极反应式为:O2+4e-+2H2O=4OH-。
(2)N2H4—H2O2 燃料电池中,通入N2H4的电极B为负极,N2H4在负极上失去电子生成氮气,电极反应式为:N2H4-4e-+4OH-=N2↑+4H2O;通入H2O2的电极A为正极,在正极上H2O2得到电子生成OH-:H2O2+2e-=2OH-,OH-通过离子交换膜进入负极区,所以离子交换膜为阴离子交换膜;根据电子守恒,当有1molN2H4参加反应时,消耗的H2O2为2mol,所以N2H4和H2O2的物质的量之比为1:2,质量比为1×32:2×34=8:17。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
