化学电源_ppt课件
图片预览











文档简介
(共39张PPT)
发明电池的故事
伏特是意大利帕维亚大学的研究电学的物理学家。
? ?有一天,伏特看了一位名叫加伐尼的解剖学家的一篇论文,说动物肌肉里贮存着电,可以用金属接触肌肉把电引出来。看了这篇论文,伏特非常兴奋,便决定亲自来做这个实验。他用许多只活青蛙反复实验,终于发现,实际情况并不像加伐尼所说的那样,而是两种不同的金属接触产生的电流,才使蛙腿的肌肉充电而收缩。
? ?为了证明自己的发现是正确的,伏特决定更深入地了解电的来源。
福清高山中学 高二化学组
形形色色的电池
A
Cu
Zn
稀H2SO4
KOH溶液
CH4
O2
H2O
a极 b极
用途广泛的电池
用于汽车的铅蓄电池和燃料电池
用途广泛的电池
用于“神六”的太阳能电池
笔记本电脑专用电池
手机专用电池
摄像机专用电池
各式各样的纽扣电池
化学电池
一次电池
二次电池
燃料电池
碱性锌锰电池
铅蓄电池
氢氧燃料电池
锂离子电池
银锌蓄电池
普通锌锰干电池
锌银纽扣电池
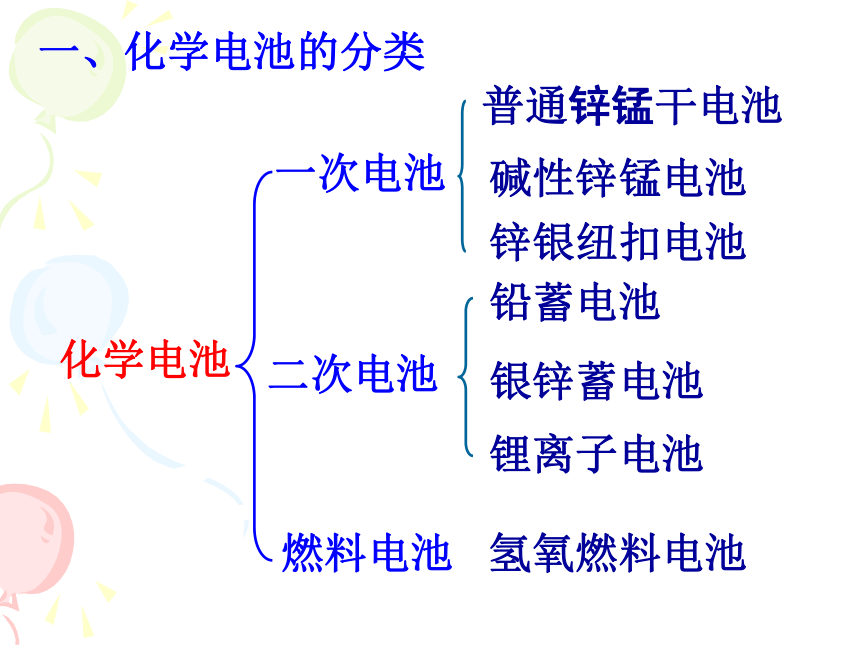
一、化学电池的分类
二、一次电池
普通锌锰电池
碱性电池
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2 和 H2O等
1、普通干电池
负极
正极
电池反应:
氢氧化氧锰
(Zn):Zn – 2e- = Zn2+
(MnO2和C):
优点:制作简单、价格便宜。 缺点:放电时间短,电压下降快。
锌锰酸性电池
负极(锌筒):
正极(石墨):
Zn + 2NH4+ + 2MnO2 = Zn2+ + 2NH3 + Mn2O3 + H2O
Zn – 2e- === Zn2+
2NH4+ + 2e - + 2MnO2 = Mn2O3 + H2O+2NH3
总反应:
酸性锌锰电池
缺点:放电时间短、放电电压下降快
2、碱性锌-锰干电池
电解质:
KOH
负极:
——Zn
Zn + 2OH- - 2e- = Zn(OH)2
正极:
——MnO2
2MnO2+2H2O+2e-=2MnOOH+2OH-
缺点:多数只能一次使用,不能充电;价格较贵
优点:比能量和储存时间有所提高,适用于大电流
和连续放电
电池反应:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
银锌电池
3、锌银钮扣电池
正极:Ag2O + H2O+ 2e- =2Ag+2OH-
负极:Zn +2OH--2e- =ZnO+H2O
总反应:
Zn+Ag2O=ZnO+2Ag
pH变化
负极:减小
正极:增大
铅蓄电池
三、二次电池
1、铅蓄电池
放电过程总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
Pb + SO42- -2e- =PbSO4
正极:
PbO2 + 4H++SO42-+2e- =2PbSO4 +2H2O
氧化反应
还原反应
负极:
①放电过程
铅蓄电池充电的反应则是上述反应的逆过程
②充电过程
PbSO4 +2e- =Pb + SO42-
还原反应
阴极:
阳极:
PbSO4 +2H2O -2e- = PbO2 + 4H++ SO42-
氧化反应
接电源负极
接电源正极
充电过程总反应:
2PbSO4+2H2O=Pb+PbO2+2H2SO4
铅蓄电池的充放电过程:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
放电
充电
缺点:
比能量低、笨重、废弃电池污染环境
优点:
可重复使用、电压稳定、使用方便、安全可靠、价格低廉
其它二次电池
镍镉电池、镍氢电池、锂离子电池、聚合物锂离子蓄电池……
四、燃料电池:
燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。(氢气、烃、肼、甲醇、氨、煤气燃料电池……)
电解液 H2O
氢氧燃料电池
2e
-
2e
-
氢气
氧气
H
+
OH
-
A
负极 正极
O2
H2
H2O
4.氢氧燃料电池
负极:2H2 + 4OH- -4e- = 4H2O
正极:O2 + 2H2O + 4e- = 4OH-
总反应式:2H2 + O2 =2H2O
碱性燃料电池
KOH
O2
H2O
H2
负极:2H2 – 4e- = 4H+
正极:O2 +4e- +4H + = 2H2O
总反应式:2H2 +O2 = 2H2O
酸性
HCl
O2
H2O
H2
3 O2+12H++12e- =6H2O
总反应:
2CH3OH+3O2→ 2CO2+4H2O
2CH3OH + 2H2O-12 e- = 2CO2+ 12H+
甲醇燃料电池
酸性条件
负极
正极
2CH3OH+4OH-+3O2→ 2CO3 2 -+3H2O
甲醇燃料电池
3O2+6H2O+12e-→12OH-
2CH3OH+16OH--12e-→2CO32-+12H2O
碱性条件
负极
正极
总反应
总反应:
CH4+2OH-+2O2→ CO3 2 -+3H2O
CH4、O2、NaOH溶液组成的燃料电池
正极:2O2+4H2O+8e-→8OH-
负极:CH4+10OH--8e-→CO32-+7H2O
总反应:
CH4+2O2→ CO2+3H2O
CH4、O2、盐酸溶液组成的燃料电池
正极:2O2+4H2O+8e-→8OH-
负极:CH4+-8e-→CO2+8H+
新型燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池
连续电池
5.锂电池
锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。
使用锂电源的手机与手提电脑
日本产海水电池
以海水电池为能源的航海标志灯
6、海水电池
电池的能量比普通干电池高20---50倍!
负极:4Al – 12e- = 4Al3+
正极:3O2 + 6H2O + 12e- = 12OH-
总反应:4Al + 3O2 + 6H2O = 4Al(OH)3
三、电池的污染和回收
1.电池中含有大量的重金属、酸、碱等物质
2.一粒小小的钮扣电池可污染600立方米水,
相当于一个人一生的饮水量一节一号电池烂在地里,能
使一平方米的土地失去利用价值,并造成永久性公害。
3.电池的回收
书写电极反应式应注意以下几点:
2.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);
1.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
3.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-;
练习1: 2004年江苏高考)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:
Zn s +2MnO2 s +H2O l =Zn OH 2 s +Mn2O3 s
下列说法错误的是 ( )
A 电池工作时,锌失去电子
B 电池正极电极反应式为:
2MnO2 s +H2O l +2e =Mn2O3 s +2OH aq
C 电池工作时,电子由正极通过外电路流向负极
D 外电路中每通过0 2 mol电子,锌的质量理论上减小6 5 g
C
练习2:航天技术上使用的氢氧燃料电池具有高
能、轻便、无污染的优点。氢氧燃料电池有酸式
和碱式两种,它们放电时的总反应都可以表示为
2H2+O2=2H2O,酸式电池中电解质是酸,其负极反
应可表示为2H2-4e-=4H+ ,则其正极反应式
为 。碱式电池的电解质是碱,
其正极反应式为O2+2H2O+4e-=4OH-,则其负极反应
可表示为 。
O2+4e-+4H+=2H2O
2H2-4e-+4OH-=4H2O
练习3:氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出将图中氢气换成甲烷时所构成的甲烷燃料电池中a极的电极反应式:
,
此时电池内总的反应式:
。
KOH溶液
CH4
O2
H2O
a b
CH4+10OH- - 8e-=CO32- +7H2O
CH4+2O2+2KOH=K2CO3+3H2O
小结:
化学电源
1、一次电池
2、二次电池
3、燃料电池
——锌锰干电池
——铅蓄电池
——氢氧燃料电池
掌握每一类典型
电池的正负极、
电极反应;了解
每一类电池的优
缺点;对其它电
池有初步的认识
减 少 污 染
节 约 资 源
发明电池的故事
伏特是意大利帕维亚大学的研究电学的物理学家。
? ?有一天,伏特看了一位名叫加伐尼的解剖学家的一篇论文,说动物肌肉里贮存着电,可以用金属接触肌肉把电引出来。看了这篇论文,伏特非常兴奋,便决定亲自来做这个实验。他用许多只活青蛙反复实验,终于发现,实际情况并不像加伐尼所说的那样,而是两种不同的金属接触产生的电流,才使蛙腿的肌肉充电而收缩。
? ?为了证明自己的发现是正确的,伏特决定更深入地了解电的来源。
福清高山中学 高二化学组
形形色色的电池
A
Cu
Zn
稀H2SO4
KOH溶液
CH4
O2
H2O
a极 b极
用途广泛的电池
用于汽车的铅蓄电池和燃料电池
用途广泛的电池
用于“神六”的太阳能电池
笔记本电脑专用电池
手机专用电池
摄像机专用电池
各式各样的纽扣电池
化学电池
一次电池
二次电池
燃料电池
碱性锌锰电池
铅蓄电池
氢氧燃料电池
锂离子电池
银锌蓄电池
普通锌锰干电池
锌银纽扣电池
一、化学电池的分类
二、一次电池
普通锌锰电池
碱性电池
锌筒
石墨棒
MnO2和C
普通锌-锰干电池的结构
NH4Cl、ZnCl2 和 H2O等
1、普通干电池
负极
正极
电池反应:
氢氧化氧锰
(Zn):Zn – 2e- = Zn2+
(MnO2和C):
优点:制作简单、价格便宜。 缺点:放电时间短,电压下降快。
锌锰酸性电池
负极(锌筒):
正极(石墨):
Zn + 2NH4+ + 2MnO2 = Zn2+ + 2NH3 + Mn2O3 + H2O
Zn – 2e- === Zn2+
2NH4+ + 2e - + 2MnO2 = Mn2O3 + H2O+2NH3
总反应:
酸性锌锰电池
缺点:放电时间短、放电电压下降快
2、碱性锌-锰干电池
电解质:
KOH
负极:
——Zn
Zn + 2OH- - 2e- = Zn(OH)2
正极:
——MnO2
2MnO2+2H2O+2e-=2MnOOH+2OH-
缺点:多数只能一次使用,不能充电;价格较贵
优点:比能量和储存时间有所提高,适用于大电流
和连续放电
电池反应:
Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2
银锌电池
3、锌银钮扣电池
正极:Ag2O + H2O+ 2e- =2Ag+2OH-
负极:Zn +2OH--2e- =ZnO+H2O
总反应:
Zn+Ag2O=ZnO+2Ag
pH变化
负极:减小
正极:增大
铅蓄电池
三、二次电池
1、铅蓄电池
放电过程总反应:
Pb+PbO2+2H2SO4=2PbSO4+2H2O
Pb + SO42- -2e- =PbSO4
正极:
PbO2 + 4H++SO42-+2e- =2PbSO4 +2H2O
氧化反应
还原反应
负极:
①放电过程
铅蓄电池充电的反应则是上述反应的逆过程
②充电过程
PbSO4 +2e- =Pb + SO42-
还原反应
阴极:
阳极:
PbSO4 +2H2O -2e- = PbO2 + 4H++ SO42-
氧化反应
接电源负极
接电源正极
充电过程总反应:
2PbSO4+2H2O=Pb+PbO2+2H2SO4
铅蓄电池的充放电过程:
Pb+PbO2+2H2SO4 2PbSO4+2H2O
放电
充电
缺点:
比能量低、笨重、废弃电池污染环境
优点:
可重复使用、电压稳定、使用方便、安全可靠、价格低廉
其它二次电池
镍镉电池、镍氢电池、锂离子电池、聚合物锂离子蓄电池……
四、燃料电池:
燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。(氢气、烃、肼、甲醇、氨、煤气燃料电池……)
电解液 H2O
氢氧燃料电池
2e
-
2e
-
氢气
氧气
H
+
OH
-
A
负极 正极
O2
H2
H2O
4.氢氧燃料电池
负极:2H2 + 4OH- -4e- = 4H2O
正极:O2 + 2H2O + 4e- = 4OH-
总反应式:2H2 + O2 =2H2O
碱性燃料电池
KOH
O2
H2O
H2
负极:2H2 – 4e- = 4H+
正极:O2 +4e- +4H + = 2H2O
总反应式:2H2 +O2 = 2H2O
酸性
HCl
O2
H2O
H2
3 O2+12H++12e- =6H2O
总反应:
2CH3OH+3O2→ 2CO2+4H2O
2CH3OH + 2H2O-12 e- = 2CO2+ 12H+
甲醇燃料电池
酸性条件
负极
正极
2CH3OH+4OH-+3O2→ 2CO3 2 -+3H2O
甲醇燃料电池
3O2+6H2O+12e-→12OH-
2CH3OH+16OH--12e-→2CO32-+12H2O
碱性条件
负极
正极
总反应
总反应:
CH4+2OH-+2O2→ CO3 2 -+3H2O
CH4、O2、NaOH溶液组成的燃料电池
正极:2O2+4H2O+8e-→8OH-
负极:CH4+10OH--8e-→CO32-+7H2O
总反应:
CH4+2O2→ CO2+3H2O
CH4、O2、盐酸溶液组成的燃料电池
正极:2O2+4H2O+8e-→8OH-
负极:CH4+-8e-→CO2+8H+
新型燃料电池
燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池
连续电池
5.锂电池
锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。
使用锂电源的手机与手提电脑
日本产海水电池
以海水电池为能源的航海标志灯
6、海水电池
电池的能量比普通干电池高20---50倍!
负极:4Al – 12e- = 4Al3+
正极:3O2 + 6H2O + 12e- = 12OH-
总反应:4Al + 3O2 + 6H2O = 4Al(OH)3
三、电池的污染和回收
1.电池中含有大量的重金属、酸、碱等物质
2.一粒小小的钮扣电池可污染600立方米水,
相当于一个人一生的饮水量一节一号电池烂在地里,能
使一平方米的土地失去利用价值,并造成永久性公害。
3.电池的回收
书写电极反应式应注意以下几点:
2.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);
1.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
3.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-;
练习1: 2004年江苏高考)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:
Zn s +2MnO2 s +H2O l =Zn OH 2 s +Mn2O3 s
下列说法错误的是 ( )
A 电池工作时,锌失去电子
B 电池正极电极反应式为:
2MnO2 s +H2O l +2e =Mn2O3 s +2OH aq
C 电池工作时,电子由正极通过外电路流向负极
D 外电路中每通过0 2 mol电子,锌的质量理论上减小6 5 g
C
练习2:航天技术上使用的氢氧燃料电池具有高
能、轻便、无污染的优点。氢氧燃料电池有酸式
和碱式两种,它们放电时的总反应都可以表示为
2H2+O2=2H2O,酸式电池中电解质是酸,其负极反
应可表示为2H2-4e-=4H+ ,则其正极反应式
为 。碱式电池的电解质是碱,
其正极反应式为O2+2H2O+4e-=4OH-,则其负极反应
可表示为 。
O2+4e-+4H+=2H2O
2H2-4e-+4OH-=4H2O
练习3:氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出将图中氢气换成甲烷时所构成的甲烷燃料电池中a极的电极反应式:
,
此时电池内总的反应式:
。
KOH溶液
CH4
O2
H2O
a b
CH4+10OH- - 8e-=CO32- +7H2O
CH4+2O2+2KOH=K2CO3+3H2O
小结:
化学电源
1、一次电池
2、二次电池
3、燃料电池
——锌锰干电池
——铅蓄电池
——氢氧燃料电池
掌握每一类典型
电池的正负极、
电极反应;了解
每一类电池的优
缺点;对其它电
池有初步的认识
减 少 污 染
节 约 资 源
