第四章生命之源---水复习与检测-2021-2022学年九年级化学科粤版(2012)上册(含解析)
文档属性
| 名称 | 第四章生命之源---水复习与检测-2021-2022学年九年级化学科粤版(2012)上册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 104.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-13 16:42:40 | ||
图片预览




文档简介
第四章生命之源---水复习与检测新学期同步练习基础过关九年级化学上册(科粤版2012)
练习
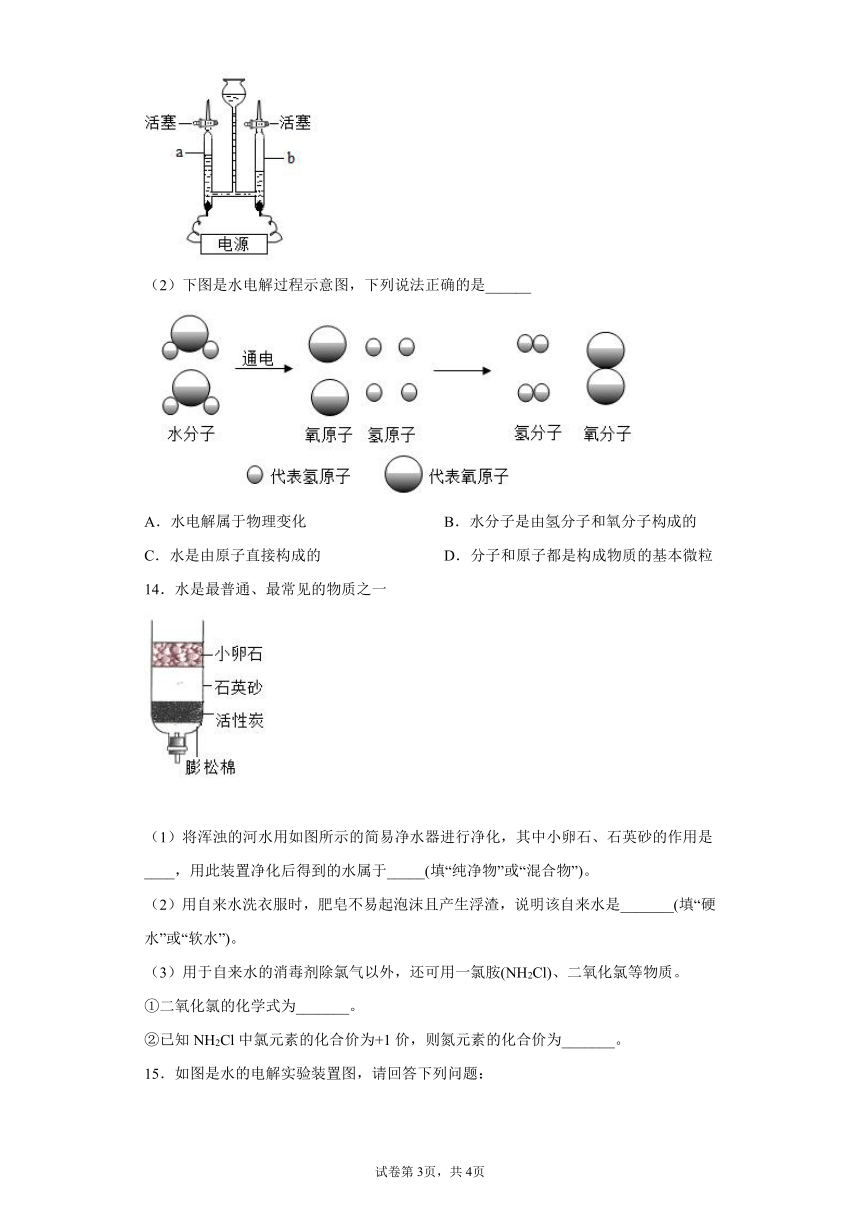
一、单选题,共11小题
1.生活中使用硬水有较大的危害,下列方法能使硬水软化的是
A.肥皂水 B.过滤 C.静置沉淀 D.煮沸
2.推动绿色发展,促进人与自然和谐共生。下列做法合理的是
A.城市生活污水与雨水管网分离 B.河南地区水资源充足,可以不用节约用水
C.农业种植禁止使用农药、化肥,防止水体污染 D.将化工厂废水送入自来水厂净化
3.下列实验中,仪器间不允许接触的是
A.将试剂瓶中的液体药品倒入试管 B.将试剂瓶中的液体倒入量筒中称取
C.用胶头滴管向试管内滴加试剂 D.过滤时滤液由漏斗流入接收的烧杯内
4.2021年世界水日的主题是“珍惜水、爱护水”,下列说法正确的是
A.为了节约用水,可以直接用工业废水灌溉农田
B.过滤和加热都可以使硬水软化
C.水中的色素和异味可用活性炭吸附
D.饮用水越纯越好,长期饮用有益于健康
5.净化水的操作有多种,综合运用这些操作净化效果更好。下面合理的先后顺序是
A.过滤、沉淀、蒸馏 B.沉淀、蒸馏、过滤
C.沉淀、过滤、蒸馏 D.蒸馏、过滤、沉淀
6.我国科学家研究出碳化钼(Mo2C)负载金原子组成的高效催化体系,使水煤气中的CO和H2O在120℃下发生反应,反应微观模型如图所示,下列说法不正确的是
A.金原子对CO分子起吸附催化作用 B.催化剂的性质在反应前后不变
C.化学反应的实质是原子重新组合 D.图中物质中共有两种金属元素
7.一定条件下,一定质量的化合物R和O2恰好完全反应,生成44gCO2和9gH2O,下列说法不正确的是
A.化合物R的相对分子质量可能为40 B.44gCO2中碳元素的质量为12g
C.化合物R中一定含有碳元素和氢元素 D.化合物R中碳、氢原子个数比一定为1:1
8.某化合物可发生如下反应:M + 3H22Fe + 3H2O,则该化合物的化学式为
A.FeO B.FeCO3 C.Fe2O3 D.Fe3O4
9.下列化学方程式书写正确的是
A. B.
C. D.
10.已知2A+3B=2C+3D,2.3gA和4.8gB恰好完全反应,生成4.4gC。又知D的相对分子质量为18,则A的相对分子质量为
A.23 B.46 C.92 D.96
11.在光照条件下,AgNO3可分解为Ag、O2和某种氮的氧化物X。取一定质量的AgNO3固体充分光照,测得生成Ag、O2、X的质量分别为21.6g、mg、9.2g。说法正确的是
A.m=1.6
B.X中含氧元素6.4g
C.AgNO3固体应密封保存在无色细口瓶中
D.生成物中Ag与O2的物质的量之比为3∶2
二、非选择题,共5小题
12.在生产生活中,你会发现“化学就在身边”。
(1)校园里,在远处就能闻到桂花的香味,说明分子______。
(2)超氧化钾(KO2)常备于急救器和消防队员背包中,能迅速与水反应放出氧气:,X的化学式为______。
13.水是生命之源,“珍惜水、节约水、保护水”是每个公民的义务和责任。
(1)如图为电解水的实验,此反应的文字表达式______;此反应属于______反应(填基本反应类型);a试管中收集到的气体为______(填化学符号),从能量转化角度分析,电解水是将______能转化为______能。
(2)下图是水电解过程示意图,下列说法正确的是______
A.水电解属于物理变化 B.水分子是由氢分子和氧分子构成的
C.水是由原子直接构成的 D.分子和原子都是构成物质的基本微粒
14.水是最普通、最常见的物质之一
(1)将浑浊的河水用如图所示的简易净水器进行净化,其中小卵石、石英砂的作用是____,用此装置净化后得到的水属于_____(填“纯净物”或“混合物”)。
(2)用自来水洗衣服时,肥皂不易起泡沫且产生浮渣,说明该自来水是_______(填“硬水”或“软水”)。
(3)用于自来水的消毒剂除氯气以外,还可用一氯胺(NH2Cl)、二氧化氯等物质。
①二氧化氯的化学式为_______。
②已知NH2Cl中氯元素的化合价为+1价,则氮元素的化合价为_______。
15.如图是水的电解实验装置图,请回答下列问题:
(1)检验b管内气体的方法是______。
(2)若a管收集到8mL气体,则在相同条件下b管应收集到的气体是______mL。
16.合理灭火与预防爆炸十分重要。
(1)火灾是燃烧最常见的危害。“火立熄”是一种新型的家用灭火用品,“火立想”接触到火焰3-5s后炸开,释放的粉未覆盖在燃烧物上,同时放出不可燃气体,使火焰熄灭。其灭火原理是________________。
(2)下列物质漂浮在空气中遇见明火不会发生爆炸的是 (填字母)。
A.天然气 B.氮气 C.酒精蒸汽 D.面粉或煤粉
(3)某化学反应的微观模拟示意图如图:
①图示的反应物为黑色固体和无色气体,写出该反应的符号表达式_________。
②图示的反应中没有发生改变的微粒符号有_____________。
③该反应的微观实质是_____________。
试卷第1页,共3页
试卷第1页,共3页
参考答案
1.D
【详解】
生活中常用煮沸的方法来降低水的硬度,煮沸可以将硬水中的钙镁离子转化为沉淀除去;
故选:D。
2.A
【详解】
A、城市生活污水与雨水管网分离,可以减少污染,保护水资源,符合题意;
B、地球上淡水资源有限,且分布不均,应节约用水,不符合题意;
C、农药、化肥对农业生产非常重要,不能禁止使用,应合理使用,不符合题意;
D、化工厂废水中含有一些有毒物质,不能送入自来水厂净化,否则会污染自来水,不符合题意。
故选A。
3.C
【详解】
A.在倾倒液体时,试管倾斜且试管口与试剂瓶口紧挨在一起,错误;
B.用量筒来量取液体时,试剂瓶口必须与量筒紧挨在一起,错误;
C.用胶头滴管向试管内滴加液体时,胶头滴管悬空放置,不能与试管相接触,以防污染滴管,正确;
D.过滤时滤液由漏斗流入接收的烧杯内,漏斗下端要与烧杯紧靠,防止液体溅出,错误。
故选C。
4.C
【详解】
A、工业废水中往往含有有害物质,未经处理不能直接灌溉农田,故A错误;
B、过滤只能除去水中的难溶性杂质,不能除去水中的可溶性杂质,即不能将硬水软化,故B错误;
C、活性炭具有吸附性,可以吸附水中的色素和异味,故C正确;
D、饮用水不单提供水,还要提供人体所需的矿物质元素,所以,饮用水并非越纯越好,故D错误。
故选C。
5.C
【详解】
净化水的操作中,沉淀只能除去颗粒和密度较大的固体杂质,过滤可以除去水中所有的固体杂质但不能除去水中的可溶性杂质,蒸馏可以除去水中所有的杂质得到纯水,因此为了使净化效果更好,合理的先后顺序是:沉淀、过滤、蒸馏。故选C。
6.B
【详解】
A、从图可以看出该反应中金原子对CO分子起吸附催化作用,选项正确;
B、催化剂在反应前后其质量与化学性质(不是性质)不发生改变,选项错误;
C、化学反应的实质是分子分裂为原子,原子重新组合,选项正确;
D、图中有金、钼两种金属元素,选项正确;
故选:B。
【点睛】
根据化学变化微观示意图及粒子构成模拟图,根据分子由原子构成等特点,正确判断变化中的物质构成与粒子个数关系,是解答本题的基本方法。
7.A
【详解】
A、根据质量守恒定律,化合物R一定含有碳元素和氢元素,可能含有氧元素。44g二氧化碳中的碳元素的质量为:,9g水中氢元素的质量是:,因此化合物中碳、氢元素的原子个数比为1:1,所以该物质化学式可表示为(CH)mOn,相对分子质量=13m+16n,无论m、n取何值时,R物质的相对分子质量不可能是40,说法错误,故A符合题意;
B、44g二氧化碳中的碳元素的质量为:,说法正确,故B不符合题意;
C、化学反应前后元素种类和原子个数均守恒,分析反应物和产物可知,化合物R中一定含有碳元素和氢元素,可能有氧元素,说法正确,故C不符合题意;
D、化合物中.碳氢元素质量比是12g:1g=12:1,因此个数比一定为1:1,说法正确,故D不符合题意。
故选A。
8.C
【详解】
根据题目中的化学方程式M + 3H22Fe + 3H2O,结合质量守恒定律,反应前后元素种类不变,原子个数相等。反应前:氢原子6个;反应后:氢原子6个,铁原子2个,氧原子3个,故化合物M中有2个铁原子,3个氧原子,其化学式为Fe2O3。
故选:C。
【点睛】
本题考察质量守恒定律及化学式的书写。
9.D
【分析】
根据化学方程式判断正误的方法需考虑:应用的原理是否正确;化学式书写是否正确;是否配平;反应条件是否正确;个和↓的标注是否正确。
【详解】
A、铁在氧气中燃烧生成四氧化三铁,正确的化学方程式为:,故选项错误;
B、该化学方程式碳酸钙的后面没有标注↓,正确的化学方程式应为CO2+Ca(OH)2=CaCO3↓+H2O,故选项错误;
C、该化学方程式氢气后面没有标注↑,正确的化学方程式应为:Fe+H2SO4=FeSO4+H2↑,故选项错误;
D、该化学方程式书写完全正确,故选项正确。
故选:D。
【点睛】
10.A
【分析】
根据质量守恒定律求算生成的D的质量,进而根据AD的质量以及D的相对分子质量和对应化学方程式求算A的相对分子质量。
【详解】
根据质量守恒定律可得,生成的D的质量为2. 3g+4. 8g-4. 4g=2. 7g
设A的相对分子质量为x
x=23
则A的相对分子质量为23
故选:A。
【点睛】
11.B
【详解】
A、根据质量守恒定律可知,反应前后元素的种类和质量不会发生改变,硝酸银分解之后银元素全部转移到单质银中,根据单质银的质量可求出反应的硝酸银的质量,生成氧气的质量为,所以m=3.2,故A选项错误;
B、根据质量守恒定律,化学反应前后元素质量不变,硝酸银中含有的氧元素质量等于氧气中氧元素与氮氧化物中氧元素质量之和,所以氮氧化物中所含氧元素质量为:,故B选项正确;
C、硝酸银固体在光照条件下易分解,应存放于棕色广口瓶中,故C选项错误;
D、根据反应的化学方程式可知,生成物中Ag与O2的物质的量之比等于其化学计量数之比,为2:1,故D选项错误。
故选B。
12.
(1)在不断运动
(2)H2O2
【分析】
(1)
因为分子在不断运动,所以在远处就能闻到桂花的香味。
(2)
依据质量守恒定律中原子个数守恒,反应前后氢原子少2个,氧原子少2个,可知物质X中有2个氢原子和2个氧原子,故X的化学式为:H2O2。
13.
(1) 水氢气+氧气 分解 O2 电 化学
(2)D
【解析】
(1)
水通电分解生成氢气和氧气,反应的文字表达式为水氢气+氧气,该反应符合“一变多”的特点,属于分解反应;电解水实验中“正氧负氢,氢二氧一”,a试管中收集到的气体较少,是氧气,从能量转化角度分析,电解水是将电能转化为化学能,故填:水氢气+氧气;分解;O2;电;化学;
(2)
A、水通电分解生成氢气和氧气,有新物质生成,属于化学变化,故A不符合题意;
B、由水分子的构成可知,水分子是由氧原子和氢原子构成的,故B选项不符合题意;
C、由微粒的构成可知,水是由水分子构成的,故C选项不符合题意;
D、分子和原子都是构成物质的微粒,故D选项符合题意。
故选D。
14.
(1) 过滤 混合物
(2)硬水
(3) ClO2 -3
【解析】
(1)
小卵石、石英砂能够将水中的难溶性杂质与水进行分离,起到过滤的作用,故填过滤;
通过简易净水器进行净化水,能够除去水中的难溶性杂质、色素和异味,但不能除去水中的可溶性杂质,所以通过简易净水器后的水中还含有可溶性杂质,属于混合物,故填混合物。
(2)
硬水遇到肥皂水产生浮渣,软水遇到肥皂水产生泡沫,用自来水洗衣服时,肥皂不易起泡沫且产生浮渣,说明该自来水是硬水,故填硬水。
(3)
①由物质的名称二氧化氯可知,该物质的1个分子由1个氯原子和2个氧原子构成,故二氧化氯的化学式写为ClO2;
②化合物中氢元素的化合价为+1价,氯元素的化合价为+1价,设氮元素的化合价为x,根据化合物中各元素的化合价的代数和为零,则x+(+1)×2+(+1)=0,x=-3,故填-3。
15.
(1)将带火星木条靠近玻璃管尖嘴处,打开活塞
(2)4
【分析】
(1)
与b电极相连的试管中产生的气体是氧气,可以用带火星的木条检验,木条复燃,证明是氧气;故填:将带火星木条靠近玻璃管尖嘴处,打开活塞。
(2)
生成氢气的体积是氧气体积的2倍,若收集到a气体8mL,则在相同条件下b管应收集到的气体是4ml,故填:4。
16.
(1)隔绝可燃物与空气(或氧气)接触
(2)B
(3)
C、H、O 水分子拆分成氢、氧原子,然后碳原子和氧原子结合生成一氧化碳分子,氢原子结合成氢气分子
【分析】
(1)
根据“释放的粉未覆盖在燃烧物上,同时放出不可燃气体,使火焰熄灭。”可知,灭火原理是隔绝可燃物与空气接触。
(2)
可燃性物质与空气混合遇见明火可能发生爆炸。B氮气不可燃,所以遇见明火不会发生爆炸。
(3)
①从微观示意图可知,该反应是水与碳在高温下生成一氧化碳和氢气,符号表达式是。
②反应前后原子的种类和数目不变,所以没有发生改变的微粒符号有C、H、O。
③化学反应的实质是分子拆分成原子,原子组合成新的分子。该反应的实质是水分子拆分成氢、氧原子,然后碳原子和氧原子结合生成一氧化碳分子,氢原子结合成氢气分子。
【点睛】
答案第1页,共2页
答案第1页,共2页
练习
一、单选题,共11小题
1.生活中使用硬水有较大的危害,下列方法能使硬水软化的是
A.肥皂水 B.过滤 C.静置沉淀 D.煮沸
2.推动绿色发展,促进人与自然和谐共生。下列做法合理的是
A.城市生活污水与雨水管网分离 B.河南地区水资源充足,可以不用节约用水
C.农业种植禁止使用农药、化肥,防止水体污染 D.将化工厂废水送入自来水厂净化
3.下列实验中,仪器间不允许接触的是
A.将试剂瓶中的液体药品倒入试管 B.将试剂瓶中的液体倒入量筒中称取
C.用胶头滴管向试管内滴加试剂 D.过滤时滤液由漏斗流入接收的烧杯内
4.2021年世界水日的主题是“珍惜水、爱护水”,下列说法正确的是
A.为了节约用水,可以直接用工业废水灌溉农田
B.过滤和加热都可以使硬水软化
C.水中的色素和异味可用活性炭吸附
D.饮用水越纯越好,长期饮用有益于健康
5.净化水的操作有多种,综合运用这些操作净化效果更好。下面合理的先后顺序是
A.过滤、沉淀、蒸馏 B.沉淀、蒸馏、过滤
C.沉淀、过滤、蒸馏 D.蒸馏、过滤、沉淀
6.我国科学家研究出碳化钼(Mo2C)负载金原子组成的高效催化体系,使水煤气中的CO和H2O在120℃下发生反应,反应微观模型如图所示,下列说法不正确的是
A.金原子对CO分子起吸附催化作用 B.催化剂的性质在反应前后不变
C.化学反应的实质是原子重新组合 D.图中物质中共有两种金属元素
7.一定条件下,一定质量的化合物R和O2恰好完全反应,生成44gCO2和9gH2O,下列说法不正确的是
A.化合物R的相对分子质量可能为40 B.44gCO2中碳元素的质量为12g
C.化合物R中一定含有碳元素和氢元素 D.化合物R中碳、氢原子个数比一定为1:1
8.某化合物可发生如下反应:M + 3H22Fe + 3H2O,则该化合物的化学式为
A.FeO B.FeCO3 C.Fe2O3 D.Fe3O4
9.下列化学方程式书写正确的是
A. B.
C. D.
10.已知2A+3B=2C+3D,2.3gA和4.8gB恰好完全反应,生成4.4gC。又知D的相对分子质量为18,则A的相对分子质量为
A.23 B.46 C.92 D.96
11.在光照条件下,AgNO3可分解为Ag、O2和某种氮的氧化物X。取一定质量的AgNO3固体充分光照,测得生成Ag、O2、X的质量分别为21.6g、mg、9.2g。说法正确的是
A.m=1.6
B.X中含氧元素6.4g
C.AgNO3固体应密封保存在无色细口瓶中
D.生成物中Ag与O2的物质的量之比为3∶2
二、非选择题,共5小题
12.在生产生活中,你会发现“化学就在身边”。
(1)校园里,在远处就能闻到桂花的香味,说明分子______。
(2)超氧化钾(KO2)常备于急救器和消防队员背包中,能迅速与水反应放出氧气:,X的化学式为______。
13.水是生命之源,“珍惜水、节约水、保护水”是每个公民的义务和责任。
(1)如图为电解水的实验,此反应的文字表达式______;此反应属于______反应(填基本反应类型);a试管中收集到的气体为______(填化学符号),从能量转化角度分析,电解水是将______能转化为______能。
(2)下图是水电解过程示意图,下列说法正确的是______
A.水电解属于物理变化 B.水分子是由氢分子和氧分子构成的
C.水是由原子直接构成的 D.分子和原子都是构成物质的基本微粒
14.水是最普通、最常见的物质之一
(1)将浑浊的河水用如图所示的简易净水器进行净化,其中小卵石、石英砂的作用是____,用此装置净化后得到的水属于_____(填“纯净物”或“混合物”)。
(2)用自来水洗衣服时,肥皂不易起泡沫且产生浮渣,说明该自来水是_______(填“硬水”或“软水”)。
(3)用于自来水的消毒剂除氯气以外,还可用一氯胺(NH2Cl)、二氧化氯等物质。
①二氧化氯的化学式为_______。
②已知NH2Cl中氯元素的化合价为+1价,则氮元素的化合价为_______。
15.如图是水的电解实验装置图,请回答下列问题:
(1)检验b管内气体的方法是______。
(2)若a管收集到8mL气体,则在相同条件下b管应收集到的气体是______mL。
16.合理灭火与预防爆炸十分重要。
(1)火灾是燃烧最常见的危害。“火立熄”是一种新型的家用灭火用品,“火立想”接触到火焰3-5s后炸开,释放的粉未覆盖在燃烧物上,同时放出不可燃气体,使火焰熄灭。其灭火原理是________________。
(2)下列物质漂浮在空气中遇见明火不会发生爆炸的是 (填字母)。
A.天然气 B.氮气 C.酒精蒸汽 D.面粉或煤粉
(3)某化学反应的微观模拟示意图如图:
①图示的反应物为黑色固体和无色气体,写出该反应的符号表达式_________。
②图示的反应中没有发生改变的微粒符号有_____________。
③该反应的微观实质是_____________。
试卷第1页,共3页
试卷第1页,共3页
参考答案
1.D
【详解】
生活中常用煮沸的方法来降低水的硬度,煮沸可以将硬水中的钙镁离子转化为沉淀除去;
故选:D。
2.A
【详解】
A、城市生活污水与雨水管网分离,可以减少污染,保护水资源,符合题意;
B、地球上淡水资源有限,且分布不均,应节约用水,不符合题意;
C、农药、化肥对农业生产非常重要,不能禁止使用,应合理使用,不符合题意;
D、化工厂废水中含有一些有毒物质,不能送入自来水厂净化,否则会污染自来水,不符合题意。
故选A。
3.C
【详解】
A.在倾倒液体时,试管倾斜且试管口与试剂瓶口紧挨在一起,错误;
B.用量筒来量取液体时,试剂瓶口必须与量筒紧挨在一起,错误;
C.用胶头滴管向试管内滴加液体时,胶头滴管悬空放置,不能与试管相接触,以防污染滴管,正确;
D.过滤时滤液由漏斗流入接收的烧杯内,漏斗下端要与烧杯紧靠,防止液体溅出,错误。
故选C。
4.C
【详解】
A、工业废水中往往含有有害物质,未经处理不能直接灌溉农田,故A错误;
B、过滤只能除去水中的难溶性杂质,不能除去水中的可溶性杂质,即不能将硬水软化,故B错误;
C、活性炭具有吸附性,可以吸附水中的色素和异味,故C正确;
D、饮用水不单提供水,还要提供人体所需的矿物质元素,所以,饮用水并非越纯越好,故D错误。
故选C。
5.C
【详解】
净化水的操作中,沉淀只能除去颗粒和密度较大的固体杂质,过滤可以除去水中所有的固体杂质但不能除去水中的可溶性杂质,蒸馏可以除去水中所有的杂质得到纯水,因此为了使净化效果更好,合理的先后顺序是:沉淀、过滤、蒸馏。故选C。
6.B
【详解】
A、从图可以看出该反应中金原子对CO分子起吸附催化作用,选项正确;
B、催化剂在反应前后其质量与化学性质(不是性质)不发生改变,选项错误;
C、化学反应的实质是分子分裂为原子,原子重新组合,选项正确;
D、图中有金、钼两种金属元素,选项正确;
故选:B。
【点睛】
根据化学变化微观示意图及粒子构成模拟图,根据分子由原子构成等特点,正确判断变化中的物质构成与粒子个数关系,是解答本题的基本方法。
7.A
【详解】
A、根据质量守恒定律,化合物R一定含有碳元素和氢元素,可能含有氧元素。44g二氧化碳中的碳元素的质量为:,9g水中氢元素的质量是:,因此化合物中碳、氢元素的原子个数比为1:1,所以该物质化学式可表示为(CH)mOn,相对分子质量=13m+16n,无论m、n取何值时,R物质的相对分子质量不可能是40,说法错误,故A符合题意;
B、44g二氧化碳中的碳元素的质量为:,说法正确,故B不符合题意;
C、化学反应前后元素种类和原子个数均守恒,分析反应物和产物可知,化合物R中一定含有碳元素和氢元素,可能有氧元素,说法正确,故C不符合题意;
D、化合物中.碳氢元素质量比是12g:1g=12:1,因此个数比一定为1:1,说法正确,故D不符合题意。
故选A。
8.C
【详解】
根据题目中的化学方程式M + 3H22Fe + 3H2O,结合质量守恒定律,反应前后元素种类不变,原子个数相等。反应前:氢原子6个;反应后:氢原子6个,铁原子2个,氧原子3个,故化合物M中有2个铁原子,3个氧原子,其化学式为Fe2O3。
故选:C。
【点睛】
本题考察质量守恒定律及化学式的书写。
9.D
【分析】
根据化学方程式判断正误的方法需考虑:应用的原理是否正确;化学式书写是否正确;是否配平;反应条件是否正确;个和↓的标注是否正确。
【详解】
A、铁在氧气中燃烧生成四氧化三铁,正确的化学方程式为:,故选项错误;
B、该化学方程式碳酸钙的后面没有标注↓,正确的化学方程式应为CO2+Ca(OH)2=CaCO3↓+H2O,故选项错误;
C、该化学方程式氢气后面没有标注↑,正确的化学方程式应为:Fe+H2SO4=FeSO4+H2↑,故选项错误;
D、该化学方程式书写完全正确,故选项正确。
故选:D。
【点睛】
10.A
【分析】
根据质量守恒定律求算生成的D的质量,进而根据AD的质量以及D的相对分子质量和对应化学方程式求算A的相对分子质量。
【详解】
根据质量守恒定律可得,生成的D的质量为2. 3g+4. 8g-4. 4g=2. 7g
设A的相对分子质量为x
x=23
则A的相对分子质量为23
故选:A。
【点睛】
11.B
【详解】
A、根据质量守恒定律可知,反应前后元素的种类和质量不会发生改变,硝酸银分解之后银元素全部转移到单质银中,根据单质银的质量可求出反应的硝酸银的质量,生成氧气的质量为,所以m=3.2,故A选项错误;
B、根据质量守恒定律,化学反应前后元素质量不变,硝酸银中含有的氧元素质量等于氧气中氧元素与氮氧化物中氧元素质量之和,所以氮氧化物中所含氧元素质量为:,故B选项正确;
C、硝酸银固体在光照条件下易分解,应存放于棕色广口瓶中,故C选项错误;
D、根据反应的化学方程式可知,生成物中Ag与O2的物质的量之比等于其化学计量数之比,为2:1,故D选项错误。
故选B。
12.
(1)在不断运动
(2)H2O2
【分析】
(1)
因为分子在不断运动,所以在远处就能闻到桂花的香味。
(2)
依据质量守恒定律中原子个数守恒,反应前后氢原子少2个,氧原子少2个,可知物质X中有2个氢原子和2个氧原子,故X的化学式为:H2O2。
13.
(1) 水氢气+氧气 分解 O2 电 化学
(2)D
【解析】
(1)
水通电分解生成氢气和氧气,反应的文字表达式为水氢气+氧气,该反应符合“一变多”的特点,属于分解反应;电解水实验中“正氧负氢,氢二氧一”,a试管中收集到的气体较少,是氧气,从能量转化角度分析,电解水是将电能转化为化学能,故填:水氢气+氧气;分解;O2;电;化学;
(2)
A、水通电分解生成氢气和氧气,有新物质生成,属于化学变化,故A不符合题意;
B、由水分子的构成可知,水分子是由氧原子和氢原子构成的,故B选项不符合题意;
C、由微粒的构成可知,水是由水分子构成的,故C选项不符合题意;
D、分子和原子都是构成物质的微粒,故D选项符合题意。
故选D。
14.
(1) 过滤 混合物
(2)硬水
(3) ClO2 -3
【解析】
(1)
小卵石、石英砂能够将水中的难溶性杂质与水进行分离,起到过滤的作用,故填过滤;
通过简易净水器进行净化水,能够除去水中的难溶性杂质、色素和异味,但不能除去水中的可溶性杂质,所以通过简易净水器后的水中还含有可溶性杂质,属于混合物,故填混合物。
(2)
硬水遇到肥皂水产生浮渣,软水遇到肥皂水产生泡沫,用自来水洗衣服时,肥皂不易起泡沫且产生浮渣,说明该自来水是硬水,故填硬水。
(3)
①由物质的名称二氧化氯可知,该物质的1个分子由1个氯原子和2个氧原子构成,故二氧化氯的化学式写为ClO2;
②化合物中氢元素的化合价为+1价,氯元素的化合价为+1价,设氮元素的化合价为x,根据化合物中各元素的化合价的代数和为零,则x+(+1)×2+(+1)=0,x=-3,故填-3。
15.
(1)将带火星木条靠近玻璃管尖嘴处,打开活塞
(2)4
【分析】
(1)
与b电极相连的试管中产生的气体是氧气,可以用带火星的木条检验,木条复燃,证明是氧气;故填:将带火星木条靠近玻璃管尖嘴处,打开活塞。
(2)
生成氢气的体积是氧气体积的2倍,若收集到a气体8mL,则在相同条件下b管应收集到的气体是4ml,故填:4。
16.
(1)隔绝可燃物与空气(或氧气)接触
(2)B
(3)
C、H、O 水分子拆分成氢、氧原子,然后碳原子和氧原子结合生成一氧化碳分子,氢原子结合成氢气分子
【分析】
(1)
根据“释放的粉未覆盖在燃烧物上,同时放出不可燃气体,使火焰熄灭。”可知,灭火原理是隔绝可燃物与空气接触。
(2)
可燃性物质与空气混合遇见明火可能发生爆炸。B氮气不可燃,所以遇见明火不会发生爆炸。
(3)
①从微观示意图可知,该反应是水与碳在高温下生成一氧化碳和氢气,符号表达式是。
②反应前后原子的种类和数目不变,所以没有发生改变的微粒符号有C、H、O。
③化学反应的实质是分子拆分成原子,原子组合成新的分子。该反应的实质是水分子拆分成氢、氧原子,然后碳原子和氧原子结合生成一氧化碳分子,氢原子结合成氢气分子。
【点睛】
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第一章 大家都来学化学
- 1.1 身边的化学
- 1.2 化学实验室之旅
- 1.3 物质的变化
- 1.4 物质性质的探究
- 第二章 空气、物质的构成
- 2.1 空气的成分
- 2.2 构成物质的微粒(Ⅰ)——分子
- 2.3 构成物质的微粒(Ⅱ)——原子和离子
- 2.4 辨别物质的元素组成
- 第三章 维持生命之气——氧气
- 3.1 氧气的性质和用途
- 3.2 制取氧气
- 3.3 燃烧条件与灭火原理
- 3.4 物质构成的表示式
- 第四章 生命之源——水
- 4.1 我们的水资源
- 4.2 水的组成
- 4.3 质量守恒定律
- 4.4 化学方程式
- 第五章 燃料
- 5.1 洁净的燃料——氢气
- 5.2 组成燃料的主要元素——碳
- 5.3 二氧化碳的性质和制法
- 5.4 古生物的“遗产”——化石燃料
