人教版(五四制)八年级全一册化学 第六单元 课题1 金刚石、石墨和C60 第二课时(教案)
文档属性
| 名称 | 人教版(五四制)八年级全一册化学 第六单元 课题1 金刚石、石墨和C60 第二课时(教案) |
|
|
| 格式 | docx | ||
| 文件大小 | 20.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-14 08:16:53 | ||
图片预览

文档简介
第六单元 课题1 金刚石、石墨和C60
三维教学目标
知识与技能
(1)掌握碳单质的化学性质
(2)了解金刚石、石墨在生活和生产中的多种用途
过程与方法
(1)能用发展的观点认识碳单质的化学性质
(2)初步学会运用比较、归纳等方法,总结归纳碳的化学性质
3、情感态度与价值观
知道量变引起质变的哲学思想,初步了解事物的多面性
教学重点与难点
重点:碳单质的化学性质
难点:探究碳跟某些氧化物的反应,认识还原剂、氧化剂
教学过程:
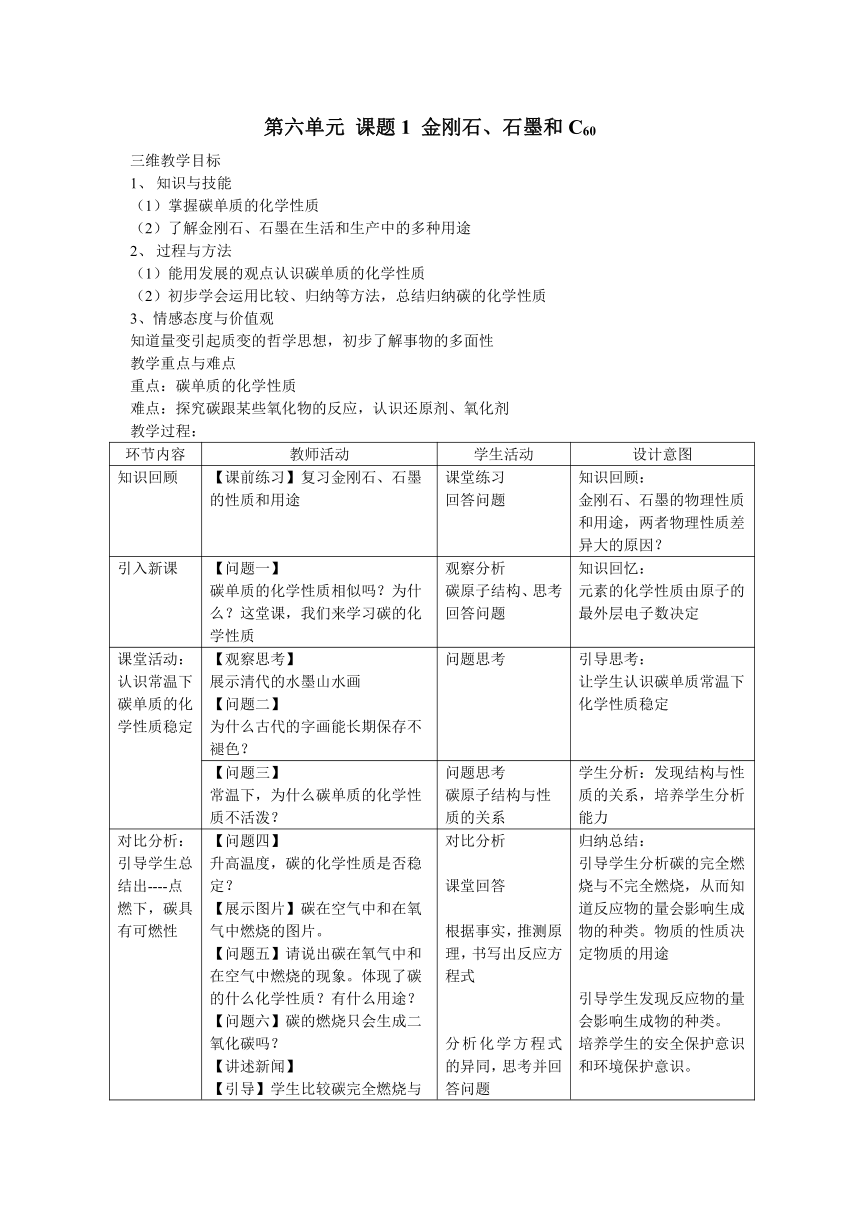
环节内容 教师活动 学生活动 设计意图
知识回顾 【课前练习】复习金刚石、石墨的性质和用途 课堂练习 回答问题 知识回顾: 金刚石、石墨的物理性质和用途,两者物理性质差异大的原因?
引入新课 【问题一】 碳单质的化学性质相似吗?为什么?这堂课,我们来学习碳的化学性质 观察分析 碳原子结构、思考回答问题 知识回忆: 元素的化学性质由原子的最外层电子数决定
课堂活动:认识常温下碳单质的化学性质稳定 【观察思考】 展示清代的水墨山水画 【问题二】 为什么古代的字画能长期保存不褪色? 问题思考 引导思考: 让学生认识碳单质常温下化学性质稳定
【问题三】 常温下,为什么碳单质的化学性质不活泼? 问题思考 碳原子结构与性质的关系 学生分析:发现结构与性质的关系,培养学生分析能力
对比分析:引导学生总结出----点燃下,碳具有可燃性 【问题四】 升高温度,碳的化学性质是否稳定? 【展示图片】碳在空气中和在氧气中燃烧的图片。 【问题五】请说出碳在氧气中和在空气中燃烧的现象。体现了碳的什么化学性质?有什么用途? 【问题六】碳的燃烧只会生成二氧化碳吗? 【讲述新闻】 【引导】学生比较碳完全燃烧与不完全燃烧的反应方程式。 【问题七】两个反应有什么相同点? 对比分析 课堂回答 根据事实,推测原理,书写出反应方程式 分析化学方程式的异同,思考并回答问题 归纳总结: 引导学生分析碳的完全燃烧与不完全燃烧,从而知道反应物的量会影响生成物的种类。物质的性质决定物质的用途 引导学生发现反应物的量会影响生成物的种类。 培养学生的安全保护意识和环境保护意识。 对比分析: 引导学生通过实验现象,认识碳与氧气反应。
活动探究: 验证高温下碳粉与氧化铜反应现象 【问题八】 碳能与氧气反应,夺取氧气的氧元素,那碳粉能否与氧化铜反应,夺取氧元素吗? 【问题九】 如果能反应,生成物是什么,怎样设计实验证明? 观察分析 观察实验现象 提问回答问题 课堂阅读 P110实验6-2,认识实验关键 学生猜想: 引导通过分析,让学生参与设计实验验证
【演示装置】 展示实验药品,组装实验装置 【视频演示】 碳还原氧化铜 引导学生观察实验现象,写出反应方程式 【问题十】根据实验中的操作,回答问题: ⑴酒精灯加网罩的目的是什么? ⑵实验结束时要先将导管从试管中撤出,然后熄灭酒精灯,为什么? ⑶为什么要待试管冷却后才把粉末倒在纸上? ⑷实验中石灰水的作用是什么? 课堂分析 观察碳粉,CuO粉末颜色,观察实验装置,实验现象,描述并记录实验现象。 写出反应方程式 小组讨论 指导学生思考回答问题 课堂练习: 引导学生根据现象写出反应方程式 指导学生规范实验操作,培养学生实验能力
【归纳总结】 在此反应中,碳夺取了氧元素,具有还原性,在反应中作还原剂。氧化铜失去了氧元素,发生了还原反应。 碳高温下,碳有还原性 【问题十一】碳的还原性,在生产中的用途。 【练习】写出焦炭还原氧化铁的反应方程式 【归纳】 碳+金属氧化物--金属+二氧化碳 思考分析 阅读课本找出答案 书写反应方程式 总结规律: 引导学生了解还原性,还原反应 引导学生利用碳的还原性写出反应方程式,并总结规律
【讲述】高温下,碳还可以夺取二氧化碳中的氧元素,生成一氧化碳 加深学生对还原性的认识
课堂小结 拓展训练 【小结】这堂课,我们学习了碳那些化学性质? 【课堂检测】完成4道练习题 1、齐白石最大尺幅黑白作品《松柏高立图.篆书四言联》,于2011年5月22日以4.255亿人民币拍出,其画用墨汁的主要成分为炭黑,它能使画很长时间不褪色,这是因为墨汁中的炭黑具有( ) A、可燃性 B、还原性 C、稳定性 D、吸附性 2、影响碳的化学性质的主要原因是( ) A、空气 B、水 C、日光 D、温度 3、下列各种碳单质的用途中,利用其化学性质的是( ) A、石墨用作电极 B、焦炭用于把氧化铁炼成铁 C、活性炭用于滤毒面具 D、炭黑用于制造墨汁和油墨 4、下列关于碳的化学性质的叙述中,错误的是( ) A、碳的化学性质很活泼 B、碳与O2反应可生成CO2也可以生成CO C、炽热的碳能与CO2反应化合生成CO,这个反应体现了C具有还原性 D、碳在空气中燃烧时放出热量,是一个重要的燃料 小结归纳,学习总结 独立完成,举手回答 通过完成练习,进一步巩固碳的三点化学性质 限时训练: 帮助学生反馈知识,提高学生应用知识解决问题的能力
课后作业 《同步解析》P60---63 第二课时部分
板书设计 课题1 金刚石、石墨和C60 二、碳的化学性质 1、常温下-----稳定性——认识生产、生活中的实例 2、点燃-----可燃性------作燃料 (
点燃
) (
点燃
) O2充足:C+O2====CO2 O2不足:2C+O2 ==== 2CO 高温下------还原性-----作还原剂 (
高温
) C+2CuO ==== 2Cu+CO2 现象:黑色固体变红,澄清石灰水变浑浊 (
得到
O
) C CO2 碳夺取了氧元素,碳具有还原性,碳作还原剂 碳+金属氧化物—--金属+二氧化碳 (
高温
) C+CO2 ===== 2CO
三维教学目标
知识与技能
(1)掌握碳单质的化学性质
(2)了解金刚石、石墨在生活和生产中的多种用途
过程与方法
(1)能用发展的观点认识碳单质的化学性质
(2)初步学会运用比较、归纳等方法,总结归纳碳的化学性质
3、情感态度与价值观
知道量变引起质变的哲学思想,初步了解事物的多面性
教学重点与难点
重点:碳单质的化学性质
难点:探究碳跟某些氧化物的反应,认识还原剂、氧化剂
教学过程:
环节内容 教师活动 学生活动 设计意图
知识回顾 【课前练习】复习金刚石、石墨的性质和用途 课堂练习 回答问题 知识回顾: 金刚石、石墨的物理性质和用途,两者物理性质差异大的原因?
引入新课 【问题一】 碳单质的化学性质相似吗?为什么?这堂课,我们来学习碳的化学性质 观察分析 碳原子结构、思考回答问题 知识回忆: 元素的化学性质由原子的最外层电子数决定
课堂活动:认识常温下碳单质的化学性质稳定 【观察思考】 展示清代的水墨山水画 【问题二】 为什么古代的字画能长期保存不褪色? 问题思考 引导思考: 让学生认识碳单质常温下化学性质稳定
【问题三】 常温下,为什么碳单质的化学性质不活泼? 问题思考 碳原子结构与性质的关系 学生分析:发现结构与性质的关系,培养学生分析能力
对比分析:引导学生总结出----点燃下,碳具有可燃性 【问题四】 升高温度,碳的化学性质是否稳定? 【展示图片】碳在空气中和在氧气中燃烧的图片。 【问题五】请说出碳在氧气中和在空气中燃烧的现象。体现了碳的什么化学性质?有什么用途? 【问题六】碳的燃烧只会生成二氧化碳吗? 【讲述新闻】 【引导】学生比较碳完全燃烧与不完全燃烧的反应方程式。 【问题七】两个反应有什么相同点? 对比分析 课堂回答 根据事实,推测原理,书写出反应方程式 分析化学方程式的异同,思考并回答问题 归纳总结: 引导学生分析碳的完全燃烧与不完全燃烧,从而知道反应物的量会影响生成物的种类。物质的性质决定物质的用途 引导学生发现反应物的量会影响生成物的种类。 培养学生的安全保护意识和环境保护意识。 对比分析: 引导学生通过实验现象,认识碳与氧气反应。
活动探究: 验证高温下碳粉与氧化铜反应现象 【问题八】 碳能与氧气反应,夺取氧气的氧元素,那碳粉能否与氧化铜反应,夺取氧元素吗? 【问题九】 如果能反应,生成物是什么,怎样设计实验证明? 观察分析 观察实验现象 提问回答问题 课堂阅读 P110实验6-2,认识实验关键 学生猜想: 引导通过分析,让学生参与设计实验验证
【演示装置】 展示实验药品,组装实验装置 【视频演示】 碳还原氧化铜 引导学生观察实验现象,写出反应方程式 【问题十】根据实验中的操作,回答问题: ⑴酒精灯加网罩的目的是什么? ⑵实验结束时要先将导管从试管中撤出,然后熄灭酒精灯,为什么? ⑶为什么要待试管冷却后才把粉末倒在纸上? ⑷实验中石灰水的作用是什么? 课堂分析 观察碳粉,CuO粉末颜色,观察实验装置,实验现象,描述并记录实验现象。 写出反应方程式 小组讨论 指导学生思考回答问题 课堂练习: 引导学生根据现象写出反应方程式 指导学生规范实验操作,培养学生实验能力
【归纳总结】 在此反应中,碳夺取了氧元素,具有还原性,在反应中作还原剂。氧化铜失去了氧元素,发生了还原反应。 碳高温下,碳有还原性 【问题十一】碳的还原性,在生产中的用途。 【练习】写出焦炭还原氧化铁的反应方程式 【归纳】 碳+金属氧化物--金属+二氧化碳 思考分析 阅读课本找出答案 书写反应方程式 总结规律: 引导学生了解还原性,还原反应 引导学生利用碳的还原性写出反应方程式,并总结规律
【讲述】高温下,碳还可以夺取二氧化碳中的氧元素,生成一氧化碳 加深学生对还原性的认识
课堂小结 拓展训练 【小结】这堂课,我们学习了碳那些化学性质? 【课堂检测】完成4道练习题 1、齐白石最大尺幅黑白作品《松柏高立图.篆书四言联》,于2011年5月22日以4.255亿人民币拍出,其画用墨汁的主要成分为炭黑,它能使画很长时间不褪色,这是因为墨汁中的炭黑具有( ) A、可燃性 B、还原性 C、稳定性 D、吸附性 2、影响碳的化学性质的主要原因是( ) A、空气 B、水 C、日光 D、温度 3、下列各种碳单质的用途中,利用其化学性质的是( ) A、石墨用作电极 B、焦炭用于把氧化铁炼成铁 C、活性炭用于滤毒面具 D、炭黑用于制造墨汁和油墨 4、下列关于碳的化学性质的叙述中,错误的是( ) A、碳的化学性质很活泼 B、碳与O2反应可生成CO2也可以生成CO C、炽热的碳能与CO2反应化合生成CO,这个反应体现了C具有还原性 D、碳在空气中燃烧时放出热量,是一个重要的燃料 小结归纳,学习总结 独立完成,举手回答 通过完成练习,进一步巩固碳的三点化学性质 限时训练: 帮助学生反馈知识,提高学生应用知识解决问题的能力
课后作业 《同步解析》P60---63 第二课时部分
板书设计 课题1 金刚石、石墨和C60 二、碳的化学性质 1、常温下-----稳定性——认识生产、生活中的实例 2、点燃-----可燃性------作燃料 (
点燃
) (
点燃
) O2充足:C+O2====CO2 O2不足:2C+O2 ==== 2CO 高温下------还原性-----作还原剂 (
高温
) C+2CuO ==== 2Cu+CO2 现象:黑色固体变红,澄清石灰水变浑浊 (
得到
O
) C CO2 碳夺取了氧元素,碳具有还原性,碳作还原剂 碳+金属氧化物—--金属+二氧化碳 (
高温
) C+CO2 ===== 2CO
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
