物质的量在化学实验中的应用
文档属性
| 名称 | 物质的量在化学实验中的应用 |  | |
| 格式 | zip | ||
| 文件大小 | 552.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-22 20:29:57 | ||
图片预览





文档简介
(共15张PPT)
第3课时
物质的量在化学实验中的应用
1.了解物质的量浓度的含义。
2.掌握配制一定物质的量浓度溶液的方法。
3.掌握容量瓶的使用。
第一章 从实验学化学
第二节
化学计量在实验中的应用
复习导入
1、什么是溶液中溶质的质量分数?
ω= ×100%
溶质质量
溶液质量
物质的量 n
溶液体积 V
2、如何配制100g质量分数为5%的NaCl溶液?
用量筒量取95mL水,在烧杯中溶解。
计算溶质的质量和溶剂的质量,
用天平称量5gNaCl,
水是称取质量方便还是量取体积方便?
=
物质的量浓度cB
物质的量浓度
定义:以单位体积溶液里所含溶质B的物质的量来表示溶液的组成的物理量,叫做溶质B的物质的量浓度。
单位:mol/L
理解:在1L溶液中含有1mol的溶质,这种溶液中溶质的物质的量浓度就是1mol/L。
表达式:cB=
nB
V(aq)
1、配制500mL0.1mol/LNaOH溶液需要NaOH的质量是多少?
∵n(NaOH)=c(NaOH) ×V[NaOH(aq)]
=0.1mol/L×0.5L=0.05mol
∴m(NaOH)=n(NaOH) ×M(NaOH)
=0.05mol×40g/mol=2g
练习:
÷NA
m n N
÷M
×M
×NA
质量
粒子数目
V(气体体积)
÷Vm
×Vm
cB(溶液)
×V(aq)
÷V(aq)
小结:
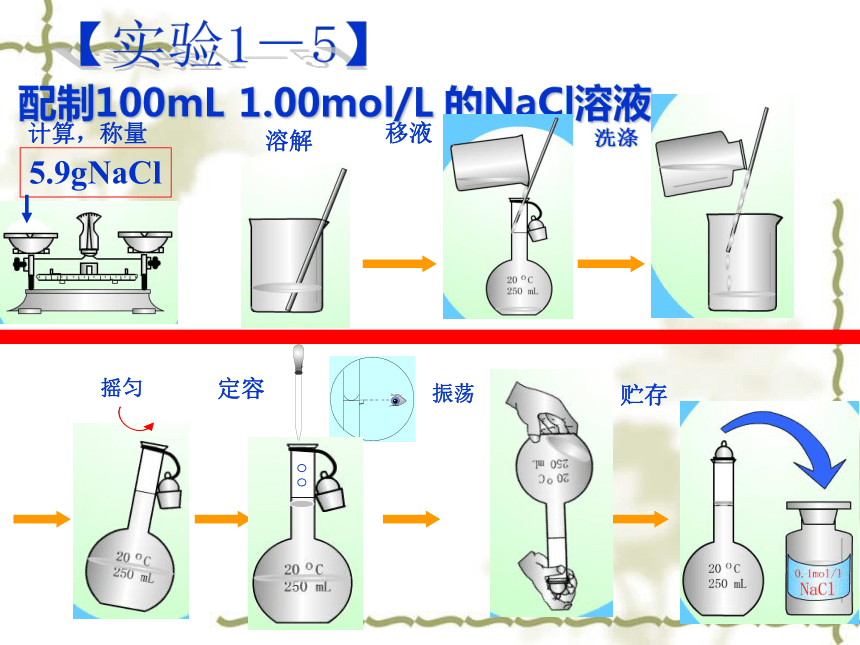
配制100mL 1.00mol/L 的NaCl溶液
5.9gNaCl
计算,称量
溶解
移液
摇匀
洗涤
定容
振荡
贮存
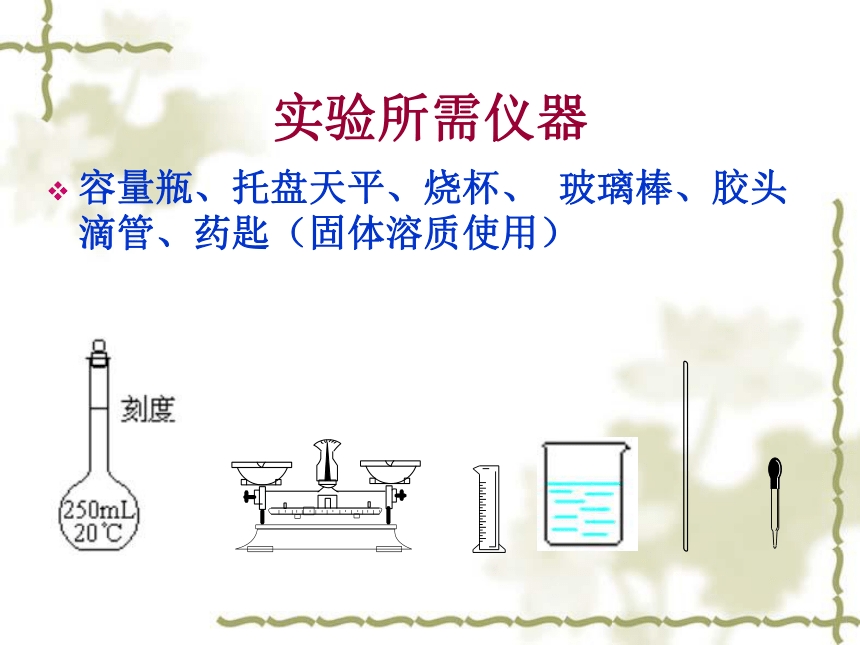
实验所需仪器
容量瓶、托盘天平、烧杯、 玻璃棒、胶头滴管、药匙(固体溶质使用)
误差分析及讨论
1、下列操作对实验结果有何影响(偏高、偏低、无影响)?
称量时,NaOH固体与砝码的位置颠倒。
天平的砝码生锈。
溶质溶解后没有恢复至室温就转移。
(1) 误差分析的依据
C=
n
v
=
m
Mv
物质的量浓度的大小取决于m和v
偏低
偏高
偏高
容量瓶内壁有水珠。
转移溶液时有部分液体溅出。
未用蒸馏水洗涤烧杯内壁。
定容摇匀后,发现液面低于刻度线,又加水至刻度线
偏低
偏低
无影响
偏低
2、视线误差分析
俯视(视线偏高)
仰视(视线偏低)
小结:容量瓶的使用注意事项
不能用容量瓶进行溶解(体积不准确)
不能直接往容量瓶倒液(洒到外面)
加水不能超过刻度线(浓度偏低)
读数应平视,不能仰视或俯视(仰视浓度偏低,俯视浓度偏高)
要洗涤玻璃棒和烧杯,并将洗涤液加入到容量瓶中
标准液存放于容量瓶(容量瓶是量器,不是容器)
思考
1、配制250ml 1.0mol/L H2SO4溶液,需要18mol/L H2SO4溶液的体积是多少。
c(浓溶液)×V(浓溶液)=c(稀溶液) ×V(稀溶液)
18 mol/L ×V(浓溶液) = 1 mol/L × 250mL
V(浓溶液) =14 mL
稀释公式
配制过程中物质的量保持不变
如何用CuSO4·5H2O配制100mL1mol/LCuSO4溶液。
作业
容量瓶简介:
①容量瓶
②使用之前要检查是否漏水.
如何检漏
加水
倒立
观察
瓶塞旋转180o
倒立
观察
形状:细颈,梨形,平底的玻璃瓶;
构造:瓶上标有容积,温度,颈部标有刻度线;
规格:100mL,250mL,500mL,1000mL;
③不能在其中溶解(有吸热或放热现象),不能将热的溶
液倒入,会影响体积的准确。
返回
第3课时
物质的量在化学实验中的应用
1.了解物质的量浓度的含义。
2.掌握配制一定物质的量浓度溶液的方法。
3.掌握容量瓶的使用。
第一章 从实验学化学
第二节
化学计量在实验中的应用
复习导入
1、什么是溶液中溶质的质量分数?
ω= ×100%
溶质质量
溶液质量
物质的量 n
溶液体积 V
2、如何配制100g质量分数为5%的NaCl溶液?
用量筒量取95mL水,在烧杯中溶解。
计算溶质的质量和溶剂的质量,
用天平称量5gNaCl,
水是称取质量方便还是量取体积方便?
=
物质的量浓度cB
物质的量浓度
定义:以单位体积溶液里所含溶质B的物质的量来表示溶液的组成的物理量,叫做溶质B的物质的量浓度。
单位:mol/L
理解:在1L溶液中含有1mol的溶质,这种溶液中溶质的物质的量浓度就是1mol/L。
表达式:cB=
nB
V(aq)
1、配制500mL0.1mol/LNaOH溶液需要NaOH的质量是多少?
∵n(NaOH)=c(NaOH) ×V[NaOH(aq)]
=0.1mol/L×0.5L=0.05mol
∴m(NaOH)=n(NaOH) ×M(NaOH)
=0.05mol×40g/mol=2g
练习:
÷NA
m n N
÷M
×M
×NA
质量
粒子数目
V(气体体积)
÷Vm
×Vm
cB(溶液)
×V(aq)
÷V(aq)
小结:
配制100mL 1.00mol/L 的NaCl溶液
5.9gNaCl
计算,称量
溶解
移液
摇匀
洗涤
定容
振荡
贮存
实验所需仪器
容量瓶、托盘天平、烧杯、 玻璃棒、胶头滴管、药匙(固体溶质使用)
误差分析及讨论
1、下列操作对实验结果有何影响(偏高、偏低、无影响)?
称量时,NaOH固体与砝码的位置颠倒。
天平的砝码生锈。
溶质溶解后没有恢复至室温就转移。
(1) 误差分析的依据
C=
n
v
=
m
Mv
物质的量浓度的大小取决于m和v
偏低
偏高
偏高
容量瓶内壁有水珠。
转移溶液时有部分液体溅出。
未用蒸馏水洗涤烧杯内壁。
定容摇匀后,发现液面低于刻度线,又加水至刻度线
偏低
偏低
无影响
偏低
2、视线误差分析
俯视(视线偏高)
仰视(视线偏低)
小结:容量瓶的使用注意事项
不能用容量瓶进行溶解(体积不准确)
不能直接往容量瓶倒液(洒到外面)
加水不能超过刻度线(浓度偏低)
读数应平视,不能仰视或俯视(仰视浓度偏低,俯视浓度偏高)
要洗涤玻璃棒和烧杯,并将洗涤液加入到容量瓶中
标准液存放于容量瓶(容量瓶是量器,不是容器)
思考
1、配制250ml 1.0mol/L H2SO4溶液,需要18mol/L H2SO4溶液的体积是多少。
c(浓溶液)×V(浓溶液)=c(稀溶液) ×V(稀溶液)
18 mol/L ×V(浓溶液) = 1 mol/L × 250mL
V(浓溶液) =14 mL
稀释公式
配制过程中物质的量保持不变
如何用CuSO4·5H2O配制100mL1mol/LCuSO4溶液。
作业
容量瓶简介:
①容量瓶
②使用之前要检查是否漏水.
如何检漏
加水
倒立
观察
瓶塞旋转180o
倒立
观察
形状:细颈,梨形,平底的玻璃瓶;
构造:瓶上标有容积,温度,颈部标有刻度线;
规格:100mL,250mL,500mL,1000mL;
③不能在其中溶解(有吸热或放热现象),不能将热的溶
液倒入,会影响体积的准确。
返回
