2021-2022学年上学期高一化学人教版(2019)必修第一册第二章第三节物质的量 课件(38张ppt)
文档属性
| 名称 | 2021-2022学年上学期高一化学人教版(2019)必修第一册第二章第三节物质的量 课件(38张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 65.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-15 00:00:00 | ||
图片预览








文档简介
(共38张PPT)
物质的量
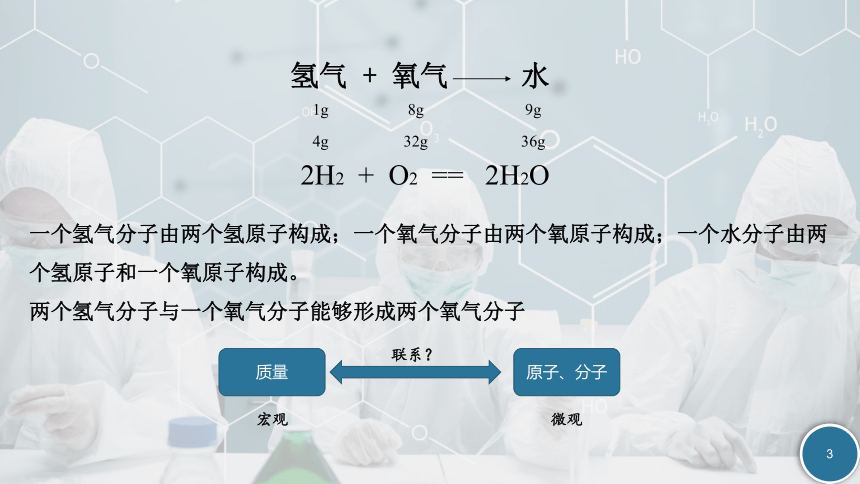
氢气 + 氧气 水
氢气 + 氧气 水
1g
8g
9g
2H2 + O2 == 2H2O
4g
32g
36g
一个氢气分子由两个氢原子构成;一个氧气分子由两个氧原子构成;一个水分子由两个氢原子和一个氧原子构成。
两个氢气分子与一个氧气分子能够形成两个氧气分子
质量
原子、分子
联系?
微观
宏观
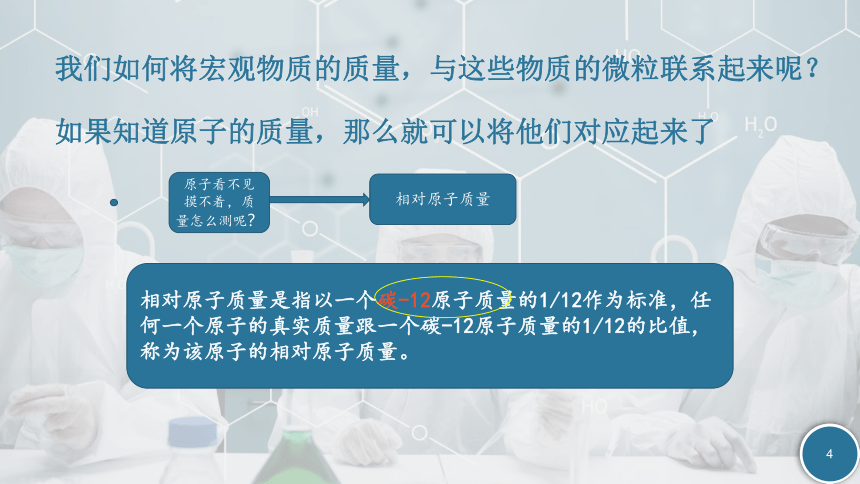
我们如何将宏观物质的质量,与这些物质的微粒联系起来呢?
如果知道原子的质量,那么就可以将他们对应起来了
原子看不见摸不着,质量怎么测呢?
相对原子质量
相对原子质量是指以一个碳-12原子质量的1/12作为标准,任何一个原子的真实质量跟一个碳-12原子质量的1/12的比值,称为该原子的相对原子质量。
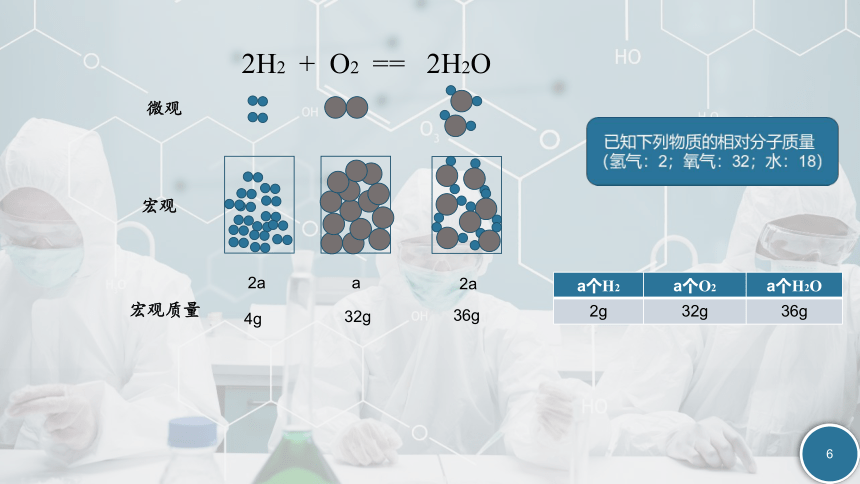
2H2 + O2 == 2H2O
微观
宏观
宏观质量
4g
32g
36g
2a
a
2a
a个H2 a个O2 a个H2O
2g 32g 36g
经过我们的推导和计算,我们发现这样质量比例下的氢气、氧气、水含有相同数目的分子
氢气 氧气 水
2g 32g 18g
这样的质量在数值上恰好和相对分子质量相等
在数值上与相对分子质量相等的质量的物质的分子数相等。
宏观与微观结合起来
已知下列物质的相对分子质量(氢气:2;氧气:32;水:18)
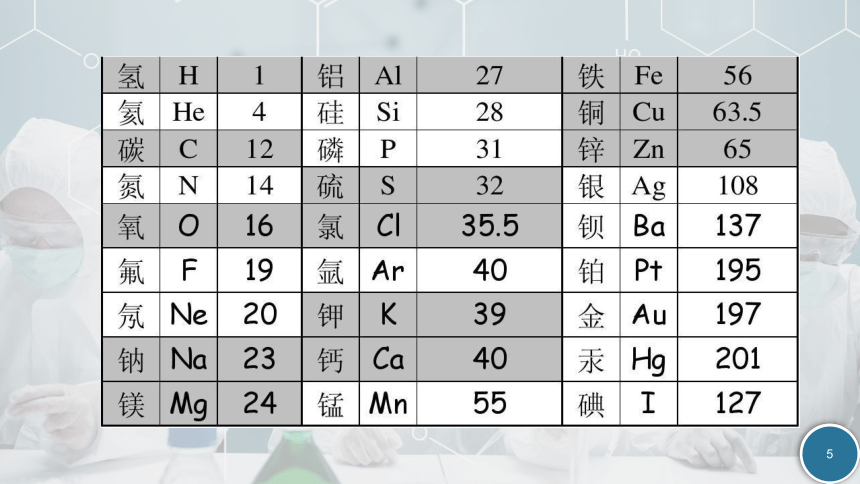
已知下列物质的相对原子质量或相对分子质量
铁:56;水:18;氧气:32;臭氧:48;钠:23,我们能够得出什么。
1908年法国物理学家佩兰这样质量下的分子数约为6.85×1023,实验相对误差只有3%,他将此常数命名为阿伏伽德罗常数
后续多位科学家进行了进准的测量,测量结果约为6.02×1023个
一、物质的量
用n表示,表示含有一定数目粒子的集合体
单位为摩尔、简称摩,符号用mol表示
国际上规定,1mol的物质所含微粒约为6.02×1023个
6.02×1023个微粒数目也被人们称为阿伏伽德罗常数,用符号NA表示
单位为mol-1或/mol
如果一个物质的粒子数为N,那么它的物质的量应该是多少呢?
已知9g水中,所含的水分子数目约为3.01×1023个,那么9g水的物质的量多少?
我们知道1mol物质所含粒子数目为6.02×1023个,而这些粒子组成的物质的质量在数值上等于其相对原子/分子质量。
1molFe是56克
1mol水是18克
1mol氧气是32克
单位物质的量所具有的的质量叫做摩尔质量,符号为M。
单位为g/mol
已知某物质的质量为m,摩尔质量为M,求该物质的物质的量。
已知下列物质的相对原子质量或相对分子质量
铁:56;水:18;
铁的摩尔质量:56g/mol,水的摩尔质量18g/mol
49克的硫酸物质的量为多少?
已知:硫酸的相对分子质量为98
作业:资源与评价物质的量第一课时
微粒的质量在数值上恰好等于相对分子质量或原子质量
微观
宏观
n
原子、分子与宏观物质的质量建立了紧密的联系
物体的体积V
对于物体而言,我们经常使用体积来描述物质的多少
二、气体摩尔体积
V与什么有关?
在微观上
微粒大小、微粒的多少、微粒之间的距离
二、气体摩尔体积
固体、液体:粒子之间的距离小,微粒数目以及大小决定了它们的体积
气体:粒子间的距离很大,微粒大小可以被忽略(质点),粒子间的距离和数目决定了体积
二、气体摩尔体积
气体:粒子间的距离和数目决定了体积
压强、温度
二、气体摩尔体积
温度和压强固定,气体物质的体积只与微粒的数目有关
如果微粒的数目定了,在温度和压强不变的情况下,物质的体积也就定了
1mol气态物质,也就是6.02×1023个气体分子的体积是固定不变的
二、气体摩尔体积
我们把单位物质的量的气体所占有的体积叫做气体摩尔体积,符号为Vm,常用单位为L/mol
某气体在一定温度和压强下体积为V,已知该温度和压强下,气体的摩尔体积为Vm,求该物质的物质的量。
二、气体摩尔体积
Vm的数值取决于温度和压强,一般在0℃和101kPa(标准状况)下,气体摩尔体积约为22.4L/mol;在25℃和10kPa下,气体摩尔体积为22.5L/mol。
22.4L氮气中一定含有2mol氮原子。( )
18g水在标况下的体积为22.4L。( )
×
×
在标准状况下,20ml氨气和20ml氧气所含的分子数相同。( )
如果微粒的数目定了,在温度和压强不变的情况下,气体物质的体积也就定了
同温同压下,相同体积的不同气体含有相同数目的分子。
这条定律也被称为阿伏伽德罗定律。
√
二、物质的量浓度
在科学实验中,我们经常会使用的溶液,那如何来描述溶液的浓度呢?
质量分数:溶质的质量/溶液的质量
二、物质的量浓度
如果知道一定体积溶液中溶质的物质的量,就特别方便了
1.物质的量浓度
单位体积的溶液里所含溶质B的物质的量,也称B的物质的量浓度,符号为cB
单位为mol/L
二、物质的量浓度
2.物质的量浓度与质量分数之间的换算
已知某V升溶液中溶质的质量分数为溶质的B的摩尔质量为单位为g/mol,溶液的密度为单位为g/ml,求该溶液的物质的量浓度cB
溶液的质量m总
=
二、物质的量浓度
溶液的质量m总
=
溶质的质量m质=
溶质的物质的量n= =
物质的量浓度cB=
二、物质的量浓度
已知市面上售出的浓硫酸质量分数为98%,密度为1.84g/ml,计算该硫酸的物质的量浓度
二、物质的量浓度
3.溶液的稀释
溶液稀释时,体积增加了,但是溶质的物质的量没有变化。
稀释定律
C(浓溶液)·V(浓溶液)= C(稀溶液)·V(稀溶液)
三、物质的量浓度
4.一定物质的量浓度溶液的配制
小明在做实验时需要65ml的1.00mol/L的氯化钠溶液,那如何配制所需要的溶液呢。
认识容量瓶
活塞
刻度线
温度、规格
50ml、100ml、250ml、500ml、1000ml
磨口玻璃塞
认识容量瓶
1.容量瓶的瓶塞必须用细绳系在瓶口,防止丢失和损坏
2.在使用前,必须检漏。将加入水的容量瓶倒置180°,看是否漏液。
3.容量瓶使用后应洗净,晾干,瓶塞和瓶口处垫一张纸,以免粘连。
二、物质的量浓度
配制100ml 1.00mol/L的氯化钠溶液
1.计算 计算需要氯化钠固体质量为
2.称量 根据计算结果,称量固体
3.溶解 将称好的固体氯化钠放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使其完全溶解。
4.移液 将烧杯中的溶液沿玻璃棒注入100ml容量瓶中(玻璃棒应低于容量瓶刻度线)
二、物质的量浓度
配制100ml 1.00mol/L的氯化钠溶液
5.洗涤 用少量蒸馏水洗涤烧杯内壁和玻璃棒两到三次,将洗涤液也注入容量瓶中。轻轻摇动,时溶液混合均匀。
6.定容 将蒸馏水沿玻璃棒注入容量瓶,当液面距离刻度线1-2cm时,改用胶头滴管滴加蒸馏水至与凹液面的相切。盖好瓶塞,反复上下颠倒,摇匀。
7.装瓶 转移至试剂瓶中,并贴好标签。
物质的量
氢气 + 氧气 水
氢气 + 氧气 水
1g
8g
9g
2H2 + O2 == 2H2O
4g
32g
36g
一个氢气分子由两个氢原子构成;一个氧气分子由两个氧原子构成;一个水分子由两个氢原子和一个氧原子构成。
两个氢气分子与一个氧气分子能够形成两个氧气分子
质量
原子、分子
联系?
微观
宏观
我们如何将宏观物质的质量,与这些物质的微粒联系起来呢?
如果知道原子的质量,那么就可以将他们对应起来了
原子看不见摸不着,质量怎么测呢?
相对原子质量
相对原子质量是指以一个碳-12原子质量的1/12作为标准,任何一个原子的真实质量跟一个碳-12原子质量的1/12的比值,称为该原子的相对原子质量。
2H2 + O2 == 2H2O
微观
宏观
宏观质量
4g
32g
36g
2a
a
2a
a个H2 a个O2 a个H2O
2g 32g 36g
经过我们的推导和计算,我们发现这样质量比例下的氢气、氧气、水含有相同数目的分子
氢气 氧气 水
2g 32g 18g
这样的质量在数值上恰好和相对分子质量相等
在数值上与相对分子质量相等的质量的物质的分子数相等。
宏观与微观结合起来
已知下列物质的相对分子质量(氢气:2;氧气:32;水:18)
已知下列物质的相对原子质量或相对分子质量
铁:56;水:18;氧气:32;臭氧:48;钠:23,我们能够得出什么。
1908年法国物理学家佩兰这样质量下的分子数约为6.85×1023,实验相对误差只有3%,他将此常数命名为阿伏伽德罗常数
后续多位科学家进行了进准的测量,测量结果约为6.02×1023个
一、物质的量
用n表示,表示含有一定数目粒子的集合体
单位为摩尔、简称摩,符号用mol表示
国际上规定,1mol的物质所含微粒约为6.02×1023个
6.02×1023个微粒数目也被人们称为阿伏伽德罗常数,用符号NA表示
单位为mol-1或/mol
如果一个物质的粒子数为N,那么它的物质的量应该是多少呢?
已知9g水中,所含的水分子数目约为3.01×1023个,那么9g水的物质的量多少?
我们知道1mol物质所含粒子数目为6.02×1023个,而这些粒子组成的物质的质量在数值上等于其相对原子/分子质量。
1molFe是56克
1mol水是18克
1mol氧气是32克
单位物质的量所具有的的质量叫做摩尔质量,符号为M。
单位为g/mol
已知某物质的质量为m,摩尔质量为M,求该物质的物质的量。
已知下列物质的相对原子质量或相对分子质量
铁:56;水:18;
铁的摩尔质量:56g/mol,水的摩尔质量18g/mol
49克的硫酸物质的量为多少?
已知:硫酸的相对分子质量为98
作业:资源与评价物质的量第一课时
微粒的质量在数值上恰好等于相对分子质量或原子质量
微观
宏观
n
原子、分子与宏观物质的质量建立了紧密的联系
物体的体积V
对于物体而言,我们经常使用体积来描述物质的多少
二、气体摩尔体积
V与什么有关?
在微观上
微粒大小、微粒的多少、微粒之间的距离
二、气体摩尔体积
固体、液体:粒子之间的距离小,微粒数目以及大小决定了它们的体积
气体:粒子间的距离很大,微粒大小可以被忽略(质点),粒子间的距离和数目决定了体积
二、气体摩尔体积
气体:粒子间的距离和数目决定了体积
压强、温度
二、气体摩尔体积
温度和压强固定,气体物质的体积只与微粒的数目有关
如果微粒的数目定了,在温度和压强不变的情况下,物质的体积也就定了
1mol气态物质,也就是6.02×1023个气体分子的体积是固定不变的
二、气体摩尔体积
我们把单位物质的量的气体所占有的体积叫做气体摩尔体积,符号为Vm,常用单位为L/mol
某气体在一定温度和压强下体积为V,已知该温度和压强下,气体的摩尔体积为Vm,求该物质的物质的量。
二、气体摩尔体积
Vm的数值取决于温度和压强,一般在0℃和101kPa(标准状况)下,气体摩尔体积约为22.4L/mol;在25℃和10kPa下,气体摩尔体积为22.5L/mol。
22.4L氮气中一定含有2mol氮原子。( )
18g水在标况下的体积为22.4L。( )
×
×
在标准状况下,20ml氨气和20ml氧气所含的分子数相同。( )
如果微粒的数目定了,在温度和压强不变的情况下,气体物质的体积也就定了
同温同压下,相同体积的不同气体含有相同数目的分子。
这条定律也被称为阿伏伽德罗定律。
√
二、物质的量浓度
在科学实验中,我们经常会使用的溶液,那如何来描述溶液的浓度呢?
质量分数:溶质的质量/溶液的质量
二、物质的量浓度
如果知道一定体积溶液中溶质的物质的量,就特别方便了
1.物质的量浓度
单位体积的溶液里所含溶质B的物质的量,也称B的物质的量浓度,符号为cB
单位为mol/L
二、物质的量浓度
2.物质的量浓度与质量分数之间的换算
已知某V升溶液中溶质的质量分数为溶质的B的摩尔质量为单位为g/mol,溶液的密度为单位为g/ml,求该溶液的物质的量浓度cB
溶液的质量m总
=
二、物质的量浓度
溶液的质量m总
=
溶质的质量m质=
溶质的物质的量n= =
物质的量浓度cB=
二、物质的量浓度
已知市面上售出的浓硫酸质量分数为98%,密度为1.84g/ml,计算该硫酸的物质的量浓度
二、物质的量浓度
3.溶液的稀释
溶液稀释时,体积增加了,但是溶质的物质的量没有变化。
稀释定律
C(浓溶液)·V(浓溶液)= C(稀溶液)·V(稀溶液)
三、物质的量浓度
4.一定物质的量浓度溶液的配制
小明在做实验时需要65ml的1.00mol/L的氯化钠溶液,那如何配制所需要的溶液呢。
认识容量瓶
活塞
刻度线
温度、规格
50ml、100ml、250ml、500ml、1000ml
磨口玻璃塞
认识容量瓶
1.容量瓶的瓶塞必须用细绳系在瓶口,防止丢失和损坏
2.在使用前,必须检漏。将加入水的容量瓶倒置180°,看是否漏液。
3.容量瓶使用后应洗净,晾干,瓶塞和瓶口处垫一张纸,以免粘连。
二、物质的量浓度
配制100ml 1.00mol/L的氯化钠溶液
1.计算 计算需要氯化钠固体质量为
2.称量 根据计算结果,称量固体
3.溶解 将称好的固体氯化钠放入烧杯中,加入适量蒸馏水,用玻璃棒搅拌,使其完全溶解。
4.移液 将烧杯中的溶液沿玻璃棒注入100ml容量瓶中(玻璃棒应低于容量瓶刻度线)
二、物质的量浓度
配制100ml 1.00mol/L的氯化钠溶液
5.洗涤 用少量蒸馏水洗涤烧杯内壁和玻璃棒两到三次,将洗涤液也注入容量瓶中。轻轻摇动,时溶液混合均匀。
6.定容 将蒸馏水沿玻璃棒注入容量瓶,当液面距离刻度线1-2cm时,改用胶头滴管滴加蒸馏水至与凹液面的相切。盖好瓶塞,反复上下颠倒,摇匀。
7.装瓶 转移至试剂瓶中,并贴好标签。
