人教版(五四制)八年级全一册化学 第四单元 自然界的水 复习 课件 (共41张PPT)
文档属性
| 名称 | 人教版(五四制)八年级全一册化学 第四单元 自然界的水 复习 课件 (共41张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-15 14:21:01 | ||
图片预览








文档简介
(共41张PPT)
第四单元 自然界的水
复习课件
1.水是无色无味、没有味道的液体,在一个标准大气压下,沸点是100℃,凝固点是0℃,水在4℃的密度为1g/cm3,能溶解多种物质形成溶液。
一、水的组成
2.电解水实验
实验 现象 表达式
电解水 电极上有气泡,正负极气体体积比为1:2。负极气体可燃烧,正极气体使燃着的木条燃得更旺。 水 氢气+氧气
H2O H2 O2
电解水是在直流电的作用下,在负极产生氢气,正极产生氧气。在这个反应中,水分子分解成氢原子和氧原子,这两种原子分别两两构成氢分子、氧分子,很多氢分子,氧分子聚集成氢气、氧气。
氢气燃烧生成水、水电解生成氢气和氧气,都说明水是由氢、氧两种元素组成的化合物。从微观分析,水是由水分子构成的,每个水分子是由2个氢原子和1个氧原子构成的,因此水可以表示为H2O。
水的组成和空气的组成在描述上的区别:
①空气是由氮气、氧气、二氧化碳、稀有气体及杂质组成,水由氢元素和氧元素组成。②描述空气的组成时用的是物质,而描述水的组成时用的是元素。③空气是混合物,含有多种物质,因此用物质描述组成,而水是纯净物,是化合物,由两种元素组成,因此用元素描述组成。
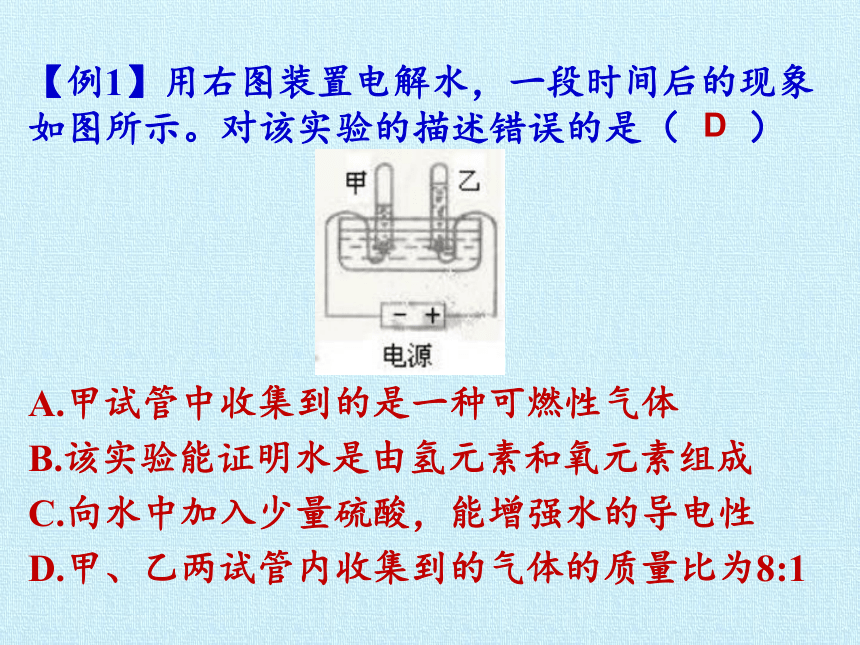
【例1】用右图装置电解水,一段时间后的现象如图所示。对该实验的描述错误的是( )
A.甲试管中收集到的是一种可燃性气体
B.该实验能证明水是由氢元素和氧元素组成
C.向水中加入少量硫酸,能增强水的导电性
D.甲、乙两试管内收集到的气体的质量比为8:1
D
【练习1】电解a克水,在阴极产生2.24mL气体,则在阳极上产生气体的体积为( )
A.4.48mL B.2.24mL C.1.12mL D.无法确定
【练习2】下列变化是化学变化的是( )
A.水结冰 B.电解水 C.水汽化 D.制蒸馏水
C
B
【例2】关于水的组成,下列说法正确的是( )
A.水是由氢气和氧气组成的
B.水中含有氢(H)、氧(O)两种元素
C.水是由氢分子和氧原子组成的
D.水是由两个氢原子和一个氧原子构成的
B
二、氢气
1.物理性质:无色无味的气体,难溶于水,密度比空气小,是相同条件下密度最小的气体。
2.化学性质——可燃性。
在空气(或氧气)中燃烧时放出大量的热,火焰呈淡蓝色,唯一的生成物是水。
3.氢气的验纯
原因:氢气与空气(或氧气)的混合气体遇明火可能发生爆炸,因此点燃氢气前,一定要先验纯。
验纯的方法:收集一试管的氢气,用拇指堵住试管口,试管口向下移进酒精灯火焰,松开拇指点火,若发出尖锐的爆鸣声表明氢气不纯;声音很小则表示氢气较纯。
【练习3】某同学在检验氢气纯度时,收集一试管氢气后,没有用拇指堵住试管口,而且试管口向上移近酒精灯火焰点火,结果没有听到声音,他认为氢气纯净了,你认为他的操作是 的(填“正确”或“错误”),原因是点火前氢气已经 到空气中去了。正确的方法是:收集一试管氢气后,用拇指 试管口,而且试管口向 移近酒精灯火焰点火。
【例3】下列混合气体遇明火可能发生爆炸的是( )
A.氢气和氧气 B.氮气和氧气
C.二氧化碳和空气 D.氢气和氮气
A
逸散
错误
下
堵住
三、水的净化
1.自来水厂的净化过程
(1)吸附沉淀(加入絮凝剂吸附杂质,如明矾溶于水后产生的胶状物吸附悬浮于水中的杂质,将小颗粒凝聚成大颗粒,使之沉降)和静置沉淀;
(2)过滤;
(3)活性炭吸附(具有较强的吸附能力,可以吸附一些可溶性杂质和色素,也可以除臭味)
(4)消毒。
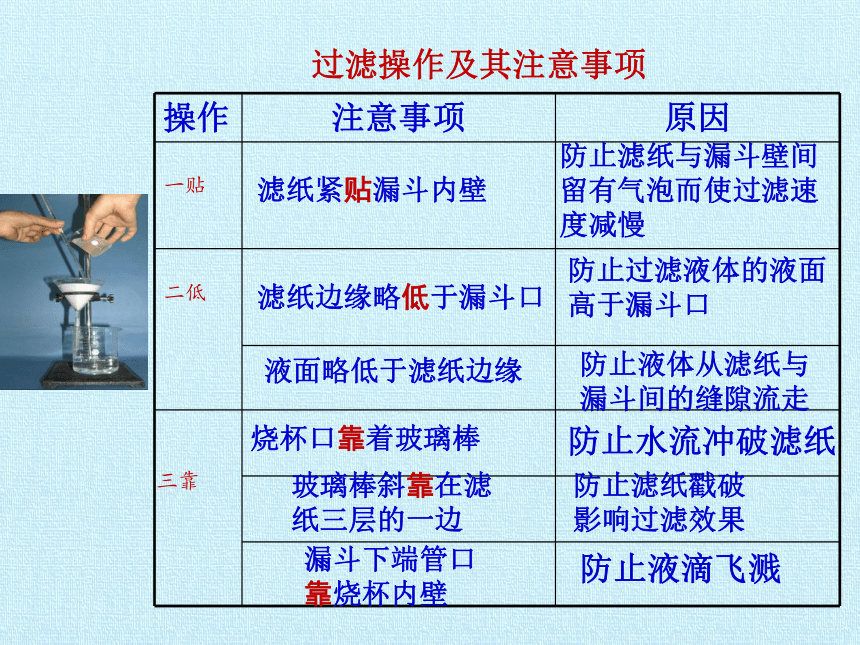
操作 注意事项 原因
防止滤纸与漏斗壁间留有气泡而使过滤速度减慢
防止过滤液体的液面高于漏斗口
防止液体从滤纸与漏斗间的缝隙流走
防止水流冲破滤纸
防止滤纸戳破影响过滤效果
防止液滴飞溅
滤纸紧贴漏斗内壁
一贴
滤纸边缘略低于漏斗口
液面略低于滤纸边缘
二低
烧杯口靠着玻璃棒
玻璃棒斜靠在滤纸三层的一边
漏斗下端管口靠烧杯内壁
三靠
过滤操作及其注意事项
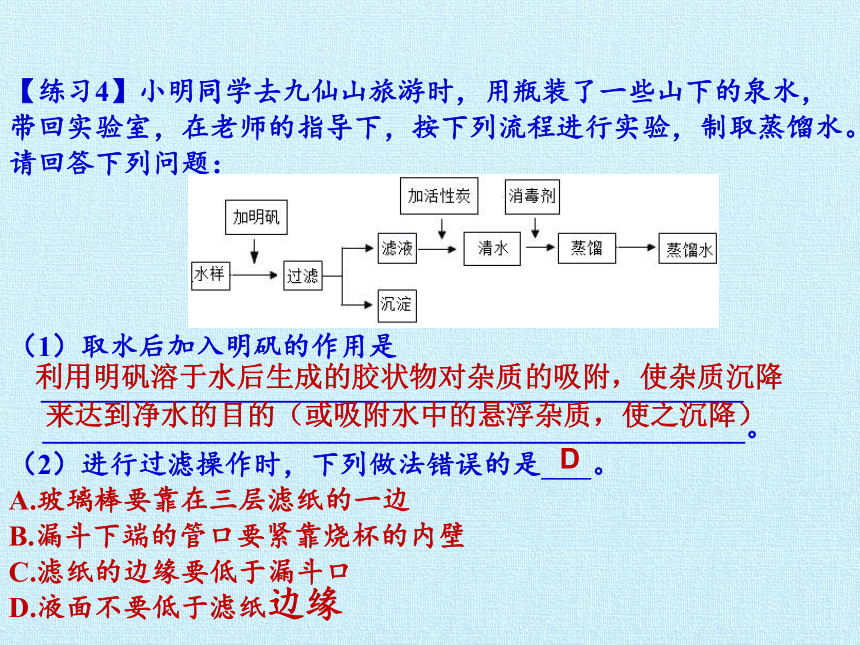
【练习4】小明同学去九仙山旅游时,用瓶装了一些山下的泉水,带回实验室,在老师的指导下,按下列流程进行实验,制取蒸馏水。请回答下列问题:
(1)取水后加入明矾的作用是_________________________________________________
_________________________________________________。
(2)进行过滤操作时,下列做法错误的是 。
A.玻璃棒要靠在三层滤纸的一边
B.漏斗下端的管口要紧靠烧杯的内壁
C.滤纸的边缘要低于漏斗口
D.液面不要低于滤纸边缘
来达到净水的目的(或吸附水中的悬浮杂质,使之沉降)
利用明矾溶于水后生成的胶状物对杂质的吸附,使杂质沉降
D
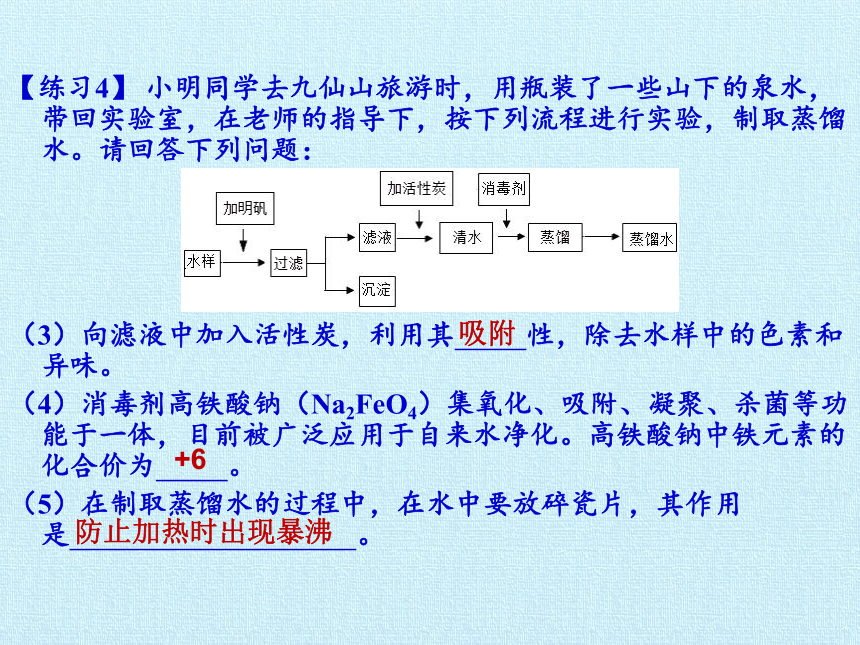
【练习4】 小明同学去九仙山旅游时,用瓶装了一些山下的泉水,带回实验室,在老师的指导下,按下列流程进行实验,制取蒸馏水。请回答下列问题:
(3)向滤液中加入活性炭,利用其 性,除去水样中的色素和异味。
(4)消毒剂高铁酸钠(Na2FeO4)集氧化、吸附、凝聚、杀菌等功能于一体,目前被广泛应用于自来水净化。高铁酸钠中铁元素的化合价为 。
(5)在制取蒸馏水的过程中,在水中要放碎瓷片,其作用是 。
吸附
+6
防止加热时出现暴沸
3.硬水和软水
(1)概念:含有较多可溶性钙和镁化合物的水叫硬水;不含或含较少可溶性钙和镁化合物的水叫软水。
(2)检验:把等量的肥皂水分别滴加到盛有等量硬水和软水的试管中,产生很多泡沫的是软水,产生很多浮渣的是硬水。
(3)硬水的软化方法:煮沸或蒸馏。
【练习5】从广告语:“农夫山泉有点甜”,可以说明“农夫山泉”饮用水是________(填“纯净物”或“混合物”)
混合物
【例4】要从氯酸钾和二氧化锰混合物加热制取氧气后的残留固体中回收二氧化锰,有以下几步操作可供选择,其中正确的操作顺序是(相关资料:氯化钾、氯酸钾易溶于水,二氧化锰难溶于水)( )
①蒸发溶液 ②过滤 ③溶解 ④水洗
⑤烘干
A.②①④⑤ B.③②⑤④
C.③②④⑤ D.④③②⑤
C
四、爱护水资源
1.人类拥有的水资源:总水量很大,但淡水资源极其有限。
2.我国的水资源:我国是世界上13个最缺水的国家之一。
3.爱护水资源
(1)节约用水:节约用水的途径:①使用新技术。 ②改革工艺。③改变习惯可以减少大量工农业和生活用水。
(2)防止水体污染
水体污染危害:影响工农业、渔业生产,破坏水生生态系统,危害人体健康。
水体污染来源:工业污染、农业污染、生活污染。
预防和治理水污染的措施:①工业上,通过应用新技术、新工艺减少污染物的产生,对污染的水体作处理使之符合排放标准。②农业上提倡使用农家肥,合理使用化肥和农药。③生活污水实现集中处理排放。
五、化学式
1.用元素符号和数字的组合来表示物质的组成的式子叫化学式。
2.化学式可以表示多种意义,请说出CO2的意义。
3.化学式的写法
(1)单质化学式的书写
①稀有气体:用元素符号表示,如氦气写为He、氖气写为Ne;
②金属、固态非金属:用元素符号表示,如铁写为Fe、铜写为Cu、碳写为C、磷写为P;
③非金属气体:在元素符号右下角写上表示分子中所含原子数的数字:如氢气H2、氧气O2、臭氧O3。
(2)化合物化学式的书写
要书写化合物的化学式,必须知道化合物中含有哪几种元素以及不同元素原子的个数比。同时注意以下几点:
①当组成元素原子个数是1时,1要省略;
②化学式中右下方的小数字一般为最简整数比,如P2O5、Fe3O4;
③氧化物,“氧在右”,如CuO、P2O5;
④金属与非金属元素组成的化合物,“金属左,非金右”:如NaCl、ZnS。
在学习元素化合价时,要注意以下几点:
1.化合价有正、有负。
2.在化合物里,正负化合价的代数和为零。
3.金属元素和非金属元素化合时,金属元素显正价,非金属元素显负价
4.有一些元素在不同的化合物中显不同的化合价。
5.在单质里,元素的化合价为0。
6.原子团也有化合价。
六、化合价
元素化合价口诀
一氟溴氢钾钠银,
单质零价永不变。
变价还有锰氯氮,
三铝四硅三、五磷,
二、四、六硫,二、四碳,
一二铜,二三铁,
二价氧钙镁钡锌,
原子团化合价口诀
正一价的是铵根。
负二硫酸、碳酸根,
负三记住磷酸根,
负一硝酸、氢氧根,
根据“在化合物里,正负化合价的代数和为零”的规则,有以下两个方面的应用:
1.根据化学式,推断某元素的化合价。
2.根据化合价写化合物的化学式。
①最小公倍数法
②数字交叉法:
一排序、二标价、三约简、四交叉。
【例5】下列物质中,硫元素的化合价最高的是( )
A. S B. H2S C. SO2 D. Na2SO4
【例6】已知氧元素在化合物中通常显-2价,计算SO42-中S元素的化合价。(提示:在原子团中,正、负化合价的代数和等于根价)
D
解:设SO42-中S元素的化合价为x。
x=+6
x+(-2)×4=-2
答:SO42-中S元素的化合价为+6。
【练习6】下列说法中正确的是( )
A.在MgO中,镁原子显+2价,氧原子显-2价
B.原子是化学变化中的最小粒子
C.长期饮用纯净水对身体有益无害
D.在CO2中含有一个氧分子
【例7】某金属元素M的氯化物的化学式为MCl2,其氧化物的化学式为( )
A.MO2 B.M2O C.MO D.M2O3
B
C
【例8】某元素R的化合价为+3价,其氧化物中氧元素的质量分数为30%,则R的相对原子质量为( )
A.56 B.112 C.48 D.160
A
解析: R的化合价为+3价,其氧化物的化学式为R2O3,设R相对原子质量为r。
r=56
或
2r:(16×3)=(1-30%):30%=7:3
r=56
【例9】某种电池的正极材料由锂(Li)、钴(Co)和氧元素组成,三种元素的化合价分别是+1、+3、-2,则该物质的化学式为( )
A.LiCoO B.LiCoO2 C.LiCoO3 D.LiCoO4
B
七、元素符号、化学式前面或右下角数字的意义
1.元素符号前的数字:表示原子个数,如2N。
2.化学式前面的数字:表示分子个数(由分子构成的物质),如2H2O。
3.离子符号前面的数字:表示离子个数,如5H+。
4.元素符号右上角的数字:表示该离子所带的电荷数,如Mg2+。
5.元素符号正上方的数字:表示该元素的化合价。
6.化学式中元素符号右下角的数字:表示该分子所含有的某原子个数H2O(化学式中元素符号右下角的数字是通过实验测定出来的,不能改动。)
化学式中各原子的相对原子质量的总和,就是相对分子质量(符号为Mr)。
八、根据化学式的有关计算
1.计算相对分子质量
2.计算物质组成元素的质量比
3.计算物质中某元素的质量分数
根据化学式可进行以下计算
【练习8】《中学生守则》中明确规定,中学生不能吸烟。其原因之一是香烟燃烧时会放出多种有毒物质和致癌物质,其中元素间的质量比为3:4的有毒物质是( )
A.NO B.NO2 C.SO2 D.CO
【例10】下列物质中铁元素的质量分数最高的是( )
A.Fe3O4 B.Fe2O3 C.FeO
D
C
【例11】在现代生活中,人们越来越注重微量元素的摄取。碘元素对人体健康有至关重要的作用。下表是某地市场销售的一种“加碘食盐”包装袋上的部分说明。
请回答下列问题:
(1)由食用方法和贮藏指南可推测碘酸钾(KIO3)的化学性质之一是:______________________
(2)计算碘酸钾(KIO3)中,钾元素、碘元素、氧元素的质量比 ;
配料 氯化钠、碘酸钾(KIO3)
含碘量 20~30 mg/kg
保质期 18个月
食用方法 勿长时间炖炒
贮存方法 避光、避热、密封、防潮
高温下化学性质不稳定
39:127:48
【例11】在现代生活中,人们越来越注重微量元素的摄取。碘元素对人体健康有至关重要的作用。下表是某地市场销售的一种“加碘食盐”包装袋上的部分说明。
请回答下列问题:
配料 氯化钠、碘酸钾(KIO3)
含碘量 20~30mg/kg
保质期 18个月
食用方法 勿长时间炖炒
贮存方法 避光、避热、密封、防潮
(3)计算碘酸钾(KIO3)中,碘元素的质量分数是多少? ; 计算结果精确到0.1%)
(4)计算1 kg这样的食盐中,应加入 g碘酸钾(用最高含碘量计算)
59.3%
0.051
1kg×30mg/kg÷1000mg/g÷59.3%=0.051g
【例12】2005年3月,国家质检局查出一些辣椒酱、番茄酱等食品中含有工业染色剂“苏丹红一号”,人食用后可能致癌。“苏丹红一号”的化学式为C16H12N2O。下列有关“苏丹红一号”的说法中正确的是( )
A.“苏丹红一号”属于氧化物
B.“苏丹红一号”由31个原子构成
C.“苏丹红一号”的相对分子质量为248
D.“苏丹红一号”属于化合物
CD
【例13】小明在路边的围墙上看到一则化肥广告(如右图):回校后,小明通过计算氮的质量分数发现该广告是虚假广告。请你帮小明出计算过程,并说说他的判断依据:
(2)我认为此广告会坑害农民,向有关部门反映,技术监督局对该产品取样分析,发现其氮元素质量分数仅为12.0%,我能算出该产品中碳酸氢铵的质量分数为多少?
NH4HCO3中氮元素的质量分数为:
20.1%>17.7%
所以该广告是虚假广告。
取该样品1g,则氮元素的质量为1g×12.0%=0.12g
NH4HCO3的质量为:
0.12g÷17.7%=0.678g
NH4HCO3的质量分数为:
方法一:
方法二:
12.0%÷17.7%=67.8%
九、有关物质分类
由同种元素组成的纯净物叫单质
由不同种元素组成的纯净物叫化合物。
(“单质”、“化合物”的定义是建立在纯净物的基础之上的。)
由两种元素组成的化合物中,其中一种是氧元素的叫氧化物。
(1.氧化物的三个特点:①由两种元素组成。②其中一种是氧元素。③是化合物。2.“氧化物”的定义是建立在化合物的基础之上的。)
含有氧元素的化合物叫含氧化合物,含氧化合物不一定是氧化物。
【例14】对下列概念说法正确的是( )
A.纯净物与混合物属于包含关系
B.化合物与氧化物属于并列关系
C.单质与化合物属于交叉关系
D.化合反应与分解反应属于并列关系
【例15】某物质中只含有一种元素,则这种物质( )
A.一定是单质
B.一定是纯净物
C.一定不是混合物
D.可能是单质,也可能是混合物
D
D
【拓展提升1】
在氧化镁(MgO)和氧化铁(Fe2O3)组成的混合物中,氧元素的质量分数为m,m的取值范围是
__<m<__
解析:MgO中氧元素的质量分数为
Fe2O3中氧元素的质量分数为
MgO和Fe2O3的混合物中氧元素的质量分数m的取值范围为
30%<m<40%
30%
40%
【拓展提升2】测知CO和M的混合气体中,氧的质量分数为50%,则M气体可能是( )
A .CO2 B. N2O C. SO2 D. SO3
CO中氧元素的质量分数:
CO2中氧元素的质量分数:
N2O中氧元素的质量分数:
SO2中氧元素的质量分数:
SO3中氧元素的质量分数:
B
【拓展提升3】某混合物由40g氧化镁和160g氧化铁组成,求此混合物中氧元素的质量分数。
【解】40gMgO中氧元素的质量为
160gFe2O3中氧元素的质量为:
混合物中氧元素的质量分数为
答:混合物中氧元素的质量分数为32%。
【拓展提升4】相同质量的二氧化硫(SO2)和三氧化硫(SO3)中氧元素的质量比是( )
A.1:1 B.2:3 C.5:6 D.6:5
解析:设SO2和SO3的质量均为1g
1gSO2中氧元素的质量为
1gSO3中氧元素的质量为
相同质量的二氧化硫和三氧化硫中氧元素的质量比为
0.5g:0.6g=5:6
方法一:
C
【拓展提升4】相同质量的二氧化硫(SO2)和三氧化硫(SO3)中氧元素的质量比是( )
A.1:1 B.2:3 C.5:6 D.6:5
方法二:
SO2和SO3的相对分子质量分别为64和80
80SO2和64SO3的质量相等
相同质量的二氧化硫和三氧化硫中氧元素的质量比是
(80×2):(64×3)=5:6
C
解析:设SO2和SO3中氧元素的质量均为1g
SO2的质量为
SO3的质量为
二氧化硫和三氧化硫的质量比为
2g: =6:5
方法一:
【拓展提升5】氧元素质量相同的二氧化硫(SO2)和三氧化硫(SO3)的质量比是( )
A.1:1 B.2:3 C.5:6 D.6:5
D
方法二:
3SO2和2SO3中氧元素的质量相等
二氧化硫和三氧化硫的质量比是
(3×64):(2×80)=6:5
D
【拓展提升5】氧元素质量相同的二氧化硫(SO2)和三氧化硫(SO3)的质量比是( )
A.1:1 B.2:3 C.5:6 D.6:5
【拓展提升6】化合物X2Y和YZ2中,Y元素质量分数分别为40%和50%,则化合物X2YZ3中Y元素质量分数为多少 ?
解:设X、Y、Z的相对原子质量分别为x、y、z。
2x:y=(1-40%) :40%=3:2
y:2z=50%:(1-50%)=1:1
X2YZ3中Y元素质量分数为
答:X2YZ3中Y元素质量分数为25%。
谢 谢
第四单元 自然界的水
复习课件
1.水是无色无味、没有味道的液体,在一个标准大气压下,沸点是100℃,凝固点是0℃,水在4℃的密度为1g/cm3,能溶解多种物质形成溶液。
一、水的组成
2.电解水实验
实验 现象 表达式
电解水 电极上有气泡,正负极气体体积比为1:2。负极气体可燃烧,正极气体使燃着的木条燃得更旺。 水 氢气+氧气
H2O H2 O2
电解水是在直流电的作用下,在负极产生氢气,正极产生氧气。在这个反应中,水分子分解成氢原子和氧原子,这两种原子分别两两构成氢分子、氧分子,很多氢分子,氧分子聚集成氢气、氧气。
氢气燃烧生成水、水电解生成氢气和氧气,都说明水是由氢、氧两种元素组成的化合物。从微观分析,水是由水分子构成的,每个水分子是由2个氢原子和1个氧原子构成的,因此水可以表示为H2O。
水的组成和空气的组成在描述上的区别:
①空气是由氮气、氧气、二氧化碳、稀有气体及杂质组成,水由氢元素和氧元素组成。②描述空气的组成时用的是物质,而描述水的组成时用的是元素。③空气是混合物,含有多种物质,因此用物质描述组成,而水是纯净物,是化合物,由两种元素组成,因此用元素描述组成。
【例1】用右图装置电解水,一段时间后的现象如图所示。对该实验的描述错误的是( )
A.甲试管中收集到的是一种可燃性气体
B.该实验能证明水是由氢元素和氧元素组成
C.向水中加入少量硫酸,能增强水的导电性
D.甲、乙两试管内收集到的气体的质量比为8:1
D
【练习1】电解a克水,在阴极产生2.24mL气体,则在阳极上产生气体的体积为( )
A.4.48mL B.2.24mL C.1.12mL D.无法确定
【练习2】下列变化是化学变化的是( )
A.水结冰 B.电解水 C.水汽化 D.制蒸馏水
C
B
【例2】关于水的组成,下列说法正确的是( )
A.水是由氢气和氧气组成的
B.水中含有氢(H)、氧(O)两种元素
C.水是由氢分子和氧原子组成的
D.水是由两个氢原子和一个氧原子构成的
B
二、氢气
1.物理性质:无色无味的气体,难溶于水,密度比空气小,是相同条件下密度最小的气体。
2.化学性质——可燃性。
在空气(或氧气)中燃烧时放出大量的热,火焰呈淡蓝色,唯一的生成物是水。
3.氢气的验纯
原因:氢气与空气(或氧气)的混合气体遇明火可能发生爆炸,因此点燃氢气前,一定要先验纯。
验纯的方法:收集一试管的氢气,用拇指堵住试管口,试管口向下移进酒精灯火焰,松开拇指点火,若发出尖锐的爆鸣声表明氢气不纯;声音很小则表示氢气较纯。
【练习3】某同学在检验氢气纯度时,收集一试管氢气后,没有用拇指堵住试管口,而且试管口向上移近酒精灯火焰点火,结果没有听到声音,他认为氢气纯净了,你认为他的操作是 的(填“正确”或“错误”),原因是点火前氢气已经 到空气中去了。正确的方法是:收集一试管氢气后,用拇指 试管口,而且试管口向 移近酒精灯火焰点火。
【例3】下列混合气体遇明火可能发生爆炸的是( )
A.氢气和氧气 B.氮气和氧气
C.二氧化碳和空气 D.氢气和氮气
A
逸散
错误
下
堵住
三、水的净化
1.自来水厂的净化过程
(1)吸附沉淀(加入絮凝剂吸附杂质,如明矾溶于水后产生的胶状物吸附悬浮于水中的杂质,将小颗粒凝聚成大颗粒,使之沉降)和静置沉淀;
(2)过滤;
(3)活性炭吸附(具有较强的吸附能力,可以吸附一些可溶性杂质和色素,也可以除臭味)
(4)消毒。
操作 注意事项 原因
防止滤纸与漏斗壁间留有气泡而使过滤速度减慢
防止过滤液体的液面高于漏斗口
防止液体从滤纸与漏斗间的缝隙流走
防止水流冲破滤纸
防止滤纸戳破影响过滤效果
防止液滴飞溅
滤纸紧贴漏斗内壁
一贴
滤纸边缘略低于漏斗口
液面略低于滤纸边缘
二低
烧杯口靠着玻璃棒
玻璃棒斜靠在滤纸三层的一边
漏斗下端管口靠烧杯内壁
三靠
过滤操作及其注意事项
【练习4】小明同学去九仙山旅游时,用瓶装了一些山下的泉水,带回实验室,在老师的指导下,按下列流程进行实验,制取蒸馏水。请回答下列问题:
(1)取水后加入明矾的作用是_________________________________________________
_________________________________________________。
(2)进行过滤操作时,下列做法错误的是 。
A.玻璃棒要靠在三层滤纸的一边
B.漏斗下端的管口要紧靠烧杯的内壁
C.滤纸的边缘要低于漏斗口
D.液面不要低于滤纸边缘
来达到净水的目的(或吸附水中的悬浮杂质,使之沉降)
利用明矾溶于水后生成的胶状物对杂质的吸附,使杂质沉降
D
【练习4】 小明同学去九仙山旅游时,用瓶装了一些山下的泉水,带回实验室,在老师的指导下,按下列流程进行实验,制取蒸馏水。请回答下列问题:
(3)向滤液中加入活性炭,利用其 性,除去水样中的色素和异味。
(4)消毒剂高铁酸钠(Na2FeO4)集氧化、吸附、凝聚、杀菌等功能于一体,目前被广泛应用于自来水净化。高铁酸钠中铁元素的化合价为 。
(5)在制取蒸馏水的过程中,在水中要放碎瓷片,其作用是 。
吸附
+6
防止加热时出现暴沸
3.硬水和软水
(1)概念:含有较多可溶性钙和镁化合物的水叫硬水;不含或含较少可溶性钙和镁化合物的水叫软水。
(2)检验:把等量的肥皂水分别滴加到盛有等量硬水和软水的试管中,产生很多泡沫的是软水,产生很多浮渣的是硬水。
(3)硬水的软化方法:煮沸或蒸馏。
【练习5】从广告语:“农夫山泉有点甜”,可以说明“农夫山泉”饮用水是________(填“纯净物”或“混合物”)
混合物
【例4】要从氯酸钾和二氧化锰混合物加热制取氧气后的残留固体中回收二氧化锰,有以下几步操作可供选择,其中正确的操作顺序是(相关资料:氯化钾、氯酸钾易溶于水,二氧化锰难溶于水)( )
①蒸发溶液 ②过滤 ③溶解 ④水洗
⑤烘干
A.②①④⑤ B.③②⑤④
C.③②④⑤ D.④③②⑤
C
四、爱护水资源
1.人类拥有的水资源:总水量很大,但淡水资源极其有限。
2.我国的水资源:我国是世界上13个最缺水的国家之一。
3.爱护水资源
(1)节约用水:节约用水的途径:①使用新技术。 ②改革工艺。③改变习惯可以减少大量工农业和生活用水。
(2)防止水体污染
水体污染危害:影响工农业、渔业生产,破坏水生生态系统,危害人体健康。
水体污染来源:工业污染、农业污染、生活污染。
预防和治理水污染的措施:①工业上,通过应用新技术、新工艺减少污染物的产生,对污染的水体作处理使之符合排放标准。②农业上提倡使用农家肥,合理使用化肥和农药。③生活污水实现集中处理排放。
五、化学式
1.用元素符号和数字的组合来表示物质的组成的式子叫化学式。
2.化学式可以表示多种意义,请说出CO2的意义。
3.化学式的写法
(1)单质化学式的书写
①稀有气体:用元素符号表示,如氦气写为He、氖气写为Ne;
②金属、固态非金属:用元素符号表示,如铁写为Fe、铜写为Cu、碳写为C、磷写为P;
③非金属气体:在元素符号右下角写上表示分子中所含原子数的数字:如氢气H2、氧气O2、臭氧O3。
(2)化合物化学式的书写
要书写化合物的化学式,必须知道化合物中含有哪几种元素以及不同元素原子的个数比。同时注意以下几点:
①当组成元素原子个数是1时,1要省略;
②化学式中右下方的小数字一般为最简整数比,如P2O5、Fe3O4;
③氧化物,“氧在右”,如CuO、P2O5;
④金属与非金属元素组成的化合物,“金属左,非金右”:如NaCl、ZnS。
在学习元素化合价时,要注意以下几点:
1.化合价有正、有负。
2.在化合物里,正负化合价的代数和为零。
3.金属元素和非金属元素化合时,金属元素显正价,非金属元素显负价
4.有一些元素在不同的化合物中显不同的化合价。
5.在单质里,元素的化合价为0。
6.原子团也有化合价。
六、化合价
元素化合价口诀
一氟溴氢钾钠银,
单质零价永不变。
变价还有锰氯氮,
三铝四硅三、五磷,
二、四、六硫,二、四碳,
一二铜,二三铁,
二价氧钙镁钡锌,
原子团化合价口诀
正一价的是铵根。
负二硫酸、碳酸根,
负三记住磷酸根,
负一硝酸、氢氧根,
根据“在化合物里,正负化合价的代数和为零”的规则,有以下两个方面的应用:
1.根据化学式,推断某元素的化合价。
2.根据化合价写化合物的化学式。
①最小公倍数法
②数字交叉法:
一排序、二标价、三约简、四交叉。
【例5】下列物质中,硫元素的化合价最高的是( )
A. S B. H2S C. SO2 D. Na2SO4
【例6】已知氧元素在化合物中通常显-2价,计算SO42-中S元素的化合价。(提示:在原子团中,正、负化合价的代数和等于根价)
D
解:设SO42-中S元素的化合价为x。
x=+6
x+(-2)×4=-2
答:SO42-中S元素的化合价为+6。
【练习6】下列说法中正确的是( )
A.在MgO中,镁原子显+2价,氧原子显-2价
B.原子是化学变化中的最小粒子
C.长期饮用纯净水对身体有益无害
D.在CO2中含有一个氧分子
【例7】某金属元素M的氯化物的化学式为MCl2,其氧化物的化学式为( )
A.MO2 B.M2O C.MO D.M2O3
B
C
【例8】某元素R的化合价为+3价,其氧化物中氧元素的质量分数为30%,则R的相对原子质量为( )
A.56 B.112 C.48 D.160
A
解析: R的化合价为+3价,其氧化物的化学式为R2O3,设R相对原子质量为r。
r=56
或
2r:(16×3)=(1-30%):30%=7:3
r=56
【例9】某种电池的正极材料由锂(Li)、钴(Co)和氧元素组成,三种元素的化合价分别是+1、+3、-2,则该物质的化学式为( )
A.LiCoO B.LiCoO2 C.LiCoO3 D.LiCoO4
B
七、元素符号、化学式前面或右下角数字的意义
1.元素符号前的数字:表示原子个数,如2N。
2.化学式前面的数字:表示分子个数(由分子构成的物质),如2H2O。
3.离子符号前面的数字:表示离子个数,如5H+。
4.元素符号右上角的数字:表示该离子所带的电荷数,如Mg2+。
5.元素符号正上方的数字:表示该元素的化合价。
6.化学式中元素符号右下角的数字:表示该分子所含有的某原子个数H2O(化学式中元素符号右下角的数字是通过实验测定出来的,不能改动。)
化学式中各原子的相对原子质量的总和,就是相对分子质量(符号为Mr)。
八、根据化学式的有关计算
1.计算相对分子质量
2.计算物质组成元素的质量比
3.计算物质中某元素的质量分数
根据化学式可进行以下计算
【练习8】《中学生守则》中明确规定,中学生不能吸烟。其原因之一是香烟燃烧时会放出多种有毒物质和致癌物质,其中元素间的质量比为3:4的有毒物质是( )
A.NO B.NO2 C.SO2 D.CO
【例10】下列物质中铁元素的质量分数最高的是( )
A.Fe3O4 B.Fe2O3 C.FeO
D
C
【例11】在现代生活中,人们越来越注重微量元素的摄取。碘元素对人体健康有至关重要的作用。下表是某地市场销售的一种“加碘食盐”包装袋上的部分说明。
请回答下列问题:
(1)由食用方法和贮藏指南可推测碘酸钾(KIO3)的化学性质之一是:______________________
(2)计算碘酸钾(KIO3)中,钾元素、碘元素、氧元素的质量比 ;
配料 氯化钠、碘酸钾(KIO3)
含碘量 20~30 mg/kg
保质期 18个月
食用方法 勿长时间炖炒
贮存方法 避光、避热、密封、防潮
高温下化学性质不稳定
39:127:48
【例11】在现代生活中,人们越来越注重微量元素的摄取。碘元素对人体健康有至关重要的作用。下表是某地市场销售的一种“加碘食盐”包装袋上的部分说明。
请回答下列问题:
配料 氯化钠、碘酸钾(KIO3)
含碘量 20~30mg/kg
保质期 18个月
食用方法 勿长时间炖炒
贮存方法 避光、避热、密封、防潮
(3)计算碘酸钾(KIO3)中,碘元素的质量分数是多少? ; 计算结果精确到0.1%)
(4)计算1 kg这样的食盐中,应加入 g碘酸钾(用最高含碘量计算)
59.3%
0.051
1kg×30mg/kg÷1000mg/g÷59.3%=0.051g
【例12】2005年3月,国家质检局查出一些辣椒酱、番茄酱等食品中含有工业染色剂“苏丹红一号”,人食用后可能致癌。“苏丹红一号”的化学式为C16H12N2O。下列有关“苏丹红一号”的说法中正确的是( )
A.“苏丹红一号”属于氧化物
B.“苏丹红一号”由31个原子构成
C.“苏丹红一号”的相对分子质量为248
D.“苏丹红一号”属于化合物
CD
【例13】小明在路边的围墙上看到一则化肥广告(如右图):回校后,小明通过计算氮的质量分数发现该广告是虚假广告。请你帮小明出计算过程,并说说他的判断依据:
(2)我认为此广告会坑害农民,向有关部门反映,技术监督局对该产品取样分析,发现其氮元素质量分数仅为12.0%,我能算出该产品中碳酸氢铵的质量分数为多少?
NH4HCO3中氮元素的质量分数为:
20.1%>17.7%
所以该广告是虚假广告。
取该样品1g,则氮元素的质量为1g×12.0%=0.12g
NH4HCO3的质量为:
0.12g÷17.7%=0.678g
NH4HCO3的质量分数为:
方法一:
方法二:
12.0%÷17.7%=67.8%
九、有关物质分类
由同种元素组成的纯净物叫单质
由不同种元素组成的纯净物叫化合物。
(“单质”、“化合物”的定义是建立在纯净物的基础之上的。)
由两种元素组成的化合物中,其中一种是氧元素的叫氧化物。
(1.氧化物的三个特点:①由两种元素组成。②其中一种是氧元素。③是化合物。2.“氧化物”的定义是建立在化合物的基础之上的。)
含有氧元素的化合物叫含氧化合物,含氧化合物不一定是氧化物。
【例14】对下列概念说法正确的是( )
A.纯净物与混合物属于包含关系
B.化合物与氧化物属于并列关系
C.单质与化合物属于交叉关系
D.化合反应与分解反应属于并列关系
【例15】某物质中只含有一种元素,则这种物质( )
A.一定是单质
B.一定是纯净物
C.一定不是混合物
D.可能是单质,也可能是混合物
D
D
【拓展提升1】
在氧化镁(MgO)和氧化铁(Fe2O3)组成的混合物中,氧元素的质量分数为m,m的取值范围是
__<m<__
解析:MgO中氧元素的质量分数为
Fe2O3中氧元素的质量分数为
MgO和Fe2O3的混合物中氧元素的质量分数m的取值范围为
30%<m<40%
30%
40%
【拓展提升2】测知CO和M的混合气体中,氧的质量分数为50%,则M气体可能是( )
A .CO2 B. N2O C. SO2 D. SO3
CO中氧元素的质量分数:
CO2中氧元素的质量分数:
N2O中氧元素的质量分数:
SO2中氧元素的质量分数:
SO3中氧元素的质量分数:
B
【拓展提升3】某混合物由40g氧化镁和160g氧化铁组成,求此混合物中氧元素的质量分数。
【解】40gMgO中氧元素的质量为
160gFe2O3中氧元素的质量为:
混合物中氧元素的质量分数为
答:混合物中氧元素的质量分数为32%。
【拓展提升4】相同质量的二氧化硫(SO2)和三氧化硫(SO3)中氧元素的质量比是( )
A.1:1 B.2:3 C.5:6 D.6:5
解析:设SO2和SO3的质量均为1g
1gSO2中氧元素的质量为
1gSO3中氧元素的质量为
相同质量的二氧化硫和三氧化硫中氧元素的质量比为
0.5g:0.6g=5:6
方法一:
C
【拓展提升4】相同质量的二氧化硫(SO2)和三氧化硫(SO3)中氧元素的质量比是( )
A.1:1 B.2:3 C.5:6 D.6:5
方法二:
SO2和SO3的相对分子质量分别为64和80
80SO2和64SO3的质量相等
相同质量的二氧化硫和三氧化硫中氧元素的质量比是
(80×2):(64×3)=5:6
C
解析:设SO2和SO3中氧元素的质量均为1g
SO2的质量为
SO3的质量为
二氧化硫和三氧化硫的质量比为
2g: =6:5
方法一:
【拓展提升5】氧元素质量相同的二氧化硫(SO2)和三氧化硫(SO3)的质量比是( )
A.1:1 B.2:3 C.5:6 D.6:5
D
方法二:
3SO2和2SO3中氧元素的质量相等
二氧化硫和三氧化硫的质量比是
(3×64):(2×80)=6:5
D
【拓展提升5】氧元素质量相同的二氧化硫(SO2)和三氧化硫(SO3)的质量比是( )
A.1:1 B.2:3 C.5:6 D.6:5
【拓展提升6】化合物X2Y和YZ2中,Y元素质量分数分别为40%和50%,则化合物X2YZ3中Y元素质量分数为多少 ?
解:设X、Y、Z的相对原子质量分别为x、y、z。
2x:y=(1-40%) :40%=3:2
y:2z=50%:(1-50%)=1:1
X2YZ3中Y元素质量分数为
答:X2YZ3中Y元素质量分数为25%。
谢 谢
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
