人教版(五四制)八年级全一册化学 第四单元 课题4 化学式与化合价 课件(共36张PPT)
文档属性
| 名称 | 人教版(五四制)八年级全一册化学 第四单元 课题4 化学式与化合价 课件(共36张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-15 14:24:32 | ||
图片预览










文档简介
(共36张PPT)
课题4 化学式与化合价
1
课堂讲解
化合价
化合价与化学式
2
课时流程
课后作业
逐点
导讲练
课堂小结
化合价
1
知识点
化合价
1.概念
元素一定数目的原子跟其他元素一定数目的
原子化合的性质叫做元素的化合价,化合价
有正价和负价。
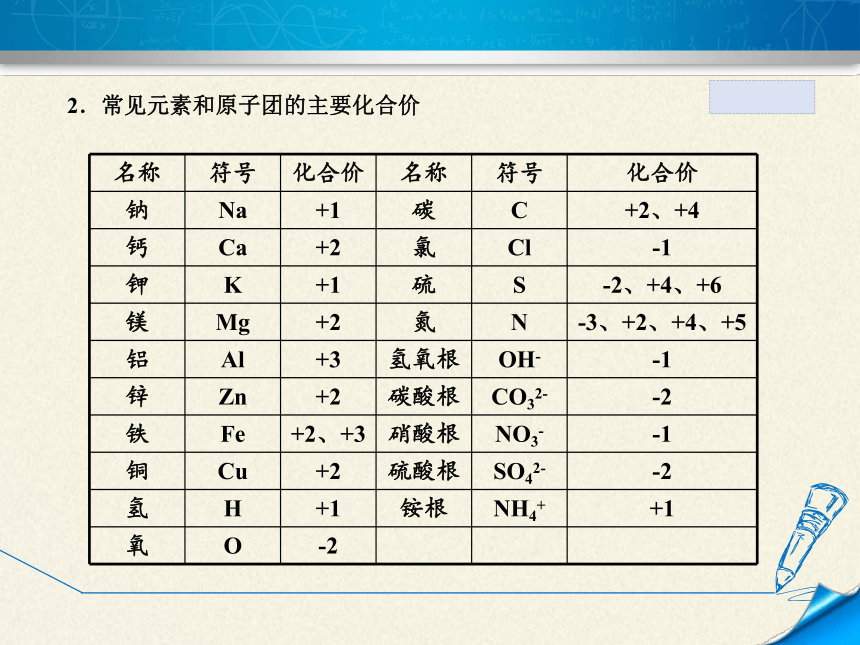
2.常见元素和原子团的主要化合价
名称 符号 化合价 名称 符号 化合价
钠 Na +1 碳 C +2、+4
钙 Ca +2 氯 Cl -1
钾 K +1 硫 S -2、+4、+6
镁 Mg +2 氮 N -3、+2、+4、+5
铝 Al +3 氢氧根 OH- -1
锌 Zn +2 碳酸根 CO32- -2
铁 Fe +2、+3 硝酸根 NO3- -1
铜 Cu +2 硫酸根 SO42- -2
氢 H +1 铵根 NH4+ +1
氧 O -2
问 题(一)
同一种化合价能不能有不同种的元素?举例子
问 题(二)
同一种元素是不是只有一种化合价?举例子
问 题(三)
什么叫原子团?表中哪些是原子团?
3.原子团
一种或多种元素的原子结合在一起形成带电的
离子,作为一个整体参加化学反应,这样的原子集
合称为原子团。化学上常用“根”来命名。
如氢氧根(OH-) 、碳酸根(CO32- ) 、硫酸根(SO42-) 、
硝酸根(NO3-) 、 铵根(NH4+)。
常见元素化合价的记忆口诀:
钾钠银氢正一价,
钙镁钡锌正二价,
铜正一二铝正三,
铁正二三硅正四,
氟氯负一氧负二,
氢氧硝酸为负一,
碳酸硫酸为负二,
只有铵根为正一。
4.化合价的一般规律
①通常,金属元素显正价,非金属元素显负价;
②一些元素在不同物质中可显不同的化合价,
+2 +3
例:FeO Fe2O3
(氧化亚铁) (氧化铁、三氧化二铁)
③一些元素在同一物质中可显不同的化合价,
-3 +5
例:NH4NO3
④化合物中各种元素化合价的代数和为零;
⑤单质中元素的化合价为零。
问 题(一)
化合价的标注与离子符号的书写有什么相似点和不同点?
归 纳
化合价 离子符号
区别 (1)元素符号的正上方标 注化合价 (2)符号在前,数字在后 (3)“1”不能省 (1)元素符号的右上角标 注所带电荷
(2)数字在前,符号在后
(3)“1”必须省
联系 同种元素(或原子团)的化合价和对应离子的电荷,通常数值相等,位置相反
【例1】下列有关化合价的说法中,正确的是( )
A.在NaCl和Cl2里,氯元素均为-1价
B.一种元素只能显一种化合价
C.在化合物里,元素正负化合价的代数和为0
D.在化合物里,非金属元素只能显负价
C
导引:关于化合价必须掌握一些基本规律:(1)化合价是元素的原子在形成化合物过程中表现出来的性质,所以在单质中元素的化合价为零,如Cl2中氯元素化合价为0;(2)化合物中元素正负化合价的代数和为零;(3)化合物中有的元素只有一种化合价,如镁、铝、钠等元素,有的元素有多种化合价,如碳、硫、氯等元素;(4)化合物中金属元素一般显正价,非金属元素显负价 ,但非金属元素在有些化合物中也显正价,如二氧化碳、二氧化硫中碳元素、硫元素显正价,氧元素显负价;(5)元素的化合价数值等于一个原子得失电子的数目,即元素的化合价与原子的最外层电子数有关。
【例2】(安顺)人体吸入的O2有2%转化为活性氧,它加速人体衰老,被称为“夺命杀手”。我国科学家尝试用Na2SeO3清除人体内的活性氧,Na2SeO3中的Se(硒)元素的化合价是( )
A.+2 B.+4 C.+6 D.-2
C
导引:在化合物中各元素化合价的代数和为0。 Na2SeO3中Na显+1价,O显-2价,设Se的化合价为x,则可列式:(+1)×2+x+(-2)×3=0,可算出x=+4
【例3】(莱芜)在日常生活中我们常接触到许多含氮的物质,如:N2、NO2、NH3、NO、N2O3、N2O4、NaNO2、NH4NO3,则这八种物质中氮元素显示的化合价共有( )
A.4种 B.5种 C.6种 D.7种
B
导引:N2中氮元素化合价为0;NO2中氮元素化合价为+4;NH3中氮元素化合价为-3;NO、N2O3、N2O4、NaNO2中氮元素化合价分别为+2、+3、+4、+3;求NH4NO3中氮元素的化合价要在两个不同的原子团即NH4+、NO3-中根据元素正负化合价代数和分别为+1、-1,求出氮元素的化合价分别为-3、+5。因此题中各物质中氮元素的化合价一共有6种。
总 结
单质中元素的化合价为零,在化合物中元素有正价,也有负价,但正负化合价代数和为零。但在原子团中元素正负化合价的代数和不为零,等于该原子团的化合价。
1 (2016 百色)人体吸入的O2有2%转化为活性氧,它加速人体衰老,被称为“夺命杀手”。我国科学家尝试用亚硒酸钠Na2SeO3清除人体内的活性氧,亚硒酸钠Na2SeO3中Se(硒)元素的化合价是( )
A.+2 B.+4 C.+6 D.-2
2.(2016 营口)下列硫的单质和化合物中,硫元素的化合价最高的是
( )
A.S B.SO2 C.H2S D.H2SO4
下列关于化合价的说法中,正确的是( )
A.在NaCl和HCl里,氯元素均显-1价
B.在H2中,氢元素显+1价
C.一种元素只能显一种化合价
D.非金属元素在化合物中一定显负价
下列叙述中,正确的是( )
A.金属元素总是显正价,非金属元素总是显负价
B.一种元素在同一化合物中只有一种化合价
C.元素的化合价是元素的原子形成化合物时表现出来
的性质
D.在原子团NO3-中,各元素化合价的代数和为零
2
知识点
化合价与化学式
(1)已知化合价,求化学式
十字交叉法:
1、写符号 P O
2、标化合价 P O
3、化合价绝对值交叉放置元素符号右下角
4、约简
5、检查
+5 -2
P2O5
+5 -2
注:原子团作为一个整体,当一个数不为1时要用括号括起来
(2)根据化学式求化合价
例题(2):已知O为-2价,求Fe2O3中铁元素的
化合价。
(依据:化合物里正负化合价代数和为0。)
解:设Fe2O3中铁元素的化合价为x
2x+(-2) ×3=0
x=+3
【例4】曾用作麻醉剂的“笑气”是一种氮的氧化物,其中氮元素的化合价为+1,则“笑气”的化学式是( )
A.N2O5 B.NO2 C.NO D.N2O
D
已知氮元素的化合价为+1,氧元素的化合价为-2,利用十字交叉法可得: ,当原子个数为“1”时省略不写,即“笑气”的化学式为N2O。
【例5】(苏州)下列物质化学式书写正确的是( )
A.铝:AL B.氯化钾:KCl2
C.硫酸铜:CuSO4 D.四氧化三铁:O4Fe3
C
导引:铝的化学式直接用元素符号来表示,A中的元素符号书写不规范,不符合“一大二小”的原则,错误;钾元素显+1价,氯元素显-1价,B的化学式中各元素正负化合价的代数和不等于零,不正确;D中元素符号的书写顺序不对,应该是正价在前,负价在后。
【例6】(广州番禺区一模)物质的化学式和相应名称均书写正确的是( )
A.FeSO4:硫酸铁
B.氢氧化铜CuOH
C.NaCO3:碳酸钠
D.氢氧化钙 Ca(OH)2
D
导引:含有原子团的化学式的书写方法类似,前正后负排顺序,上方标明化合价,求出最小公倍数,算出原子团数量。需注意的是:原子团是一个整体,当原子团的个数不为1时,应先添括号,再标数字。FeSO4是硫酸亚铁,硫酸铁中铁元素显+3价,应写为Fe2(SO4)3;氢氧化铜中铜元素为+2价,化学式为Cu(OH)2;碳酸钠中碳酸根为-2价,化学式为Na2CO3。
总 结
辨别化学式书写是否正确,可从以下几点去思考:
1.元素符号书写是否规范或符号与名称是否一致;
2.元素符号书写的位置是否遵循前正后负的原则;
3.相关元素或原子团的化合价是否正确,特别是由
多种化合价的如铁元素;
4.元素正负化合价的代数和是否为零。
5.(2016 兰州)LiFePO4新型锂离子电池以其独特的优势成为绿色能源的新宠,已知锂的化合价为+1价,P的化合价为+5价,则LiFePO4中Fe的化合价是( )
A.+2 B.0 C.+3 D.+6
6 (中考·雅安)偏钛酸钡(BaxTiO3)因其显著的“压电
效应”而广泛地应用于超声波发生装置中。已知偏钛酸钡中钛元素的化合价为+4价,则其化学式中x的数值为( )
A.1 B.2 C.3 D.4
7 (中考·泰安)稀土元素铕(Eu)是激光及原子能应 用的重要材料。已知氯化铕的化学式为EuCl3,如果铕元素的化合价不变,则氧化铕的化学式为( )
A. EuO B.Eu2O3 C.Eu3O2 D.EuO3
8 (中考·温州)硫化镉是“文身彩贴”的主要成分,可 经皮肤进入人体内,干扰人体正常的新陈代谢。已知硫化镉中镉(Cd)元素的化合价为+2价、硫(S)元素的化合价为-2价,其化学式是( )
A. Cd2S B.CdS2 C.Cd2S3 D.CdS
9 标出下列物质中加点元素的化合价: (1)Al2O3________;(2)SO3________;
(3)NH4Cl________;(4)KClO3________;(5)KMnO4________;(6)Na2CO3________。
· ·
· ·
· ·
10 根据化合价写出下列离子之间形成化合物的化学式:
离子 K+ Ca2+ Al3+ NH4+
O2- /
Cl-
NO3-
SO42-
化合价
应用
规律
概念
用来表示元素在形成化合物时的原子个数比
①氧元素通常显-2价;氢元素通常显+1价
②金属跟非金属化合时,金属显正价、
非金属显负价
③化合物中正、负化合价的代数和为0;
单质中元素的化合价为0
已知化学式求化合价
已知化合价求化学式
请完成习题
谢 谢
课题4 化学式与化合价
1
课堂讲解
化合价
化合价与化学式
2
课时流程
课后作业
逐点
导讲练
课堂小结
化合价
1
知识点
化合价
1.概念
元素一定数目的原子跟其他元素一定数目的
原子化合的性质叫做元素的化合价,化合价
有正价和负价。
2.常见元素和原子团的主要化合价
名称 符号 化合价 名称 符号 化合价
钠 Na +1 碳 C +2、+4
钙 Ca +2 氯 Cl -1
钾 K +1 硫 S -2、+4、+6
镁 Mg +2 氮 N -3、+2、+4、+5
铝 Al +3 氢氧根 OH- -1
锌 Zn +2 碳酸根 CO32- -2
铁 Fe +2、+3 硝酸根 NO3- -1
铜 Cu +2 硫酸根 SO42- -2
氢 H +1 铵根 NH4+ +1
氧 O -2
问 题(一)
同一种化合价能不能有不同种的元素?举例子
问 题(二)
同一种元素是不是只有一种化合价?举例子
问 题(三)
什么叫原子团?表中哪些是原子团?
3.原子团
一种或多种元素的原子结合在一起形成带电的
离子,作为一个整体参加化学反应,这样的原子集
合称为原子团。化学上常用“根”来命名。
如氢氧根(OH-) 、碳酸根(CO32- ) 、硫酸根(SO42-) 、
硝酸根(NO3-) 、 铵根(NH4+)。
常见元素化合价的记忆口诀:
钾钠银氢正一价,
钙镁钡锌正二价,
铜正一二铝正三,
铁正二三硅正四,
氟氯负一氧负二,
氢氧硝酸为负一,
碳酸硫酸为负二,
只有铵根为正一。
4.化合价的一般规律
①通常,金属元素显正价,非金属元素显负价;
②一些元素在不同物质中可显不同的化合价,
+2 +3
例:FeO Fe2O3
(氧化亚铁) (氧化铁、三氧化二铁)
③一些元素在同一物质中可显不同的化合价,
-3 +5
例:NH4NO3
④化合物中各种元素化合价的代数和为零;
⑤单质中元素的化合价为零。
问 题(一)
化合价的标注与离子符号的书写有什么相似点和不同点?
归 纳
化合价 离子符号
区别 (1)元素符号的正上方标 注化合价 (2)符号在前,数字在后 (3)“1”不能省 (1)元素符号的右上角标 注所带电荷
(2)数字在前,符号在后
(3)“1”必须省
联系 同种元素(或原子团)的化合价和对应离子的电荷,通常数值相等,位置相反
【例1】下列有关化合价的说法中,正确的是( )
A.在NaCl和Cl2里,氯元素均为-1价
B.一种元素只能显一种化合价
C.在化合物里,元素正负化合价的代数和为0
D.在化合物里,非金属元素只能显负价
C
导引:关于化合价必须掌握一些基本规律:(1)化合价是元素的原子在形成化合物过程中表现出来的性质,所以在单质中元素的化合价为零,如Cl2中氯元素化合价为0;(2)化合物中元素正负化合价的代数和为零;(3)化合物中有的元素只有一种化合价,如镁、铝、钠等元素,有的元素有多种化合价,如碳、硫、氯等元素;(4)化合物中金属元素一般显正价,非金属元素显负价 ,但非金属元素在有些化合物中也显正价,如二氧化碳、二氧化硫中碳元素、硫元素显正价,氧元素显负价;(5)元素的化合价数值等于一个原子得失电子的数目,即元素的化合价与原子的最外层电子数有关。
【例2】(安顺)人体吸入的O2有2%转化为活性氧,它加速人体衰老,被称为“夺命杀手”。我国科学家尝试用Na2SeO3清除人体内的活性氧,Na2SeO3中的Se(硒)元素的化合价是( )
A.+2 B.+4 C.+6 D.-2
C
导引:在化合物中各元素化合价的代数和为0。 Na2SeO3中Na显+1价,O显-2价,设Se的化合价为x,则可列式:(+1)×2+x+(-2)×3=0,可算出x=+4
【例3】(莱芜)在日常生活中我们常接触到许多含氮的物质,如:N2、NO2、NH3、NO、N2O3、N2O4、NaNO2、NH4NO3,则这八种物质中氮元素显示的化合价共有( )
A.4种 B.5种 C.6种 D.7种
B
导引:N2中氮元素化合价为0;NO2中氮元素化合价为+4;NH3中氮元素化合价为-3;NO、N2O3、N2O4、NaNO2中氮元素化合价分别为+2、+3、+4、+3;求NH4NO3中氮元素的化合价要在两个不同的原子团即NH4+、NO3-中根据元素正负化合价代数和分别为+1、-1,求出氮元素的化合价分别为-3、+5。因此题中各物质中氮元素的化合价一共有6种。
总 结
单质中元素的化合价为零,在化合物中元素有正价,也有负价,但正负化合价代数和为零。但在原子团中元素正负化合价的代数和不为零,等于该原子团的化合价。
1 (2016 百色)人体吸入的O2有2%转化为活性氧,它加速人体衰老,被称为“夺命杀手”。我国科学家尝试用亚硒酸钠Na2SeO3清除人体内的活性氧,亚硒酸钠Na2SeO3中Se(硒)元素的化合价是( )
A.+2 B.+4 C.+6 D.-2
2.(2016 营口)下列硫的单质和化合物中,硫元素的化合价最高的是
( )
A.S B.SO2 C.H2S D.H2SO4
下列关于化合价的说法中,正确的是( )
A.在NaCl和HCl里,氯元素均显-1价
B.在H2中,氢元素显+1价
C.一种元素只能显一种化合价
D.非金属元素在化合物中一定显负价
下列叙述中,正确的是( )
A.金属元素总是显正价,非金属元素总是显负价
B.一种元素在同一化合物中只有一种化合价
C.元素的化合价是元素的原子形成化合物时表现出来
的性质
D.在原子团NO3-中,各元素化合价的代数和为零
2
知识点
化合价与化学式
(1)已知化合价,求化学式
十字交叉法:
1、写符号 P O
2、标化合价 P O
3、化合价绝对值交叉放置元素符号右下角
4、约简
5、检查
+5 -2
P2O5
+5 -2
注:原子团作为一个整体,当一个数不为1时要用括号括起来
(2)根据化学式求化合价
例题(2):已知O为-2价,求Fe2O3中铁元素的
化合价。
(依据:化合物里正负化合价代数和为0。)
解:设Fe2O3中铁元素的化合价为x
2x+(-2) ×3=0
x=+3
【例4】曾用作麻醉剂的“笑气”是一种氮的氧化物,其中氮元素的化合价为+1,则“笑气”的化学式是( )
A.N2O5 B.NO2 C.NO D.N2O
D
已知氮元素的化合价为+1,氧元素的化合价为-2,利用十字交叉法可得: ,当原子个数为“1”时省略不写,即“笑气”的化学式为N2O。
【例5】(苏州)下列物质化学式书写正确的是( )
A.铝:AL B.氯化钾:KCl2
C.硫酸铜:CuSO4 D.四氧化三铁:O4Fe3
C
导引:铝的化学式直接用元素符号来表示,A中的元素符号书写不规范,不符合“一大二小”的原则,错误;钾元素显+1价,氯元素显-1价,B的化学式中各元素正负化合价的代数和不等于零,不正确;D中元素符号的书写顺序不对,应该是正价在前,负价在后。
【例6】(广州番禺区一模)物质的化学式和相应名称均书写正确的是( )
A.FeSO4:硫酸铁
B.氢氧化铜CuOH
C.NaCO3:碳酸钠
D.氢氧化钙 Ca(OH)2
D
导引:含有原子团的化学式的书写方法类似,前正后负排顺序,上方标明化合价,求出最小公倍数,算出原子团数量。需注意的是:原子团是一个整体,当原子团的个数不为1时,应先添括号,再标数字。FeSO4是硫酸亚铁,硫酸铁中铁元素显+3价,应写为Fe2(SO4)3;氢氧化铜中铜元素为+2价,化学式为Cu(OH)2;碳酸钠中碳酸根为-2价,化学式为Na2CO3。
总 结
辨别化学式书写是否正确,可从以下几点去思考:
1.元素符号书写是否规范或符号与名称是否一致;
2.元素符号书写的位置是否遵循前正后负的原则;
3.相关元素或原子团的化合价是否正确,特别是由
多种化合价的如铁元素;
4.元素正负化合价的代数和是否为零。
5.(2016 兰州)LiFePO4新型锂离子电池以其独特的优势成为绿色能源的新宠,已知锂的化合价为+1价,P的化合价为+5价,则LiFePO4中Fe的化合价是( )
A.+2 B.0 C.+3 D.+6
6 (中考·雅安)偏钛酸钡(BaxTiO3)因其显著的“压电
效应”而广泛地应用于超声波发生装置中。已知偏钛酸钡中钛元素的化合价为+4价,则其化学式中x的数值为( )
A.1 B.2 C.3 D.4
7 (中考·泰安)稀土元素铕(Eu)是激光及原子能应 用的重要材料。已知氯化铕的化学式为EuCl3,如果铕元素的化合价不变,则氧化铕的化学式为( )
A. EuO B.Eu2O3 C.Eu3O2 D.EuO3
8 (中考·温州)硫化镉是“文身彩贴”的主要成分,可 经皮肤进入人体内,干扰人体正常的新陈代谢。已知硫化镉中镉(Cd)元素的化合价为+2价、硫(S)元素的化合价为-2价,其化学式是( )
A. Cd2S B.CdS2 C.Cd2S3 D.CdS
9 标出下列物质中加点元素的化合价: (1)Al2O3________;(2)SO3________;
(3)NH4Cl________;(4)KClO3________;(5)KMnO4________;(6)Na2CO3________。
· ·
· ·
· ·
10 根据化合价写出下列离子之间形成化合物的化学式:
离子 K+ Ca2+ Al3+ NH4+
O2- /
Cl-
NO3-
SO42-
化合价
应用
规律
概念
用来表示元素在形成化合物时的原子个数比
①氧元素通常显-2价;氢元素通常显+1价
②金属跟非金属化合时,金属显正价、
非金属显负价
③化合物中正、负化合价的代数和为0;
单质中元素的化合价为0
已知化学式求化合价
已知化合价求化学式
请完成习题
谢 谢
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
