2021-2022学年上学期高一化学人教版(2019)必修第一册第1章第3节氧化还原反应(25张ppt)
文档属性
| 名称 | 2021-2022学年上学期高一化学人教版(2019)必修第一册第1章第3节氧化还原反应(25张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-17 15:16:24 | ||
图片预览








文档简介
(共25张PPT)
氧化还原反应
教学目标
1.明确氧化还原反应的相关概念及规律
教学目标:
2.强化氧化还原反应常见题型的解题技巧
本节重、难点
1.氧化还原反应的规律
教学重、难点:
2.氧化还原反应常见题型的解题技巧
学前导入
在前面,我们学习了很多的反应,按照反应前后物质的种类和数目,我们可以将反应分为哪些反应类型呢?
化合反应
分解反应
置换反应
复分解反应
学前导入
Fe2O3 + 3CO 2Fe + 3CO2
?
氧化还原反应
非氧化还原反应
教学内容
1.特征
一、氧化还原反应
元素化合价发生变化
Fe2O3 + 3CO 2Fe + 3CO2
属于氧化还原反应
教学内容
1、 Fe2O3+6HCl==2FeCl3+3H2O
2、2KClO3 == 2KCl+3O2 ↑
加热
5、2O3==3O2
3、Zn + H2SO4 = ZnSO4 + H2 ↑
哪些是氧化还原反应?
7、CuSO4 + 2NaOH==Na2SO4 +Cu(OH)2
6、2NaI+ Cl2 == 2NaCl + I2
高温
4、CaCO3 == CaO + CO2 ↑
√
√
√
教学内容
1.特征
一、氧化还原反应
元素化合价发生变化
2.本质
电子的转移
电子的得、失
电子的偏向、偏离
教学内容
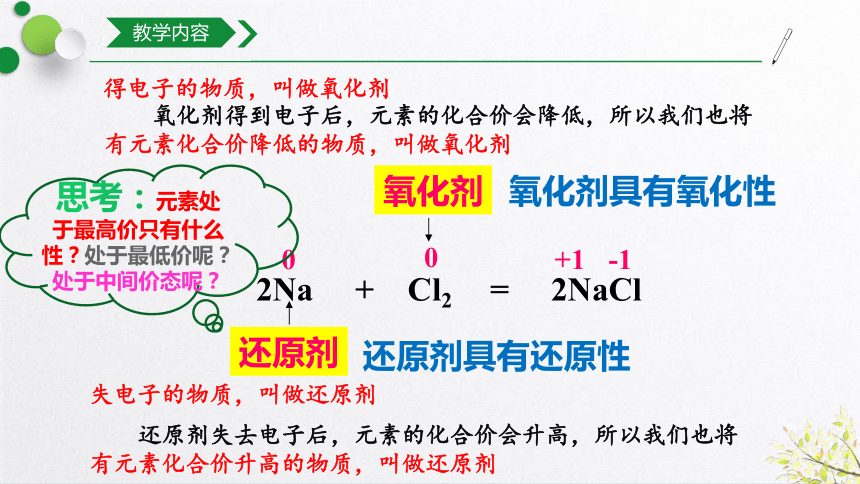
得电子的物质,叫做氧化剂
氧化剂得到电子后,元素的化合价会降低,所以我们也将有元素化合价降低的物质,叫做氧化剂
失电子的物质,叫做还原剂
还原剂失去电子后,元素的化合价会升高,所以我们也将有元素化合价升高的物质,叫做还原剂
氧化剂具有氧化性
还原剂具有还原性
2Na + Cl2 = 2NaCl
还原剂
氧化剂
0
+1
0
-1
思考:元素处于最高价只有什么性?处于最低价呢?处于中间价态呢?
教学内容
3.反应规律
一、氧化还原反应
强氧化性物质 + 强还原性物质 =弱还原性物质 + 弱氧化性物质
得到电子
化合价降低
口诀:
升失氧化 还原剂;降得还原 氧化剂
被还原
发生还原反应
失去电子
化合价升高
被氧化
发生氧化反应
(氧化剂)
(还原剂)
(还原产物)
(氧化产物)
教学内容
题型一
例1. 下列反应中属于氧化还原反应的是:( )
A. NaOH+HCl=NaCl+H2O
B. 2KI+Br2=2KBr+I2
C. MgO+2HCl=MgCl2+H2O
D. SO3+H2O=H2SO4
氧化还原反应的判断
B
题型二
例2. 在化学反应2KI+Br2=2KBr+I2中,氧化剂是:( )
A. KI B. Br2 C. KBr D. I2
氧化剂、还原剂的判断
B
教学内容
(1)Zn+CuSO4 = Cu+ZnSO4
例4.请指出下列氧化还原反应中氧化剂、还原剂。
(2)Fe2O3+3CO == 2Fe+3CO2
高温
(3)MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
Δ
(4)2KClO3 = 2KCl+3O2 ↑
Δ
B
例3.下列变化过程中,加入氧化剂才能实现的是:( )
A. Cl2→Cl- B. I-→I2
C. SO2→SO32- D. CuO→Cu
教学内容
题型三
例5. 常温下,可发生下列几种反应:
① 16H++10Cl-+2MnO4- = 2Mn2++5Cl2↑+8H2O
② 2Br-+Cl2 = Br2+2Cl-
分析上述反应,氧化性强弱顺序正确的是( )
A. MnO4- >Cl2>Br2
B. Br2>Cl2>MnO4-
C. Cl2>MnO4- >Br2
D. Cl2>Br2>MnO4-
氧化性、还原性强弱的判断
A
教学内容
题型四
例6. 已知常温下,有氧化性强弱顺序为MnO4- >Cl2>Br2>Fe3+ 的几种微粒参与下列反应,其中不能发生的反应是:( )
A. 2Br - +Cl2 = Br2+2Cl-
B. 2Fe3++2Br- = 2Fe2++Br2
C. 16H++10Cl-+2MnO4- = 2Mn2++5Cl2↑+8H2O
D. 2Fe2++Cl2 = 2Fe3++2Cl-
氧化性、还原性强弱的运用
B
教学内容
题型四
氧化性、还原性强弱的运用
同一种氧化剂与多种还原剂混合时,(氧化剂)会先与还原性强的物质反应。
例7.已知Cl2能与I-、Fe2+发生氧化还原反应,且有还原性:I->Fe2+,则若将少量Cl2通入足量FeI2溶液中,将发生的离子反应的方程式是( )
A.2I- +Cl2 = I2+2Cl- B.2Fe2++Cl2 = 2Fe3++2Cl-
同一种还原剂与多种氧化剂混合时,(还原剂)会先与氧化性强的物质反应。
A
教学内容
例8. 今有三个氧化还原反应:
① 16HCl+2KMnO4 = 2KCl+2MnCl2+5Cl2↑+8H2O
② 2FeCl3+2KI = 2FeCl2 +2KCl +I2
③ 2FeCl2 +Cl2 = 2FeCl3
若某溶液中有Fe2+和Cl-、I-共存,要氧化除去I-而又不影响Fe2+和Cl-,可加入的试剂是( )
A. KMnO4 B. Cl2 C. FeCl3 D.HCl
C
题型四
氧化性、还原性强弱的运用
教学内容
失去 e-
得到 e-
2×
(1)双线桥法
2Na + Cl2 = 2NaCl
0
+1
0
-1
2×
题型五
表示电子转移的方向和数目
“得失电子守恒”
随堂练习
例9.用双线桥标出电子转移的方向和数目
2KMnO4 +16HCl = 2KCl + 2MnCl2 + 5Cl2 ↑+8 H2O
失去10×e-
得到2×5e-
教学内容
转移
(2)单线桥法
2Na + Cl2 = 2NaCl
0
+1
0
-1
2e-
题型五
表示电子转移的方向和数目
随堂练习
例10.用单线桥标出电子转移的方向和数目
2KMnO4 +16HCl = 2KCl + 2MnCl2 + 5Cl2 ↑+8 H2O
转移10e-
教学内容
操作步骤:
题型六
方程式配平
(1)先根据“得失电子守恒”配平有化合价发生变化的物质的化学计量数(即物质的“系数”)。
(2)再根据“电荷守恒”(适用于离子方程式)、“质量守恒”等配平剩余物质的化学计量数。
KMnO4 + HCl —— KCl + MnCl2 + Cl2 ↑+ H2O
教学内容
例11.已知在碱性溶液中可发生如下反应:
2M(OH)3+10OH-+3Cl2=2MO4n-+6Cl-+8H2O
则MO4n-中M的化合价是( )
A.+4 B.+5 C.+6 D.+7
题型七
氧化还原反应中的计算
C
例12.当溶液中X2O72-与SO32-数目之比为1:3时正好完全发生氧化还原反应,X在还原产物中的化合价是( )
A.+1 B.+2 C.+3 D.+4
C
教学内容
二、氧化还原反应与四大反应类型的关系
化合反应
氧化还原反应
非氧化还原反应
分解反应
置换反应
复分解反应
试分析以下方程式,完成右图
1.2H2+O2=2H2O
2.2H2O=2H2↑+O2↑
3.CaCO3=CaO+CO2↑
4.CaO+CO2=CaCO3
5.Fe+2HCl=FeCl2+H2↑
6.HCl+AgNO3=AgCl↓+HNO3
点燃
通电
高温
4
1
2
3
5
6
板书设计
1.特征
一、氧化还原反应
氧化还原反应
2.本质
口诀:
升失氧化 还原剂;降得还原 氧化剂
3.反应规律
二、氧化还原反应与四大反应类型的关系
课后作业
完成《世纪金榜》作业本P90
氧化还原反应
教学目标
1.明确氧化还原反应的相关概念及规律
教学目标:
2.强化氧化还原反应常见题型的解题技巧
本节重、难点
1.氧化还原反应的规律
教学重、难点:
2.氧化还原反应常见题型的解题技巧
学前导入
在前面,我们学习了很多的反应,按照反应前后物质的种类和数目,我们可以将反应分为哪些反应类型呢?
化合反应
分解反应
置换反应
复分解反应
学前导入
Fe2O3 + 3CO 2Fe + 3CO2
?
氧化还原反应
非氧化还原反应
教学内容
1.特征
一、氧化还原反应
元素化合价发生变化
Fe2O3 + 3CO 2Fe + 3CO2
属于氧化还原反应
教学内容
1、 Fe2O3+6HCl==2FeCl3+3H2O
2、2KClO3 == 2KCl+3O2 ↑
加热
5、2O3==3O2
3、Zn + H2SO4 = ZnSO4 + H2 ↑
哪些是氧化还原反应?
7、CuSO4 + 2NaOH==Na2SO4 +Cu(OH)2
6、2NaI+ Cl2 == 2NaCl + I2
高温
4、CaCO3 == CaO + CO2 ↑
√
√
√
教学内容
1.特征
一、氧化还原反应
元素化合价发生变化
2.本质
电子的转移
电子的得、失
电子的偏向、偏离
教学内容
得电子的物质,叫做氧化剂
氧化剂得到电子后,元素的化合价会降低,所以我们也将有元素化合价降低的物质,叫做氧化剂
失电子的物质,叫做还原剂
还原剂失去电子后,元素的化合价会升高,所以我们也将有元素化合价升高的物质,叫做还原剂
氧化剂具有氧化性
还原剂具有还原性
2Na + Cl2 = 2NaCl
还原剂
氧化剂
0
+1
0
-1
思考:元素处于最高价只有什么性?处于最低价呢?处于中间价态呢?
教学内容
3.反应规律
一、氧化还原反应
强氧化性物质 + 强还原性物质 =弱还原性物质 + 弱氧化性物质
得到电子
化合价降低
口诀:
升失氧化 还原剂;降得还原 氧化剂
被还原
发生还原反应
失去电子
化合价升高
被氧化
发生氧化反应
(氧化剂)
(还原剂)
(还原产物)
(氧化产物)
教学内容
题型一
例1. 下列反应中属于氧化还原反应的是:( )
A. NaOH+HCl=NaCl+H2O
B. 2KI+Br2=2KBr+I2
C. MgO+2HCl=MgCl2+H2O
D. SO3+H2O=H2SO4
氧化还原反应的判断
B
题型二
例2. 在化学反应2KI+Br2=2KBr+I2中,氧化剂是:( )
A. KI B. Br2 C. KBr D. I2
氧化剂、还原剂的判断
B
教学内容
(1)Zn+CuSO4 = Cu+ZnSO4
例4.请指出下列氧化还原反应中氧化剂、还原剂。
(2)Fe2O3+3CO == 2Fe+3CO2
高温
(3)MnO2+4HCl(浓) = MnCl2+Cl2↑+2H2O
Δ
(4)2KClO3 = 2KCl+3O2 ↑
Δ
B
例3.下列变化过程中,加入氧化剂才能实现的是:( )
A. Cl2→Cl- B. I-→I2
C. SO2→SO32- D. CuO→Cu
教学内容
题型三
例5. 常温下,可发生下列几种反应:
① 16H++10Cl-+2MnO4- = 2Mn2++5Cl2↑+8H2O
② 2Br-+Cl2 = Br2+2Cl-
分析上述反应,氧化性强弱顺序正确的是( )
A. MnO4- >Cl2>Br2
B. Br2>Cl2>MnO4-
C. Cl2>MnO4- >Br2
D. Cl2>Br2>MnO4-
氧化性、还原性强弱的判断
A
教学内容
题型四
例6. 已知常温下,有氧化性强弱顺序为MnO4- >Cl2>Br2>Fe3+ 的几种微粒参与下列反应,其中不能发生的反应是:( )
A. 2Br - +Cl2 = Br2+2Cl-
B. 2Fe3++2Br- = 2Fe2++Br2
C. 16H++10Cl-+2MnO4- = 2Mn2++5Cl2↑+8H2O
D. 2Fe2++Cl2 = 2Fe3++2Cl-
氧化性、还原性强弱的运用
B
教学内容
题型四
氧化性、还原性强弱的运用
同一种氧化剂与多种还原剂混合时,(氧化剂)会先与还原性强的物质反应。
例7.已知Cl2能与I-、Fe2+发生氧化还原反应,且有还原性:I->Fe2+,则若将少量Cl2通入足量FeI2溶液中,将发生的离子反应的方程式是( )
A.2I- +Cl2 = I2+2Cl- B.2Fe2++Cl2 = 2Fe3++2Cl-
同一种还原剂与多种氧化剂混合时,(还原剂)会先与氧化性强的物质反应。
A
教学内容
例8. 今有三个氧化还原反应:
① 16HCl+2KMnO4 = 2KCl+2MnCl2+5Cl2↑+8H2O
② 2FeCl3+2KI = 2FeCl2 +2KCl +I2
③ 2FeCl2 +Cl2 = 2FeCl3
若某溶液中有Fe2+和Cl-、I-共存,要氧化除去I-而又不影响Fe2+和Cl-,可加入的试剂是( )
A. KMnO4 B. Cl2 C. FeCl3 D.HCl
C
题型四
氧化性、还原性强弱的运用
教学内容
失去 e-
得到 e-
2×
(1)双线桥法
2Na + Cl2 = 2NaCl
0
+1
0
-1
2×
题型五
表示电子转移的方向和数目
“得失电子守恒”
随堂练习
例9.用双线桥标出电子转移的方向和数目
2KMnO4 +16HCl = 2KCl + 2MnCl2 + 5Cl2 ↑+8 H2O
失去10×e-
得到2×5e-
教学内容
转移
(2)单线桥法
2Na + Cl2 = 2NaCl
0
+1
0
-1
2e-
题型五
表示电子转移的方向和数目
随堂练习
例10.用单线桥标出电子转移的方向和数目
2KMnO4 +16HCl = 2KCl + 2MnCl2 + 5Cl2 ↑+8 H2O
转移10e-
教学内容
操作步骤:
题型六
方程式配平
(1)先根据“得失电子守恒”配平有化合价发生变化的物质的化学计量数(即物质的“系数”)。
(2)再根据“电荷守恒”(适用于离子方程式)、“质量守恒”等配平剩余物质的化学计量数。
KMnO4 + HCl —— KCl + MnCl2 + Cl2 ↑+ H2O
教学内容
例11.已知在碱性溶液中可发生如下反应:
2M(OH)3+10OH-+3Cl2=2MO4n-+6Cl-+8H2O
则MO4n-中M的化合价是( )
A.+4 B.+5 C.+6 D.+7
题型七
氧化还原反应中的计算
C
例12.当溶液中X2O72-与SO32-数目之比为1:3时正好完全发生氧化还原反应,X在还原产物中的化合价是( )
A.+1 B.+2 C.+3 D.+4
C
教学内容
二、氧化还原反应与四大反应类型的关系
化合反应
氧化还原反应
非氧化还原反应
分解反应
置换反应
复分解反应
试分析以下方程式,完成右图
1.2H2+O2=2H2O
2.2H2O=2H2↑+O2↑
3.CaCO3=CaO+CO2↑
4.CaO+CO2=CaCO3
5.Fe+2HCl=FeCl2+H2↑
6.HCl+AgNO3=AgCl↓+HNO3
点燃
通电
高温
4
1
2
3
5
6
板书设计
1.特征
一、氧化还原反应
氧化还原反应
2.本质
口诀:
升失氧化 还原剂;降得还原 氧化剂
3.反应规律
二、氧化还原反应与四大反应类型的关系
课后作业
完成《世纪金榜》作业本P90
