2021-2022学年高一上学期化学人教版(2019)必修第一册第三章《铁金属材料》测试题 (含答案)
文档属性
| 名称 | 2021-2022学年高一上学期化学人教版(2019)必修第一册第三章《铁金属材料》测试题 (含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 353.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-17 15:17:10 | ||
图片预览




文档简介
第三章《铁金属材料》测试题
一、单选题(共15题)
1.下列化合物中,不能通过两种单质间直接制取的是
A.HCl B.FeCl2 C.MgCl2 D.Na2O2
2.下列有关水的说法中,不正确的是
A.煮沸可以降低水的硬度 B.用肥皂水可鉴别硬水和软水
C.在净水过程中明矾作消毒杀菌剂 D.在净水过程中用活性炭吸附杂质
3.明代《造强水法》记载“绿矾五斤,硝五斤,将矾炒去,约折五分之一,将二味同研细,锅下起火,取气冷定,开坛则药化为水。用水入五金皆成水,惟黄金不化水中。”文中的“硝”即硝酸钾。下列说法错误的是
A.“绿矾”的成分为FeSO4
B.“研细”可在研钵中进行
C.“开坛则药化为水”,“水”的主要成分是硝酸
D.“五金皆成水”,发生氧化还原反应
4.已知2Fe3++Fe=3Fe2+,将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+个数相等,则已反应的Fe3+和未反应的Fe3+的个数之比是
A.2:3 B.3:2 C.1:2 D.1:1
5.下列离子方程式书写正确的是
A.铜与稀盐酸反应:Cu+2H+=Cu2++H2↑
B.硝酸银溶液中加入铁粉:3Ag++Fe=Fe3++3Ag
C.氧化铜与盐酸反应:O2- +2H+=H2O
D.碳酸镁与稀硫酸反应:MgCO3+2H+=Mg2++H2O+CO2↑
6.下列有关实验的叙述正确的是
A.取某固体试样溶于盐酸,滴加KSCN溶液不变红,说明该固体中一定不存在
B.取某溶液试样进行焰色试验,通过蓝色钴玻璃观察火焰呈紫色,则其为钾盐溶液
C.往某溶液试样中滴加酚酞试液,溶液变红色,则该溶液一定是碱溶液
D.取某溶液试样加足量硝酸无现象,再加溶液产生白色沉淀,则原溶液中存在
7.下列有关物质的性质与用途对应关系错误的是
A.氨气易液化,常用作制冷剂
B.易溶于水,可用于电解冶炼金属铝
C.氯气具有强氧化性,可用于自来水的杀菌消毒
D.稀盐酸具有酸的通性,可用于铜器表面除锈
8.氧气转炉炼钢工艺可以利用废氧化铁经过必要的造球、码垛堆集或烧结工艺处理。将石灰与废氧化铁加工成适当的团状,然后用水雾进行水化,最后在铺满铁皮球的填料床上通入进行硬化。硬化后的铁皮球耐压、耐磨、下落强度都有很大的提高。下面关于上述过程的说法错误的是
A.用水雾进行水化发生的离子反应方程式为:
B.通入进行硬化发生的化学反应方程式为:
C.硬化后的铁皮球浸入盐酸溶液发生的离子反应方程式为:
D.该方法用废氧化铁代替铁矿石,对金属资源进行了循环利用
9.将一定质量Mg、Zn、Al的混合物与足量稀硫酸反应,生成H2 5.6L(标准状况),则原混合物的质量不可能是
A.4.4g B.8.2g C.12.7g D.15.8g
10.ag单质碳和16g氧气在恒容密闭容器中反应生成CO、,当恢复到原来的温度时,测得容器内的压强增大了0.8倍,下列数据不可能是
A. B.
C. D.
11.纳米材料Cu2O在光电领域有广泛应用,以硫酸厂的废渣(主要成分是CuO,含少量的Fe3O4、Fe2O3、SiO2、Al2O3等)为原料制备Cu2O的流程如图所示,已知:“还原”中氧化产物对环境友好。
下列判断正确的是
A.“酸浸”时未发生氧化还原反应
B.“除杂”得到的滤渣的主要成分是Fe2O3和Al2O3
C.试剂A可能是H2O2
D.制备14.4gCu2O至少需要0.8gN2H4
12.向某溶液中投入铝片后有大量产生,则溶液中一定能大量存在的离子是
A. B. C. D.
13.某废催化剂含SiO2、ZnS、CuS及少量的Fe3O4.某实验小组以该废催化剂为原料,制备锌和铜的硫酸盐的结晶水合物,设计实验流程如下:
下列说法正确的是
A.步骤①操作中,生成的气体需用NaOH溶液或CuSO4溶液吸收
B.步骤②操作中,应先加6%H2O2,然后不断搅拌下缓慢加入1.0mol·L-1H2SO4
C.滤渣1成分是SiO2和CuS,滤渣2成分只有SiO2
D.检验滤液1中是否含有Fe2+,可以选用KSCN溶液和新制的氯水
14.同温同压下,等质量的三种常见金属M、N、P分别与足量的稀盐酸反应,产生的体积分别为、、。下列说法正确的是
A.转移的电子数之比一定为 B.M消耗酸的物质的量一定为
C.化合价之比一定为 D.金属的相对原子质量之比一定为
15.以高硫铝土矿(主要成分为Fe2O3、Al2O3、SiO2,少量FeS2和硫酸盐)为原料制备聚合硫酸铁[Fe2(OH)x(SO4)y]n和明矾的部分工艺流程如下,下列说法错误的是
已知:赤泥液的主要成分为Na2CO3。
A.赤泥液的作用是吸收“焙烧”阶段中产生的SO2
B.聚合硫酸铁可用于净化自来水,与其组成中的Fe3+具有氧化性有关
C.在“聚合”阶段,若增加Fe2O3用量,会使[Fe2(OH)x(SO4)y]n中x变大
D.从“滤液”到“明矾”的过程中还应有“除硅”步骤
二、填空题(共8题)
16.铁粉放入足量的稀硫酸中,铁粉完全反应。回答下列问题:
(1)反应的化学方程式是_______。
(2)反应消耗的物质的量是_______。
(3)标准状况下,生成气体的体积是_______。
17.铁是应用广泛的金属之一,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)下列物质中,属于强电解质的有___________ (填序号)。
A.铜丝 B.烧碱 C.盐酸 D.BaSO4 E.水玻璃
(2)已知实验室可选用K2Cr2O7与浓盐酸反应制备Cl2,写出该反应的离子方程式并用双线桥表示电子转移的方向和数目为___________
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在K2FeO4中铁元素的化合价为___________,FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为___________。
(4)实验室常用___________(写名称)检验Fe3+使溶液显红色,写出该反应的离子方程式:___________;工业上还可以用FeCl3溶液来腐蚀印刷电路板上的铜,向反应所得的溶液中加入一定量的锌粉充分反应后,从理论上分析,下列说法合理的是___________。(填序号)。
A.若无固体剩余,则溶液中可能含有Fe3+、Cu2+、Fe2+、Zn2+四种离子
B.若溶液中有Cu2+,则体系中一定没有固体剩余
C.若有固体剩余,则溶液中一定有反应发生
D.当溶液中有Fe2+存在时,则一定没有Cu析出
(5)某课题小组采用离子交换和滴定的方法来测定铁的某氯化物FeClx的化学式。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol/L的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出FeClx中x的值为___________(取整数)。
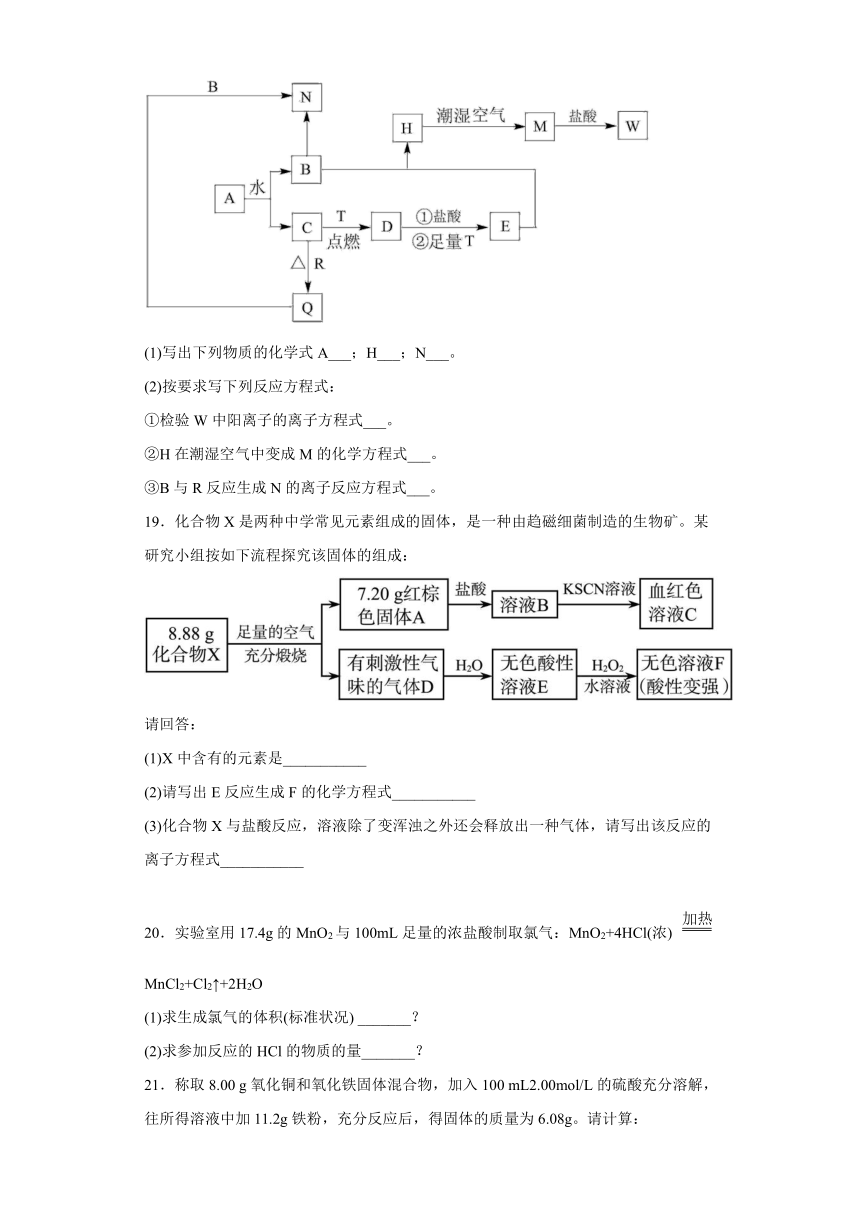
18.已知:A为淡黄色固体,T、R为两种常见的前途很广金属单质,D是具有磁性的黑色晶体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
(1)写出下列物质的化学式A___;H___;N___。
(2)按要求写下列反应方程式:
①检验W中阳离子的离子方程式___。
②H在潮湿空气中变成M的化学方程式___。
③B与R反应生成N的离子反应方程式___。
19.化合物X是两种中学常见元素组成的固体,是一种由趋磁细菌制造的生物矿。某研究小组按如下流程探究该固体的组成:
请回答:
(1)X中含有的元素是___________
(2)请写出E反应生成F的化学方程式___________
(3)化合物X与盐酸反应,溶液除了变浑浊之外还会释放出一种气体,请写出该反应的离子方程式___________
20.实验室用17.4g的MnO2与100mL足量的浓盐酸制取氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(1)求生成氯气的体积(标准状况) _______?
(2)求参加反应的HCl的物质的量_______?
21.称取8.00 g氧化铜和氧化铁固体混合物,加入100 mL2.00mol/L的硫酸充分溶解,往所得溶液中加11.2g铁粉,充分反应后,得固体的质量为6.08g。请计算:
(1)加入铁粉充分反应后,溶液中溶质的物质的量_______。
(2)固体混合物中氧化铜的质量_______。
22.莫尔盐[(NH4)2Fe(SO4)2 6H2O]是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某学习小组利用铁屑、稀硫酸和硫酸铵为原料设计如图实验制备少量的莫尔盐并测定其纯度。
已知:铁屑中含有硫、磷等杂质,与硫酸反应生成具有刺激性气味的H2S、PH3。
回答下列问题:
Ⅰ.制取莫尔盐
(1)如图所示连接装置,检查装置气密性。将0.1mol(NH4)2SO4晶体置于玻璃仪器___(填仪器名称)中,将6.0g洁净铁屑加入锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开活塞K1和K2,加入55.0mL2mol/L稀硫酸后关闭K1,该步骤的目的是___并制备FeSO4。
②待大部分铁屑溶解后,打开活塞K3、关闭活塞K2,此时可以看到的现象为___。
③关闭活塞K2、K3,采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶,过滤,用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的pH在1~2之间,其目的为___。
④装置C的作用为___,装置C存在的缺陷是___。
Ⅱ.测定莫尔盐样品的纯度
取mg该样品配制成1L溶液,分别设计如下两个实验方案,请回答:
方案一:取20.00mL所配(NH4)2Fe(SO4)2溶液用0.1000 mol L 1酸性K2Cr2O7溶液进行滴定,重复三次。
(3)写出此反应的离子方程式___。
方案二:取20.00mL所配(NH4)2Fe(SO4)2溶液进行如下实验。(相对质量(NH4)2Fe(SO4)2 6H2O:392,BaSO4:233)
待测液→加入足量的BaCl2溶液→过滤→洗涤→干燥→称量→wg固体。
(4)莫尔盐晶体纯度为____。(用含m、w的式子表示,不需化简)。
23.某种催化剂为铁的氧化物。化学兴趣小组对该催化剂中铁元素的价态进行了探究。请回答下列实验方案中的有关问题:
(一)实验仪器与试剂
仪器:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;
试剂:3mol·L-1H2SO4、6mol·L-1HNO3、0.01mol·L-1KMnO4、NaOH稀溶液、20%KSCN溶液、蒸馏水。
(二)实验原理
Fe2+能使酸性KMnO4溶液紫色褪去;Fe3+溶液中滴加KSCN溶液变红色。
(1)一位同学将少许样品溶于稀硝酸中,取少许溶液滴加KSCN溶液后出现红色。由此得出为铁元素为+3价的结论。该结论是否合理并说明理由___。
(三)实验设计
(2)提出合理假设。
假设1:催化剂中铁元素全部为+3价;
假设2:催化剂中铁元素全部为+2价;
假设3:___。
(3)设计实验证明假设。请完成下表中的实验操作步骤,预期现象与结论。
实验操作步骤 预期现象与结论
步骤1:用滴管取一定量3mol·L-1H2SO4于试管中,___数分钟以出去溶于其中的氧气。 无明显现象
步骤2:用药匙取少量样品于试管中,用滴管加入除氧的3mol·L-1H2SO4,并加热,充分反应后得A溶液。 固体溶解,溶液颜色发生变化
步骤3:取少许A溶液于试管中___ 若溶液不呈红色,则假设2成立;若___
步骤4:另取少许A溶液于试管中,___ 结合③,若___
参考答案
1.B 2.C 3.A 4.A 5.D 6.D 7.B 8.C 9.A 10.A 11.C 12.B 13.A 14.A 15.B
16.(1)
(2)0.1
(3)2.24
17.(1)BD
(2)
(3) +6
(4) 硫氰化钾 Fe3++3SCN- Fe(SCN)3. AC
(5)3
18.Na2O2 Fe(OH)2 NaAlO2 Fe3++3SCN-=Fe(SCN)3 4Fe(OH)2+O2+2H2O═4Fe(OH)3 2Al+2H2O+2OH-═2AlO+3H2↑
19.、S
20.4.48L 0.8mol
21.0.200 mol 4.80 g
22.(1)三颈烧瓶
(2) 排尽装置中的空气 浅绿色溶液会流入B 抑制亚铁离子水解 液封作用,防止空气进入B装置氧化Fe2+ 不能吸收H2S,PH3等尾气
(3)6Fe2++Cr2O+14H+=6Fe3++2Cr3++7H2O
(4)×100%
23.(1)不合理。因为HNO3会氧化催化剂中可能存在的二价铁,而不能确定样品中铁元素的价态
(2)催化剂中铁元素同时存在+2与+3价
(3) 加热煮沸 滴加1~2滴20%KSCN溶液,振荡 若溶液呈红色,则假设1或假设3成立 滴加1~2滴0.01mol·L-1KMnO4溶液,振荡 若溶液呈紫红色,则假设1成立;若溶液紫红色褪去,则假设3成立
一、单选题(共15题)
1.下列化合物中,不能通过两种单质间直接制取的是
A.HCl B.FeCl2 C.MgCl2 D.Na2O2
2.下列有关水的说法中,不正确的是
A.煮沸可以降低水的硬度 B.用肥皂水可鉴别硬水和软水
C.在净水过程中明矾作消毒杀菌剂 D.在净水过程中用活性炭吸附杂质
3.明代《造强水法》记载“绿矾五斤,硝五斤,将矾炒去,约折五分之一,将二味同研细,锅下起火,取气冷定,开坛则药化为水。用水入五金皆成水,惟黄金不化水中。”文中的“硝”即硝酸钾。下列说法错误的是
A.“绿矾”的成分为FeSO4
B.“研细”可在研钵中进行
C.“开坛则药化为水”,“水”的主要成分是硝酸
D.“五金皆成水”,发生氧化还原反应
4.已知2Fe3++Fe=3Fe2+,将适量铁粉放入FeCl3溶液中,完全反应后,溶液中的Fe2+和Fe3+个数相等,则已反应的Fe3+和未反应的Fe3+的个数之比是
A.2:3 B.3:2 C.1:2 D.1:1
5.下列离子方程式书写正确的是
A.铜与稀盐酸反应:Cu+2H+=Cu2++H2↑
B.硝酸银溶液中加入铁粉:3Ag++Fe=Fe3++3Ag
C.氧化铜与盐酸反应:O2- +2H+=H2O
D.碳酸镁与稀硫酸反应:MgCO3+2H+=Mg2++H2O+CO2↑
6.下列有关实验的叙述正确的是
A.取某固体试样溶于盐酸,滴加KSCN溶液不变红,说明该固体中一定不存在
B.取某溶液试样进行焰色试验,通过蓝色钴玻璃观察火焰呈紫色,则其为钾盐溶液
C.往某溶液试样中滴加酚酞试液,溶液变红色,则该溶液一定是碱溶液
D.取某溶液试样加足量硝酸无现象,再加溶液产生白色沉淀,则原溶液中存在
7.下列有关物质的性质与用途对应关系错误的是
A.氨气易液化,常用作制冷剂
B.易溶于水,可用于电解冶炼金属铝
C.氯气具有强氧化性,可用于自来水的杀菌消毒
D.稀盐酸具有酸的通性,可用于铜器表面除锈
8.氧气转炉炼钢工艺可以利用废氧化铁经过必要的造球、码垛堆集或烧结工艺处理。将石灰与废氧化铁加工成适当的团状,然后用水雾进行水化,最后在铺满铁皮球的填料床上通入进行硬化。硬化后的铁皮球耐压、耐磨、下落强度都有很大的提高。下面关于上述过程的说法错误的是
A.用水雾进行水化发生的离子反应方程式为:
B.通入进行硬化发生的化学反应方程式为:
C.硬化后的铁皮球浸入盐酸溶液发生的离子反应方程式为:
D.该方法用废氧化铁代替铁矿石,对金属资源进行了循环利用
9.将一定质量Mg、Zn、Al的混合物与足量稀硫酸反应,生成H2 5.6L(标准状况),则原混合物的质量不可能是
A.4.4g B.8.2g C.12.7g D.15.8g
10.ag单质碳和16g氧气在恒容密闭容器中反应生成CO、,当恢复到原来的温度时,测得容器内的压强增大了0.8倍,下列数据不可能是
A. B.
C. D.
11.纳米材料Cu2O在光电领域有广泛应用,以硫酸厂的废渣(主要成分是CuO,含少量的Fe3O4、Fe2O3、SiO2、Al2O3等)为原料制备Cu2O的流程如图所示,已知:“还原”中氧化产物对环境友好。
下列判断正确的是
A.“酸浸”时未发生氧化还原反应
B.“除杂”得到的滤渣的主要成分是Fe2O3和Al2O3
C.试剂A可能是H2O2
D.制备14.4gCu2O至少需要0.8gN2H4
12.向某溶液中投入铝片后有大量产生,则溶液中一定能大量存在的离子是
A. B. C. D.
13.某废催化剂含SiO2、ZnS、CuS及少量的Fe3O4.某实验小组以该废催化剂为原料,制备锌和铜的硫酸盐的结晶水合物,设计实验流程如下:
下列说法正确的是
A.步骤①操作中,生成的气体需用NaOH溶液或CuSO4溶液吸收
B.步骤②操作中,应先加6%H2O2,然后不断搅拌下缓慢加入1.0mol·L-1H2SO4
C.滤渣1成分是SiO2和CuS,滤渣2成分只有SiO2
D.检验滤液1中是否含有Fe2+,可以选用KSCN溶液和新制的氯水
14.同温同压下,等质量的三种常见金属M、N、P分别与足量的稀盐酸反应,产生的体积分别为、、。下列说法正确的是
A.转移的电子数之比一定为 B.M消耗酸的物质的量一定为
C.化合价之比一定为 D.金属的相对原子质量之比一定为
15.以高硫铝土矿(主要成分为Fe2O3、Al2O3、SiO2,少量FeS2和硫酸盐)为原料制备聚合硫酸铁[Fe2(OH)x(SO4)y]n和明矾的部分工艺流程如下,下列说法错误的是
已知:赤泥液的主要成分为Na2CO3。
A.赤泥液的作用是吸收“焙烧”阶段中产生的SO2
B.聚合硫酸铁可用于净化自来水,与其组成中的Fe3+具有氧化性有关
C.在“聚合”阶段,若增加Fe2O3用量,会使[Fe2(OH)x(SO4)y]n中x变大
D.从“滤液”到“明矾”的过程中还应有“除硅”步骤
二、填空题(共8题)
16.铁粉放入足量的稀硫酸中,铁粉完全反应。回答下列问题:
(1)反应的化学方程式是_______。
(2)反应消耗的物质的量是_______。
(3)标准状况下,生成气体的体积是_______。
17.铁是应用广泛的金属之一,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)下列物质中,属于强电解质的有___________ (填序号)。
A.铜丝 B.烧碱 C.盐酸 D.BaSO4 E.水玻璃
(2)已知实验室可选用K2Cr2O7与浓盐酸反应制备Cl2,写出该反应的离子方程式并用双线桥表示电子转移的方向和数目为___________
(3)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池的电极材料。在K2FeO4中铁元素的化合价为___________,FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为___________。
(4)实验室常用___________(写名称)检验Fe3+使溶液显红色,写出该反应的离子方程式:___________;工业上还可以用FeCl3溶液来腐蚀印刷电路板上的铜,向反应所得的溶液中加入一定量的锌粉充分反应后,从理论上分析,下列说法合理的是___________。(填序号)。
A.若无固体剩余,则溶液中可能含有Fe3+、Cu2+、Fe2+、Zn2+四种离子
B.若溶液中有Cu2+,则体系中一定没有固体剩余
C.若有固体剩余,则溶液中一定有反应发生
D.当溶液中有Fe2+存在时,则一定没有Cu析出
(5)某课题小组采用离子交换和滴定的方法来测定铁的某氯化物FeClx的化学式。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol/L的盐酸滴定,滴定至终点时消耗盐酸25.00mL。通过计算求出FeClx中x的值为___________(取整数)。
18.已知:A为淡黄色固体,T、R为两种常见的前途很广金属单质,D是具有磁性的黑色晶体,H是白色沉淀,且在潮湿空气中迅速变为灰绿色,最终变为红褐色固体。
(1)写出下列物质的化学式A___;H___;N___。
(2)按要求写下列反应方程式:
①检验W中阳离子的离子方程式___。
②H在潮湿空气中变成M的化学方程式___。
③B与R反应生成N的离子反应方程式___。
19.化合物X是两种中学常见元素组成的固体,是一种由趋磁细菌制造的生物矿。某研究小组按如下流程探究该固体的组成:
请回答:
(1)X中含有的元素是___________
(2)请写出E反应生成F的化学方程式___________
(3)化合物X与盐酸反应,溶液除了变浑浊之外还会释放出一种气体,请写出该反应的离子方程式___________
20.实验室用17.4g的MnO2与100mL足量的浓盐酸制取氯气:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
(1)求生成氯气的体积(标准状况) _______?
(2)求参加反应的HCl的物质的量_______?
21.称取8.00 g氧化铜和氧化铁固体混合物,加入100 mL2.00mol/L的硫酸充分溶解,往所得溶液中加11.2g铁粉,充分反应后,得固体的质量为6.08g。请计算:
(1)加入铁粉充分反应后,溶液中溶质的物质的量_______。
(2)固体混合物中氧化铜的质量_______。
22.莫尔盐[(NH4)2Fe(SO4)2 6H2O]是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某学习小组利用铁屑、稀硫酸和硫酸铵为原料设计如图实验制备少量的莫尔盐并测定其纯度。
已知:铁屑中含有硫、磷等杂质,与硫酸反应生成具有刺激性气味的H2S、PH3。
回答下列问题:
Ⅰ.制取莫尔盐
(1)如图所示连接装置,检查装置气密性。将0.1mol(NH4)2SO4晶体置于玻璃仪器___(填仪器名称)中,将6.0g洁净铁屑加入锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开活塞K1和K2,加入55.0mL2mol/L稀硫酸后关闭K1,该步骤的目的是___并制备FeSO4。
②待大部分铁屑溶解后,打开活塞K3、关闭活塞K2,此时可以看到的现象为___。
③关闭活塞K2、K3,采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶,过滤,用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的pH在1~2之间,其目的为___。
④装置C的作用为___,装置C存在的缺陷是___。
Ⅱ.测定莫尔盐样品的纯度
取mg该样品配制成1L溶液,分别设计如下两个实验方案,请回答:
方案一:取20.00mL所配(NH4)2Fe(SO4)2溶液用0.1000 mol L 1酸性K2Cr2O7溶液进行滴定,重复三次。
(3)写出此反应的离子方程式___。
方案二:取20.00mL所配(NH4)2Fe(SO4)2溶液进行如下实验。(相对质量(NH4)2Fe(SO4)2 6H2O:392,BaSO4:233)
待测液→加入足量的BaCl2溶液→过滤→洗涤→干燥→称量→wg固体。
(4)莫尔盐晶体纯度为____。(用含m、w的式子表示,不需化简)。
23.某种催化剂为铁的氧化物。化学兴趣小组对该催化剂中铁元素的价态进行了探究。请回答下列实验方案中的有关问题:
(一)实验仪器与试剂
仪器:烧杯、试管、玻璃棒、药匙、滴管、酒精灯、试管夹;
试剂:3mol·L-1H2SO4、6mol·L-1HNO3、0.01mol·L-1KMnO4、NaOH稀溶液、20%KSCN溶液、蒸馏水。
(二)实验原理
Fe2+能使酸性KMnO4溶液紫色褪去;Fe3+溶液中滴加KSCN溶液变红色。
(1)一位同学将少许样品溶于稀硝酸中,取少许溶液滴加KSCN溶液后出现红色。由此得出为铁元素为+3价的结论。该结论是否合理并说明理由___。
(三)实验设计
(2)提出合理假设。
假设1:催化剂中铁元素全部为+3价;
假设2:催化剂中铁元素全部为+2价;
假设3:___。
(3)设计实验证明假设。请完成下表中的实验操作步骤,预期现象与结论。
实验操作步骤 预期现象与结论
步骤1:用滴管取一定量3mol·L-1H2SO4于试管中,___数分钟以出去溶于其中的氧气。 无明显现象
步骤2:用药匙取少量样品于试管中,用滴管加入除氧的3mol·L-1H2SO4,并加热,充分反应后得A溶液。 固体溶解,溶液颜色发生变化
步骤3:取少许A溶液于试管中___ 若溶液不呈红色,则假设2成立;若___
步骤4:另取少许A溶液于试管中,___ 结合③,若___
参考答案
1.B 2.C 3.A 4.A 5.D 6.D 7.B 8.C 9.A 10.A 11.C 12.B 13.A 14.A 15.B
16.(1)
(2)0.1
(3)2.24
17.(1)BD
(2)
(3) +6
(4) 硫氰化钾 Fe3++3SCN- Fe(SCN)3. AC
(5)3
18.Na2O2 Fe(OH)2 NaAlO2 Fe3++3SCN-=Fe(SCN)3 4Fe(OH)2+O2+2H2O═4Fe(OH)3 2Al+2H2O+2OH-═2AlO+3H2↑
19.、S
20.4.48L 0.8mol
21.0.200 mol 4.80 g
22.(1)三颈烧瓶
(2) 排尽装置中的空气 浅绿色溶液会流入B 抑制亚铁离子水解 液封作用,防止空气进入B装置氧化Fe2+ 不能吸收H2S,PH3等尾气
(3)6Fe2++Cr2O+14H+=6Fe3++2Cr3++7H2O
(4)×100%
23.(1)不合理。因为HNO3会氧化催化剂中可能存在的二价铁,而不能确定样品中铁元素的价态
(2)催化剂中铁元素同时存在+2与+3价
(3) 加热煮沸 滴加1~2滴20%KSCN溶液,振荡 若溶液呈红色,则假设1或假设3成立 滴加1~2滴0.01mol·L-1KMnO4溶液,振荡 若溶液呈紫红色,则假设1成立;若溶液紫红色褪去,则假设3成立
