第七单元 燃料及其利用 单元测试卷(二) 2021-2022学年人教版初中化学九年级上册(含解析)
文档属性
| 名称 | 第七单元 燃料及其利用 单元测试卷(二) 2021-2022学年人教版初中化学九年级上册(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 209.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-15 23:24:24 | ||
图片预览



文档简介
2021-2022学年度初中化学九年级上册第七单元
燃料及其利用测试卷(二)
一、单选题
1.下列关于燃烧与灭火事例的解释错误是
A.炒菜时油锅着火,立即盖上锅盖—隔绝了空气
B.将煤球制成蜂窝状有利于煤的充分燃烧—增大了煤与空气的接触面积
C.如图中铜片上的乒乓球碎片燃烧而滤纸碎片不燃烧—滤纸碎片不是可燃物
D.森林灭火,在火势蔓延的前方砍岀隔离带—清除可燃物
2.每年三月的最后一个星期一是全国中小学安全教育日。下列有关安全知识错误的是
A.严禁携带易燃、易爆物品乘坐火车 B.高层建筑物起火,立即乘电梯撤离
C.从火场中逃生时应有序撤离着火区域D.身上着火不要乱跑,可就地打滚使火熄灭
3.下列不属于缓慢氧化的是
A.铁生锈 B.酿酒 C.食物腐烂 D.蜡烛燃烧
4.长沙市是“资源节约型、环境友好型社会”建设试点城市之一,你认为以下做法与之不相符的是
A.将废弃的稻草就地焚烧
B.积极开发和利用太阳能、风能和核能等能源
C.减少使用一次性木筷
D.研制开发燃料电池汽车,消除机动车尾气污染
5.下列措施或事故处理方法不正确的是
A.进入久未开启的菜窖前,用燃着的蜡烛做“灯火试验”
B.油库着火用水扑灭
C.洒出的酒精在桌上燃烧,立刻用湿抹布扑盖
D.厨房煤气管道泄气,立即关闭阀门并开窗通风
6.推理是化学中一种重要的学习方法,但应具体问题具体对待,否则就会产生错误的结论。下列推理中结论正确的是
A.点燃H2与O2混合气体可能爆炸,则点燃CH4与O2 的混合气体也可能爆炸
B.原子在化学变化中不能再分,则分子在化学变化中不能再分
C.分解反应中都有多种物质生成,则能生成多种物质的反应一定是分解反应
D.燃烧一般都伴随发光和放热现象,则有发光和放热现象的变化都是燃烧
7.关于燃烧的说法中,错误的是
A.都是化学反应 B.都是氧化反应
C.都是化合反应 D.都是放热反应
8.请用所学知识判断下列说法做法正确的是
A.在加油站拨打或接听移动电话
B.遇火灾时打开所有门窗
C.档案资料着火,可用液态二氧化碳扑火
D.只要温度达到可燃物的着火点,可燃物就能燃烧
9.符合化学实验室安全要求的是
A.电气着火用水扑灭 B.不能品尝化学药品味道
C.用剩的化学药品可以带回家 D.浓硫酸沾在皮肤上立即用水冲洗
10.如图为一种烟气脱硫的流程。下列说法不正确的是
A.烟气脱硫能减少酸雨的形成
B.脱硫塔中发生的主要反应为CaS+SO2+O2CaSO4+S
C.理论上,生产过程中无需补充CaS
D.理论上每处理64.0g SO2,可回收32.0g S粉,同时排放出44.0g CO2
二、综合应用题
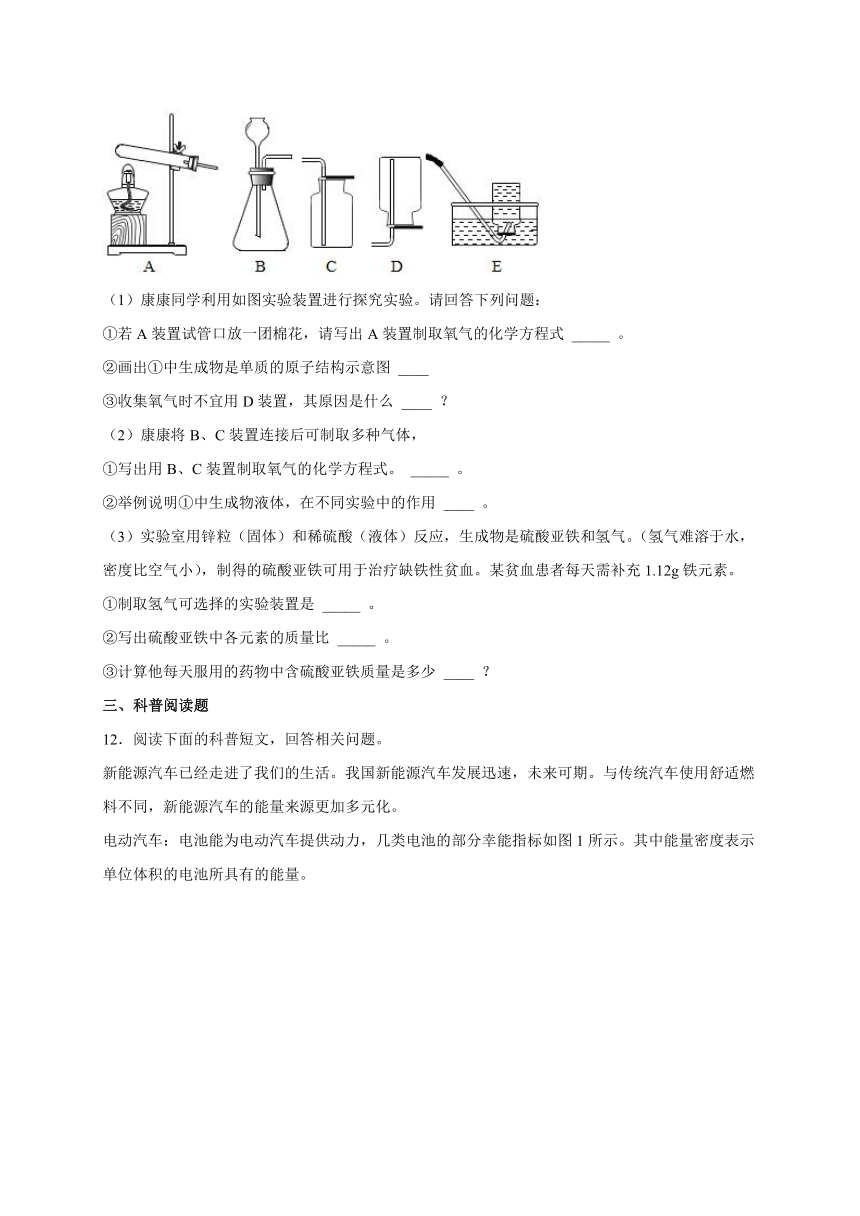
11.化学是以实验为基础的科学,实验是科学探究的重要手段。
(1)康康同学利用如图实验装置进行探究实验。请回答下列问题:
①若A装置试管口放一团棉花,请写出A装置制取氧气的化学方程式 _____ 。
②画出①中生成物是单质的原子结构示意图 ____
③收集氧气时不宜用D装置,其原因是什么 ____ ?
(2)康康将B、C装置连接后可制取多种气体,
①写出用B、C装置制取氧气的化学方程式。 _____ 。
②举例说明①中生成物液体,在不同实验中的作用 ____ 。
(3)实验室用锌粒(固体)和稀硫酸(液体)反应,生成物是硫酸亚铁和氢气。(氢气难溶于水,密度比空气小),制得的硫酸亚铁可用于治疗缺铁性贫血。某贫血患者每天需补充1.12g铁元素。
①制取氢气可选择的实验装置是 _____ 。
②写出硫酸亚铁中各元素的质量比 _____ 。
③计算他每天服用的药物中含硫酸亚铁质量是多少 ____ ?
三、科普阅读题
12.阅读下面的科普短文,回答相关问题。
新能源汽车已经走进了我们的生活。我国新能源汽车发展迅速,未来可期。与传统汽车使用舒适燃料不同,新能源汽车的能量来源更加多元化。
电动汽车:电池能为电动汽车提供动力,几类电池的部分幸能指标如图1所示。其中能量密度表示单位体积的电池所具有的能量。
氢内燃车:氢内燃车以氢气为燃料,不排放任何污染物。氢气可通过电解水(原理如图2)等多种方式获得。据测算,1kg氢气完全燃烧可释放1.43×105kJ的热量,1kg汽油完全燃烧可释放4.6×104kJ的热量。
乙醇汽车:乙醇汽车以乙醇为燃料,乙醇是可再生资源,可以通过发酵甘蔗、玉米等农作物或发酵粮食收割后剩余的秸秆大量提取。
根据以上文章内容回答下列问题:
(1)下列说法正确的是______(填序号)
A 依据图1可知,提高相同能量时,铝空电池的体积最小
B 图2中,A口产生的气体为氢气
C 农业大国盛产甘蔗和玉米,有利于推广乙醇汽车
(2)依据图1,锂电池优于镍氢电池的性能指标是______,锂电池放电将______能转化为______能。
(3)依据测算数据可知,氢内燃车与汽油车相比的优势是______。
(4)下图是制取与贮存氢气的一种方法。ZnFeO在循环制氢体系的总反应中起______作用,反应③的化学方程式为______。
四、填空题
13.仓库突发大火时,消防人员紧急赶到现场。有的用高压水枪灭火其原理主要是________;有的拆除周围仓库制造防火隔离带,其灭火原理又是__________。
14.2021年5月15日,中国“天问”一号探测器成功着陆火星。
(1)“天问”火星探测器通过长征5号运载火箭发射,长征5号火箭使用了液氧,是利用氧气能_________的化学性质,燃烧过程中________能转化为大量热能。
(2)火星拥有丰富的金属矿物和一些资源。火星低层大气的主要成分如下表。
①为鉴别一瓶模拟“火星低层大气”组成的气体和一瓶空气,可采用的操作方法是_________。
气体成分 二氧化碳 氮气 氩气 氧气 其他
体积分数/% 95.32 2.7 1.6 0.13 0.25
②若为满足人类未来在火星上生活,下列研究设想不合理的是__________(填标号)。
a.将CO2转化为O2,提高O2含量
b.将CO2分解转化为N2,提高N2含量
c.寻找水的存在和开发水循环技术
d.利用火星上的金属矿物冶炼金属
(3)化学家提出“镁粉在火星上可以扮演地球上煤的角色”,结合火星低层大气成分推测Mg一定还能在__________气体中燃烧。
五、推断题
15.如图是初中化学中常见物质问的转化关系,其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体。
(1)写出化学式:甲_____;乙_____
(2)写出丙和E反应生成A和B的化学方程式_____
(3)D和A是组成元素相同的化合物,写出D在丁做催化剂条件下,分解生成A和丙的化学方程式:_____
六、实验题
16.下列是初中化学中的一些重要实验,请回答:
(1)A中红磷必须足量的原因是__________;
(2)B中玻璃棒的作用是____________;
(3)C中铜片上的红磷没有燃烧说明燃烧需要的条件之一是_____________。
17.结合下列图示装置,回答有关问题。
(1)写出编号所指仪器的名称:a______;b______。用A装置制取某种气体的一个化学反应文字表达式(或化学方程式)______。
(2)实验室中,用加热高锰酸钾的方法制取气,发生装置可选用______(填标号);用排水法法收集氧气,应如何判断已经集满气体?______。
(3)氢气是最清洁的燃料,它的密度比空气小,难溶于水,实验室常用锌粒与稀硫酸反应来制得。发生装置______,收集氢气的装置可选用______或______。(填标号)
七、科学探究题
18.某化学兴趣小组进行了“寻找新的催化剂”的如下研究性实验
(提出问题)①二氧化锰常用作氯酸钾和过氧化氢分解的催化剂,其他物质是否也可以用作该反应的催化剂呢?
②除了催化剂还有其他因素影响化学反应的速率吗?
(1)(查阅资料)
研究表明,许多物质对氯酸钾的分解有催化作用,分别用它们作催化剂,氯酸钾开始发生反应和反应剧烈时的温度如下表所示:
氧化铁 氧化铝 氧化铜 氧化镁
开始反应 420℃ 515℃ 305℃ 490℃
剧烈反应 490℃ 540℃ 350℃ 545℃
通过分析资料中的数据,实验室用氯酸钾制取氧气,如果不用二氧化锰作催化剂,最好选用的物质是______。
(2)(实验探究一)
①将3g氯酸钾放在试管中加热。
②将3g 氯酸钾与1g二氧化锰混合均匀后加热。
③将xg 氯酸钾与1g氧化铜混合均匀后加热。
④将实验③反应后的固体加水溶解、过滤、洗涤、______、称量,结果为1g。
⑤将实验④后得到1g固体和xg氯酸钾混合均匀后加热,现象与实验③相同。
(3)(分析实验)
a、实验③中x的值应为______。
b、实验④过滤操作中需要的玻璃仪器有烧杯、漏斗、______,它在操作中的作用是______,通过实验④可以得出的结论是______。
c、通过实验⑤可以得出的结论是______。
d、实验②③对比的目的是______。
(实验结论)氧化铜确实也能做氯酸钾分解的催化剂
(4)(实验探究二)
影响化学反应的速率除了催化剂以外,还有其他因素吗?
以下是另一实验小组探究影响过氧化氢反应速率部分因素的相关实验数据。
实验序号 H2O2溶液浓度% H2O2溶液体积/mL 温度℃ MnO2的用量/g 收集氧气的体积/mL 反应所需的时间/s
① 5 1 20 0.1 4 16.75
② 15 1 20 0.1 4 6.04
③ 30 5 35 0 2 49.21
④ 30 5 55 0 2 10.76
a通过实验①和实验②对比可知,化学反应速率还与______有关。
b通过实验③和实验④对比可知,化学反应速率与温度的关系是______。
八、计算题
19.燃气汽车燃料(压缩天然气)主要成分是甲烷(CH4),它在汽车发动机里完全燃烧的化学方程式为:。如果以每公里95g的二氧化碳排放标准,每公里燃烧甲烷的理论值是多少克?(假定压缩天然气中其他成分燃烧不产生二氧化碳;计算结果保留小数点后一位数字)。
20.某纯净物X 32g在160g氧气中充分燃烧,反应的化学方程式为: X + 2O2 CO2 + 2H2O
请完成下列问题:
(1)X的化学式为______________
(2)计算生成二氧化碳的质量为____________ (写出计算过程)
试卷第1页,共3页
参考答案
1.C
【详解】
A、炒菜时油锅着火,立即盖上锅盖—隔绝了空气,破坏燃烧条件,可以灭火,选项正确,不符合题意;
B、燃料充分燃烧要有足够的氧气,将煤球制成蜂窝状有利于煤的充分燃烧—增大了煤与空气的接触面积,选项正确,不符合题意;
C、如图中铜片上的乒乓球碎片燃烧而滤纸碎片不燃烧—铜片上的温度未达到滤纸的着火点,选项错误,符合题意;
D、森林灭火,在火势蔓延的前方砍岀隔离带—清除可燃物,使燃烧停止,选项正确,不符合题意。
故选C。
2.B
【详解】
A.严禁携带易燃、易爆物品乘坐火车,很容易发生火灾和爆炸,选项A正确;
B.高层建筑物起火,不能乘电梯撤离,选项B错误;
C.从火场中逃生时,应有序撤离着火区域,不能乱跑,选项C正确;
D.身上着火要是乱跑,会加速空气流动,提供充足的氧气,火势会更旺,可就地打滚使火熄灭,选项D正确。
故选:B。
3.D
【详解】
A、铁生锈是铁与氧气、水共同作用的结果,属于缓慢氧化,故错误;
B、酿酒反应缓慢甚至不易察觉,属于缓慢氧化,故错误;
C、食物腐烂是食物和氧气发生的缓慢甚至不易察觉的反应,属于缓慢氧化,故错误;
D、蜡烛燃烧是一种发光发热的剧烈的氧化反应,故正确;
故选D。
4.A
【详解】
A、燃烧废弃的稻草会释放出大量有害气体和粉尘,能造成空气二次污染,故A错误;
B、太阳能、风能和核能等是洁净能源可以节能也可以减少污染物,故B正确;
C、减少使用一次性木筷,可以节约能源也可减少污染,故C正确;
D、研制开发燃料电池汽车,推广使用可以节省化石燃料同时减少对大气的污染,故D正确。
故选A。
5.B
【详解】
A、二氧化碳的密度比空气大,会聚集到菜窖内,且二氧化碳不能供给呼吸,会使人窒息死亡,故进入久未开启的菜窖前,用燃着的蜡烛做“灯火试验”,所以正确。
B、油不溶于水且密度比水小,会浮在水面上,不能达到灭火的目的,所以错误。
C、洒出的酒精在桌上燃烧,立刻用湿抹布扑盖能隔绝氧气或空气,以达到灭火的目的,所以正确。
D、可燃性的气体与空气混合点燃易发生爆炸,煤气有可燃性,关闭阀门开窗通风,即可降低燃气的浓度,又能降温,使气体达不到着火点,防止造成爆炸,所以正确。
故选B。
6.A
【详解】
A、氢气具有可燃性,点燃H2与O2混合气体可能爆炸;甲烷也具有可燃性,则点燃CH4与O2的混合气体也可能爆炸,故选项列推理中结论正确;
B、化学反应的实质是分子的分裂,原子的重组,原子在化学变化中不能再分,而分子却可以再分,故选项推理中结论错误;
C、分解反应中都有多种物质生成,但能生成多种物质的反应不一定是分解反应,例如蜡烛燃烧生成二氧化碳和水,不是分解反应,故选项推理中结论错误;
D、燃烧一般都伴随发光和放热现象,有发光和放热现象的变化不都是燃烧,例如白炽灯发光发热不是化学变化,故选项推理中结论错误。
故选A。
7.C
【详解】
燃烧是剧烈的发光发热的氧化反应,一定属于化学反应。但燃烧不一定是化合反应,如如蜡烛在空气中燃烧生成水和二氧化碳,就不属于化合反应。故选C。
8.C
【详解】
A、拨打或接听移动电话产生的电火花会引燃汽油与空气的混合物发生火灾,选项错误;
B、遇火灾时打开所有门窗后,室外的新鲜空气进入室内会提高室内氧气的浓度,燃烧更旺,再次火势加大,选项错误;
C、档案资料着火,用液态二氧化碳扑火后不留下痕迹,不会污毁档案资料,选项正确;
D、可燃物燃烧得条件是可燃物与氧气充分接触,温度达到可燃物的着火点,选项错误,故选C。
9.B
【详解】
A、电气设备着火后,不能直接用水灭火,因为水中一般含有导电的杂质,喷在带电设备上,再渗入设备上的灰尘杂质,则更易导电,如用水灭火,还会降低电气设备的绝缘性能,引起接地短路,或危及附近救火人员的安全,故选项错误;
B、实验室里所用的药品,很多是易燃、易爆、有腐蚀性或有毒的.在使用药品时为保证安全,要做到“三不”,不能尝任何药品的味道,故选项正确;
C、用剩的化学药品不可以带回家,带回家中,可能会造成污染或中毒等事故,故选项错误;
D、如果不慎将浓硫酸沾到皮肤上,立即用较多的水冲洗,再用3%~5%的NaHCO3溶液冲洗,故选项错误。
故选:B。
10.D
【详解】
A、烟气脱硫后,能够减少排入大气中的二氧化硫,能减少酸雨的形成,该选项说法正确;
B、脱硫塔中发生的主要反应为:硫化钙、二氧化硫、氧气反应生成硫酸钙和硫,反应的化学方程式:CaS+SO2+O2CaSO4+S,该选项说法正确;
C、脱硫塔中消耗硫化钙,再生塔中生成硫化钙,理论上,生产过程中无需补充CaS,该选项说法正确;
D、再生塔中反应的化学方程式:CaSO4+2C CaS+2CO2↑,结合脱硫塔中的反应可知,SO2﹣S﹣2CO2,因此理论上每处理64.0gSO2,可回收32.0gS粉,同时排放出88.0gCO2,该选项说法不正确。
故选:D。
11.2KMnO4K2MnO4+MnO2+O2↑ 氧气的密度比空气大 2H2O22H2O+O2↑ 铁丝在氧气中燃烧;降温,防止熔融物溅落,炸裂瓶底;硫在氧气中燃烧;水用于吸收二氧化硫,防止污染空气(合理即可) BD或BE 7:4:8 3.04g
【详解】
(1)①装置A适用于固体加热制取气体,若试管口有一团棉花,则是加热高锰酸钾制取氧气,同时生成锰酸钾和二氧化锰;化学方程式为:2KMnO4K2MnO4+MnO2+O2↑;
②①中生成的单质是氧气,氧气是由氧分子构成的,氧分子是由氧原子构成的,氧原子的核内有8个质子,核外电子排布为2、6,所以氧原子结构示意图为: ;
③氧气的密度比空气大,所以不能用向下排空气法来收集;
(2)①装置B适用于固—液常温下制取气体,即过氧化氢在二氧化锰的催化作用下生成氧气和水;化学方程式为:2H2O22H2O+O2↑;
②①中生成的液体是水,在配制溶液的实验中,水是溶剂;在做细铁丝在氧气中燃烧的实验时,水的作用是防止高温生成物溅落、炸裂瓶底;在用红磷燃烧测定空气中氧气含量的实验中,水的作用是测定空气中氧气的含量;硫在氧气中燃烧生成二氧化硫,二氧化硫能污染空气,所以可用水吸收防止污染空气;
(3)①实验室用锌粒(固体)和稀硫酸(液体)反应制取氢气,该反应属于固—液常温型,氢气难溶于水,密度比空气小,可用排水法或向下排空气法收集,制取氢气可选择的实验装置是BD或BE;
②硫酸亚铁中铁、硫、氧三种元素的质量比56:32:(16×4)=7:4:8;
③含1.12g铁元素需要硫酸亚铁的质量为:1.12g÷100% =3.04g。
12.AC 能量密度比镍氢电池大 化学 电 放出热量大,不排放任何污染物 催化
【详解】
(1)A、依据图1可知,提高相同能量时,铝空电池的体积最小,符合题意;
B、图二中,电解水正极产生氧气,负极产生氢气,所以A口产生的气体应是氢气,错误,不符合题意;
C、乙醇是可再生资源,可以通过发酵甘蔗、玉米等农作物或发酵粮食收割后剩余的秸秆大量提取,所以农业大国盛产甘蔗和玉米,可以提取乙醇,有利于推广乙醇汽车,符合题意;
故选AC。
(2)依据图一,可以看出锂电池优于镍氢电池的性能指标是锂电池的能量密度比镍氢电池大,锂电池放电的过程是讲化学能转化为电能的过程。
(3)据测算数据,1kg氢气完全燃烧可释放1.43×105kJ的热量,1kg汽油完全燃烧可释放4.6×104kJ的热量。所以氢内燃车与汽油车相比的优势是氢内燃车放出热量大,并且不排放任何污染物。
(4)通过ZnFe2O4的循环制氢体系,可以看到ZnFeO在反应前后化学性质和质量均没有发生改变,所以ZnFeO起催化作用。反应③是Mg2Cu与H2在一定条件下生成MgCu2和MgH2,故化学反应方程式为:。
13.水可以使温度降低 清除可燃物
【详解】
用高压水枪灭火其原理主要是水可以使温度降低到可燃物着火点以下,达到灭火目的;有的拆除周围仓库制造防火隔离带,其灭火原理又是清除可燃物,达到灭火目的。
14.
(1) 支持燃烧 化学能
(2) 分别伸入燃着的木条(或取少量通入澄清石灰水) b
(3)二氧化碳
【分析】
(1)
长征5号火箭使用了液氧,是利用氧气能助燃性,能支持燃烧的化学性质。燃烧过程中化学能转化为大量热能。
(2)
①火星低层大气含有较多二氧化碳,可以使用燃着的木条或澄清石灰水鉴别火星低层大气和空气。使用燃着的木条,木条熄灭的是火星低层大气,无明显变化的是空气。使用澄清石灰水,澄清石灰水变浑浊的是火星低层大气,无明显变化的是空气。
②a.将CO2转化为O2,提高O2含量,合理,人呼吸需要氧气,二氧化碳中含有氧元素。
b.将CO2分解转化为N2,提高N2含量,不合理,反应前后元素种类不变,二氧化碳中不含氮元素。
c.寻找水的存在和开发水循环技术,合理。
d.利用火星上的金属矿物冶炼金属,合理。
故选b。
(3)
镁粉在火星上可以扮演地球上煤的角色,火星低层大气二氧化碳含量较高,说明镁能在二氧化碳中燃烧。
15.H2 C
【分析】
B是产生温室效应的主要气体,应为CO2,E是天然气的主要成分,应为CH4,由转化关系可知丙、乙为C和O2,其中丙能与甲烷反应,则丙为O2,乙为C,A为H2O,甲为H2,丁能与H2反应生成水,与C反应生成CO2,丁为金属氧化物,常见为CuO等。
【详解】
(1)由以上分析可知甲为H2,乙为C;
(2)丙是氧气,乙是甲烷,甲烷和氧气在点燃的条件下生成水和二氧化碳,反应的化学方程式为;
(3)D和A是组成元素相同的化合物,应为H2O2,在丁做催化剂条件下,分解的方程式为。
16.
(1)为了耗尽装置内的氧气
(2)引流
(3)温度达到着火点
【解析】
(1)
该实验主要是利用物质燃烧消耗装置内的氧气,然后根据进入水的体积,判断氧气的体积.只有加入过量的红磷,才能将将氧气完全消耗掉.如果红磷的量不足,会导致实验的结果是水倒流不足五分之一;故填:为了耗尽装置内的氧气;
(2)
在过滤操作中,玻璃棒的作用是引流;故填:引流;
(3)
薄铜片上的白磷和红磷都与氧气接触,白磷燃烧而红磷不燃烧,说明温度达到可燃物的着火点时才能够燃烧。
17.
(1) 试管 酒精灯 (或)
(2) A 当集气瓶口有大气泡冒出,说明已经集满气体
(3) B C E
【分析】
(1)
编号所指仪器的名称:a 试管;b 酒精灯。A装置为固体加热型,试管口没有棉花,用A装置可用氯酸钾和二氧化锰制取氧气,加热条件下二氧化锰催化氯酸钾反应生成氯化钾和氧气,反应文字表达式(或化学方程式)(或)。
(2)
实验室中,用加热高锰酸钾的方法制取气,属于固体加热型,发生装置可选用 A;用排水法法收集氧气,当集气瓶口有大气泡冒出,说明已经集满气体。
(3)
氢气是最清洁的燃料,它的密度比空气小,难溶于水,实验室常用锌粒与稀硫酸反应来制得,属于固液混合不需加热型,发生装置为B,氢气密度比空气小、难溶于水,收集氢气的装置可选用 C或E。
18.氧化铜 干燥 3 玻璃棒 引流 化学反应前后,氧化铜的质量不变 化学反应前后,氧化铜的化学性质不变 探究二氧化锰和氧化铜,哪一种催化剂的催化效果好 过氧化氢溶液的浓度 温度越高,反应速率越快
【详解】
(1)查阅资料:
由表可知,氧化铜作催化剂时,开始反应的温度和剧烈反应的温度最低,故最好选用的物质是氧化铜。
(2)实验探究一:
步骤④是从反应后的混合物中分离出氧化铜,并测量氧化铜的质量,故步骤④的操作是:将实验③反应后的固体加水溶解、过滤、洗涤、干燥、称量。
(3)分析实验:
a、该实验的目的是探究催化剂对化学反应速率的影响,以及氧化铜和二氧化锰哪一种催化剂的催化效果最好,故除了催化剂不同,其他条件都应相同,故实验③中x的值应为:3g;
b、实验④过滤操作中需要的玻璃仪器有烧杯、漏斗、玻璃棒,在过滤中,玻璃棒的作用是:引流。氯酸钾在氧化铜的催化下受热分解生成氯化钾和氧气,将反应后固体混合物加水溶解、过滤、洗涤、干燥、称量,得到固体氧化铜质量为1g,故通过实验④可以得出的结论是:化学反应前后,氧化铜的质量不变;
c、将实验④后得到的1g固体和3g氯酸钾混合均匀后加热,现象与实验③相同。说明化学反应前后,氧化铜的化学性质不变;
d、实验②③除了催化剂种类不同,其他因素都相同,故对比的目的是:探究二氧化锰和氧化铜,哪一种催化剂的效果好。
(4)实验探究二:
a、实验①和实验②除了过氧化氢溶液的浓度不同,其他因素都相同,故对比可知:化学反应速率还过氧化氢的浓度有关;
b、实验③和实验④,除了温度不同,其他因素都相同,且温度越高,收集等体积氧气所需的时间越短,说明反应速率越快。
19.解:设每公里燃烧甲烷的质量为x
x≈34.5g
答:每公里燃烧甲烷的理论值是34.5g。
20.(1)CH4 (2)88g
【详解】
本题考查根据化学方程式确定物质的化学式和有关化学方程式的计算。首先判断哪种物质过量,然后利用化学方程式计算。
(1)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式X+2O2 CO2+2H2O,反应前碳、氢、氧原子个数分别为0、0、4,反应后的生成物中碳、氢、氧原子个数分别为1、4、4,根据反应前后原子种类、数目不变,则每个X分子由1个碳原子和4个氢原子构成,物质X的化学式为CH4;
(2)根据化学方程式CH4+ 2O2 CO2 + 2H2O可知,CH4与O2的质量比是16:64,可知反应时氧气过量。
设:生成二氧化碳的质量为x,
CH4+ 2O2 CO2 + 2H2O
16 44
32g x
x=88g
答:生成二氧化碳的质量为88g。答案第1页,共2页
答案第1页,共2页
燃料及其利用测试卷(二)
一、单选题
1.下列关于燃烧与灭火事例的解释错误是
A.炒菜时油锅着火,立即盖上锅盖—隔绝了空气
B.将煤球制成蜂窝状有利于煤的充分燃烧—增大了煤与空气的接触面积
C.如图中铜片上的乒乓球碎片燃烧而滤纸碎片不燃烧—滤纸碎片不是可燃物
D.森林灭火,在火势蔓延的前方砍岀隔离带—清除可燃物
2.每年三月的最后一个星期一是全国中小学安全教育日。下列有关安全知识错误的是
A.严禁携带易燃、易爆物品乘坐火车 B.高层建筑物起火,立即乘电梯撤离
C.从火场中逃生时应有序撤离着火区域D.身上着火不要乱跑,可就地打滚使火熄灭
3.下列不属于缓慢氧化的是
A.铁生锈 B.酿酒 C.食物腐烂 D.蜡烛燃烧
4.长沙市是“资源节约型、环境友好型社会”建设试点城市之一,你认为以下做法与之不相符的是
A.将废弃的稻草就地焚烧
B.积极开发和利用太阳能、风能和核能等能源
C.减少使用一次性木筷
D.研制开发燃料电池汽车,消除机动车尾气污染
5.下列措施或事故处理方法不正确的是
A.进入久未开启的菜窖前,用燃着的蜡烛做“灯火试验”
B.油库着火用水扑灭
C.洒出的酒精在桌上燃烧,立刻用湿抹布扑盖
D.厨房煤气管道泄气,立即关闭阀门并开窗通风
6.推理是化学中一种重要的学习方法,但应具体问题具体对待,否则就会产生错误的结论。下列推理中结论正确的是
A.点燃H2与O2混合气体可能爆炸,则点燃CH4与O2 的混合气体也可能爆炸
B.原子在化学变化中不能再分,则分子在化学变化中不能再分
C.分解反应中都有多种物质生成,则能生成多种物质的反应一定是分解反应
D.燃烧一般都伴随发光和放热现象,则有发光和放热现象的变化都是燃烧
7.关于燃烧的说法中,错误的是
A.都是化学反应 B.都是氧化反应
C.都是化合反应 D.都是放热反应
8.请用所学知识判断下列说法做法正确的是
A.在加油站拨打或接听移动电话
B.遇火灾时打开所有门窗
C.档案资料着火,可用液态二氧化碳扑火
D.只要温度达到可燃物的着火点,可燃物就能燃烧
9.符合化学实验室安全要求的是
A.电气着火用水扑灭 B.不能品尝化学药品味道
C.用剩的化学药品可以带回家 D.浓硫酸沾在皮肤上立即用水冲洗
10.如图为一种烟气脱硫的流程。下列说法不正确的是
A.烟气脱硫能减少酸雨的形成
B.脱硫塔中发生的主要反应为CaS+SO2+O2CaSO4+S
C.理论上,生产过程中无需补充CaS
D.理论上每处理64.0g SO2,可回收32.0g S粉,同时排放出44.0g CO2
二、综合应用题
11.化学是以实验为基础的科学,实验是科学探究的重要手段。
(1)康康同学利用如图实验装置进行探究实验。请回答下列问题:
①若A装置试管口放一团棉花,请写出A装置制取氧气的化学方程式 _____ 。
②画出①中生成物是单质的原子结构示意图 ____
③收集氧气时不宜用D装置,其原因是什么 ____ ?
(2)康康将B、C装置连接后可制取多种气体,
①写出用B、C装置制取氧气的化学方程式。 _____ 。
②举例说明①中生成物液体,在不同实验中的作用 ____ 。
(3)实验室用锌粒(固体)和稀硫酸(液体)反应,生成物是硫酸亚铁和氢气。(氢气难溶于水,密度比空气小),制得的硫酸亚铁可用于治疗缺铁性贫血。某贫血患者每天需补充1.12g铁元素。
①制取氢气可选择的实验装置是 _____ 。
②写出硫酸亚铁中各元素的质量比 _____ 。
③计算他每天服用的药物中含硫酸亚铁质量是多少 ____ ?
三、科普阅读题
12.阅读下面的科普短文,回答相关问题。
新能源汽车已经走进了我们的生活。我国新能源汽车发展迅速,未来可期。与传统汽车使用舒适燃料不同,新能源汽车的能量来源更加多元化。
电动汽车:电池能为电动汽车提供动力,几类电池的部分幸能指标如图1所示。其中能量密度表示单位体积的电池所具有的能量。
氢内燃车:氢内燃车以氢气为燃料,不排放任何污染物。氢气可通过电解水(原理如图2)等多种方式获得。据测算,1kg氢气完全燃烧可释放1.43×105kJ的热量,1kg汽油完全燃烧可释放4.6×104kJ的热量。
乙醇汽车:乙醇汽车以乙醇为燃料,乙醇是可再生资源,可以通过发酵甘蔗、玉米等农作物或发酵粮食收割后剩余的秸秆大量提取。
根据以上文章内容回答下列问题:
(1)下列说法正确的是______(填序号)
A 依据图1可知,提高相同能量时,铝空电池的体积最小
B 图2中,A口产生的气体为氢气
C 农业大国盛产甘蔗和玉米,有利于推广乙醇汽车
(2)依据图1,锂电池优于镍氢电池的性能指标是______,锂电池放电将______能转化为______能。
(3)依据测算数据可知,氢内燃车与汽油车相比的优势是______。
(4)下图是制取与贮存氢气的一种方法。ZnFeO在循环制氢体系的总反应中起______作用,反应③的化学方程式为______。
四、填空题
13.仓库突发大火时,消防人员紧急赶到现场。有的用高压水枪灭火其原理主要是________;有的拆除周围仓库制造防火隔离带,其灭火原理又是__________。
14.2021年5月15日,中国“天问”一号探测器成功着陆火星。
(1)“天问”火星探测器通过长征5号运载火箭发射,长征5号火箭使用了液氧,是利用氧气能_________的化学性质,燃烧过程中________能转化为大量热能。
(2)火星拥有丰富的金属矿物和一些资源。火星低层大气的主要成分如下表。
①为鉴别一瓶模拟“火星低层大气”组成的气体和一瓶空气,可采用的操作方法是_________。
气体成分 二氧化碳 氮气 氩气 氧气 其他
体积分数/% 95.32 2.7 1.6 0.13 0.25
②若为满足人类未来在火星上生活,下列研究设想不合理的是__________(填标号)。
a.将CO2转化为O2,提高O2含量
b.将CO2分解转化为N2,提高N2含量
c.寻找水的存在和开发水循环技术
d.利用火星上的金属矿物冶炼金属
(3)化学家提出“镁粉在火星上可以扮演地球上煤的角色”,结合火星低层大气成分推测Mg一定还能在__________气体中燃烧。
五、推断题
15.如图是初中化学中常见物质问的转化关系,其中甲、乙、丙均为非金属单质;A、B、E和丁均为化合物;B和E为能产生温室效应的气体。
(1)写出化学式:甲_____;乙_____
(2)写出丙和E反应生成A和B的化学方程式_____
(3)D和A是组成元素相同的化合物,写出D在丁做催化剂条件下,分解生成A和丙的化学方程式:_____
六、实验题
16.下列是初中化学中的一些重要实验,请回答:
(1)A中红磷必须足量的原因是__________;
(2)B中玻璃棒的作用是____________;
(3)C中铜片上的红磷没有燃烧说明燃烧需要的条件之一是_____________。
17.结合下列图示装置,回答有关问题。
(1)写出编号所指仪器的名称:a______;b______。用A装置制取某种气体的一个化学反应文字表达式(或化学方程式)______。
(2)实验室中,用加热高锰酸钾的方法制取气,发生装置可选用______(填标号);用排水法法收集氧气,应如何判断已经集满气体?______。
(3)氢气是最清洁的燃料,它的密度比空气小,难溶于水,实验室常用锌粒与稀硫酸反应来制得。发生装置______,收集氢气的装置可选用______或______。(填标号)
七、科学探究题
18.某化学兴趣小组进行了“寻找新的催化剂”的如下研究性实验
(提出问题)①二氧化锰常用作氯酸钾和过氧化氢分解的催化剂,其他物质是否也可以用作该反应的催化剂呢?
②除了催化剂还有其他因素影响化学反应的速率吗?
(1)(查阅资料)
研究表明,许多物质对氯酸钾的分解有催化作用,分别用它们作催化剂,氯酸钾开始发生反应和反应剧烈时的温度如下表所示:
氧化铁 氧化铝 氧化铜 氧化镁
开始反应 420℃ 515℃ 305℃ 490℃
剧烈反应 490℃ 540℃ 350℃ 545℃
通过分析资料中的数据,实验室用氯酸钾制取氧气,如果不用二氧化锰作催化剂,最好选用的物质是______。
(2)(实验探究一)
①将3g氯酸钾放在试管中加热。
②将3g 氯酸钾与1g二氧化锰混合均匀后加热。
③将xg 氯酸钾与1g氧化铜混合均匀后加热。
④将实验③反应后的固体加水溶解、过滤、洗涤、______、称量,结果为1g。
⑤将实验④后得到1g固体和xg氯酸钾混合均匀后加热,现象与实验③相同。
(3)(分析实验)
a、实验③中x的值应为______。
b、实验④过滤操作中需要的玻璃仪器有烧杯、漏斗、______,它在操作中的作用是______,通过实验④可以得出的结论是______。
c、通过实验⑤可以得出的结论是______。
d、实验②③对比的目的是______。
(实验结论)氧化铜确实也能做氯酸钾分解的催化剂
(4)(实验探究二)
影响化学反应的速率除了催化剂以外,还有其他因素吗?
以下是另一实验小组探究影响过氧化氢反应速率部分因素的相关实验数据。
实验序号 H2O2溶液浓度% H2O2溶液体积/mL 温度℃ MnO2的用量/g 收集氧气的体积/mL 反应所需的时间/s
① 5 1 20 0.1 4 16.75
② 15 1 20 0.1 4 6.04
③ 30 5 35 0 2 49.21
④ 30 5 55 0 2 10.76
a通过实验①和实验②对比可知,化学反应速率还与______有关。
b通过实验③和实验④对比可知,化学反应速率与温度的关系是______。
八、计算题
19.燃气汽车燃料(压缩天然气)主要成分是甲烷(CH4),它在汽车发动机里完全燃烧的化学方程式为:。如果以每公里95g的二氧化碳排放标准,每公里燃烧甲烷的理论值是多少克?(假定压缩天然气中其他成分燃烧不产生二氧化碳;计算结果保留小数点后一位数字)。
20.某纯净物X 32g在160g氧气中充分燃烧,反应的化学方程式为: X + 2O2 CO2 + 2H2O
请完成下列问题:
(1)X的化学式为______________
(2)计算生成二氧化碳的质量为____________ (写出计算过程)
试卷第1页,共3页
参考答案
1.C
【详解】
A、炒菜时油锅着火,立即盖上锅盖—隔绝了空气,破坏燃烧条件,可以灭火,选项正确,不符合题意;
B、燃料充分燃烧要有足够的氧气,将煤球制成蜂窝状有利于煤的充分燃烧—增大了煤与空气的接触面积,选项正确,不符合题意;
C、如图中铜片上的乒乓球碎片燃烧而滤纸碎片不燃烧—铜片上的温度未达到滤纸的着火点,选项错误,符合题意;
D、森林灭火,在火势蔓延的前方砍岀隔离带—清除可燃物,使燃烧停止,选项正确,不符合题意。
故选C。
2.B
【详解】
A.严禁携带易燃、易爆物品乘坐火车,很容易发生火灾和爆炸,选项A正确;
B.高层建筑物起火,不能乘电梯撤离,选项B错误;
C.从火场中逃生时,应有序撤离着火区域,不能乱跑,选项C正确;
D.身上着火要是乱跑,会加速空气流动,提供充足的氧气,火势会更旺,可就地打滚使火熄灭,选项D正确。
故选:B。
3.D
【详解】
A、铁生锈是铁与氧气、水共同作用的结果,属于缓慢氧化,故错误;
B、酿酒反应缓慢甚至不易察觉,属于缓慢氧化,故错误;
C、食物腐烂是食物和氧气发生的缓慢甚至不易察觉的反应,属于缓慢氧化,故错误;
D、蜡烛燃烧是一种发光发热的剧烈的氧化反应,故正确;
故选D。
4.A
【详解】
A、燃烧废弃的稻草会释放出大量有害气体和粉尘,能造成空气二次污染,故A错误;
B、太阳能、风能和核能等是洁净能源可以节能也可以减少污染物,故B正确;
C、减少使用一次性木筷,可以节约能源也可减少污染,故C正确;
D、研制开发燃料电池汽车,推广使用可以节省化石燃料同时减少对大气的污染,故D正确。
故选A。
5.B
【详解】
A、二氧化碳的密度比空气大,会聚集到菜窖内,且二氧化碳不能供给呼吸,会使人窒息死亡,故进入久未开启的菜窖前,用燃着的蜡烛做“灯火试验”,所以正确。
B、油不溶于水且密度比水小,会浮在水面上,不能达到灭火的目的,所以错误。
C、洒出的酒精在桌上燃烧,立刻用湿抹布扑盖能隔绝氧气或空气,以达到灭火的目的,所以正确。
D、可燃性的气体与空气混合点燃易发生爆炸,煤气有可燃性,关闭阀门开窗通风,即可降低燃气的浓度,又能降温,使气体达不到着火点,防止造成爆炸,所以正确。
故选B。
6.A
【详解】
A、氢气具有可燃性,点燃H2与O2混合气体可能爆炸;甲烷也具有可燃性,则点燃CH4与O2的混合气体也可能爆炸,故选项列推理中结论正确;
B、化学反应的实质是分子的分裂,原子的重组,原子在化学变化中不能再分,而分子却可以再分,故选项推理中结论错误;
C、分解反应中都有多种物质生成,但能生成多种物质的反应不一定是分解反应,例如蜡烛燃烧生成二氧化碳和水,不是分解反应,故选项推理中结论错误;
D、燃烧一般都伴随发光和放热现象,有发光和放热现象的变化不都是燃烧,例如白炽灯发光发热不是化学变化,故选项推理中结论错误。
故选A。
7.C
【详解】
燃烧是剧烈的发光发热的氧化反应,一定属于化学反应。但燃烧不一定是化合反应,如如蜡烛在空气中燃烧生成水和二氧化碳,就不属于化合反应。故选C。
8.C
【详解】
A、拨打或接听移动电话产生的电火花会引燃汽油与空气的混合物发生火灾,选项错误;
B、遇火灾时打开所有门窗后,室外的新鲜空气进入室内会提高室内氧气的浓度,燃烧更旺,再次火势加大,选项错误;
C、档案资料着火,用液态二氧化碳扑火后不留下痕迹,不会污毁档案资料,选项正确;
D、可燃物燃烧得条件是可燃物与氧气充分接触,温度达到可燃物的着火点,选项错误,故选C。
9.B
【详解】
A、电气设备着火后,不能直接用水灭火,因为水中一般含有导电的杂质,喷在带电设备上,再渗入设备上的灰尘杂质,则更易导电,如用水灭火,还会降低电气设备的绝缘性能,引起接地短路,或危及附近救火人员的安全,故选项错误;
B、实验室里所用的药品,很多是易燃、易爆、有腐蚀性或有毒的.在使用药品时为保证安全,要做到“三不”,不能尝任何药品的味道,故选项正确;
C、用剩的化学药品不可以带回家,带回家中,可能会造成污染或中毒等事故,故选项错误;
D、如果不慎将浓硫酸沾到皮肤上,立即用较多的水冲洗,再用3%~5%的NaHCO3溶液冲洗,故选项错误。
故选:B。
10.D
【详解】
A、烟气脱硫后,能够减少排入大气中的二氧化硫,能减少酸雨的形成,该选项说法正确;
B、脱硫塔中发生的主要反应为:硫化钙、二氧化硫、氧气反应生成硫酸钙和硫,反应的化学方程式:CaS+SO2+O2CaSO4+S,该选项说法正确;
C、脱硫塔中消耗硫化钙,再生塔中生成硫化钙,理论上,生产过程中无需补充CaS,该选项说法正确;
D、再生塔中反应的化学方程式:CaSO4+2C CaS+2CO2↑,结合脱硫塔中的反应可知,SO2﹣S﹣2CO2,因此理论上每处理64.0gSO2,可回收32.0gS粉,同时排放出88.0gCO2,该选项说法不正确。
故选:D。
11.2KMnO4K2MnO4+MnO2+O2↑ 氧气的密度比空气大 2H2O22H2O+O2↑ 铁丝在氧气中燃烧;降温,防止熔融物溅落,炸裂瓶底;硫在氧气中燃烧;水用于吸收二氧化硫,防止污染空气(合理即可) BD或BE 7:4:8 3.04g
【详解】
(1)①装置A适用于固体加热制取气体,若试管口有一团棉花,则是加热高锰酸钾制取氧气,同时生成锰酸钾和二氧化锰;化学方程式为:2KMnO4K2MnO4+MnO2+O2↑;
②①中生成的单质是氧气,氧气是由氧分子构成的,氧分子是由氧原子构成的,氧原子的核内有8个质子,核外电子排布为2、6,所以氧原子结构示意图为: ;
③氧气的密度比空气大,所以不能用向下排空气法来收集;
(2)①装置B适用于固—液常温下制取气体,即过氧化氢在二氧化锰的催化作用下生成氧气和水;化学方程式为:2H2O22H2O+O2↑;
②①中生成的液体是水,在配制溶液的实验中,水是溶剂;在做细铁丝在氧气中燃烧的实验时,水的作用是防止高温生成物溅落、炸裂瓶底;在用红磷燃烧测定空气中氧气含量的实验中,水的作用是测定空气中氧气的含量;硫在氧气中燃烧生成二氧化硫,二氧化硫能污染空气,所以可用水吸收防止污染空气;
(3)①实验室用锌粒(固体)和稀硫酸(液体)反应制取氢气,该反应属于固—液常温型,氢气难溶于水,密度比空气小,可用排水法或向下排空气法收集,制取氢气可选择的实验装置是BD或BE;
②硫酸亚铁中铁、硫、氧三种元素的质量比56:32:(16×4)=7:4:8;
③含1.12g铁元素需要硫酸亚铁的质量为:1.12g÷100% =3.04g。
12.AC 能量密度比镍氢电池大 化学 电 放出热量大,不排放任何污染物 催化
【详解】
(1)A、依据图1可知,提高相同能量时,铝空电池的体积最小,符合题意;
B、图二中,电解水正极产生氧气,负极产生氢气,所以A口产生的气体应是氢气,错误,不符合题意;
C、乙醇是可再生资源,可以通过发酵甘蔗、玉米等农作物或发酵粮食收割后剩余的秸秆大量提取,所以农业大国盛产甘蔗和玉米,可以提取乙醇,有利于推广乙醇汽车,符合题意;
故选AC。
(2)依据图一,可以看出锂电池优于镍氢电池的性能指标是锂电池的能量密度比镍氢电池大,锂电池放电的过程是讲化学能转化为电能的过程。
(3)据测算数据,1kg氢气完全燃烧可释放1.43×105kJ的热量,1kg汽油完全燃烧可释放4.6×104kJ的热量。所以氢内燃车与汽油车相比的优势是氢内燃车放出热量大,并且不排放任何污染物。
(4)通过ZnFe2O4的循环制氢体系,可以看到ZnFeO在反应前后化学性质和质量均没有发生改变,所以ZnFeO起催化作用。反应③是Mg2Cu与H2在一定条件下生成MgCu2和MgH2,故化学反应方程式为:。
13.水可以使温度降低 清除可燃物
【详解】
用高压水枪灭火其原理主要是水可以使温度降低到可燃物着火点以下,达到灭火目的;有的拆除周围仓库制造防火隔离带,其灭火原理又是清除可燃物,达到灭火目的。
14.
(1) 支持燃烧 化学能
(2) 分别伸入燃着的木条(或取少量通入澄清石灰水) b
(3)二氧化碳
【分析】
(1)
长征5号火箭使用了液氧,是利用氧气能助燃性,能支持燃烧的化学性质。燃烧过程中化学能转化为大量热能。
(2)
①火星低层大气含有较多二氧化碳,可以使用燃着的木条或澄清石灰水鉴别火星低层大气和空气。使用燃着的木条,木条熄灭的是火星低层大气,无明显变化的是空气。使用澄清石灰水,澄清石灰水变浑浊的是火星低层大气,无明显变化的是空气。
②a.将CO2转化为O2,提高O2含量,合理,人呼吸需要氧气,二氧化碳中含有氧元素。
b.将CO2分解转化为N2,提高N2含量,不合理,反应前后元素种类不变,二氧化碳中不含氮元素。
c.寻找水的存在和开发水循环技术,合理。
d.利用火星上的金属矿物冶炼金属,合理。
故选b。
(3)
镁粉在火星上可以扮演地球上煤的角色,火星低层大气二氧化碳含量较高,说明镁能在二氧化碳中燃烧。
15.H2 C
【分析】
B是产生温室效应的主要气体,应为CO2,E是天然气的主要成分,应为CH4,由转化关系可知丙、乙为C和O2,其中丙能与甲烷反应,则丙为O2,乙为C,A为H2O,甲为H2,丁能与H2反应生成水,与C反应生成CO2,丁为金属氧化物,常见为CuO等。
【详解】
(1)由以上分析可知甲为H2,乙为C;
(2)丙是氧气,乙是甲烷,甲烷和氧气在点燃的条件下生成水和二氧化碳,反应的化学方程式为;
(3)D和A是组成元素相同的化合物,应为H2O2,在丁做催化剂条件下,分解的方程式为。
16.
(1)为了耗尽装置内的氧气
(2)引流
(3)温度达到着火点
【解析】
(1)
该实验主要是利用物质燃烧消耗装置内的氧气,然后根据进入水的体积,判断氧气的体积.只有加入过量的红磷,才能将将氧气完全消耗掉.如果红磷的量不足,会导致实验的结果是水倒流不足五分之一;故填:为了耗尽装置内的氧气;
(2)
在过滤操作中,玻璃棒的作用是引流;故填:引流;
(3)
薄铜片上的白磷和红磷都与氧气接触,白磷燃烧而红磷不燃烧,说明温度达到可燃物的着火点时才能够燃烧。
17.
(1) 试管 酒精灯 (或)
(2) A 当集气瓶口有大气泡冒出,说明已经集满气体
(3) B C E
【分析】
(1)
编号所指仪器的名称:a 试管;b 酒精灯。A装置为固体加热型,试管口没有棉花,用A装置可用氯酸钾和二氧化锰制取氧气,加热条件下二氧化锰催化氯酸钾反应生成氯化钾和氧气,反应文字表达式(或化学方程式)(或)。
(2)
实验室中,用加热高锰酸钾的方法制取气,属于固体加热型,发生装置可选用 A;用排水法法收集氧气,当集气瓶口有大气泡冒出,说明已经集满气体。
(3)
氢气是最清洁的燃料,它的密度比空气小,难溶于水,实验室常用锌粒与稀硫酸反应来制得,属于固液混合不需加热型,发生装置为B,氢气密度比空气小、难溶于水,收集氢气的装置可选用 C或E。
18.氧化铜 干燥 3 玻璃棒 引流 化学反应前后,氧化铜的质量不变 化学反应前后,氧化铜的化学性质不变 探究二氧化锰和氧化铜,哪一种催化剂的催化效果好 过氧化氢溶液的浓度 温度越高,反应速率越快
【详解】
(1)查阅资料:
由表可知,氧化铜作催化剂时,开始反应的温度和剧烈反应的温度最低,故最好选用的物质是氧化铜。
(2)实验探究一:
步骤④是从反应后的混合物中分离出氧化铜,并测量氧化铜的质量,故步骤④的操作是:将实验③反应后的固体加水溶解、过滤、洗涤、干燥、称量。
(3)分析实验:
a、该实验的目的是探究催化剂对化学反应速率的影响,以及氧化铜和二氧化锰哪一种催化剂的催化效果最好,故除了催化剂不同,其他条件都应相同,故实验③中x的值应为:3g;
b、实验④过滤操作中需要的玻璃仪器有烧杯、漏斗、玻璃棒,在过滤中,玻璃棒的作用是:引流。氯酸钾在氧化铜的催化下受热分解生成氯化钾和氧气,将反应后固体混合物加水溶解、过滤、洗涤、干燥、称量,得到固体氧化铜质量为1g,故通过实验④可以得出的结论是:化学反应前后,氧化铜的质量不变;
c、将实验④后得到的1g固体和3g氯酸钾混合均匀后加热,现象与实验③相同。说明化学反应前后,氧化铜的化学性质不变;
d、实验②③除了催化剂种类不同,其他因素都相同,故对比的目的是:探究二氧化锰和氧化铜,哪一种催化剂的效果好。
(4)实验探究二:
a、实验①和实验②除了过氧化氢溶液的浓度不同,其他因素都相同,故对比可知:化学反应速率还过氧化氢的浓度有关;
b、实验③和实验④,除了温度不同,其他因素都相同,且温度越高,收集等体积氧气所需的时间越短,说明反应速率越快。
19.解:设每公里燃烧甲烷的质量为x
x≈34.5g
答:每公里燃烧甲烷的理论值是34.5g。
20.(1)CH4 (2)88g
【详解】
本题考查根据化学方程式确定物质的化学式和有关化学方程式的计算。首先判断哪种物质过量,然后利用化学方程式计算。
(1)由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式X+2O2 CO2+2H2O,反应前碳、氢、氧原子个数分别为0、0、4,反应后的生成物中碳、氢、氧原子个数分别为1、4、4,根据反应前后原子种类、数目不变,则每个X分子由1个碳原子和4个氢原子构成,物质X的化学式为CH4;
(2)根据化学方程式CH4+ 2O2 CO2 + 2H2O可知,CH4与O2的质量比是16:64,可知反应时氧气过量。
设:生成二氧化碳的质量为x,
CH4+ 2O2 CO2 + 2H2O
16 44
32g x
x=88g
答:生成二氧化碳的质量为88g。答案第1页,共2页
答案第1页,共2页
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
