气体的摩尔体积课件
图片预览





文档简介
(共14张PPT)
第二节 气体摩尔体积
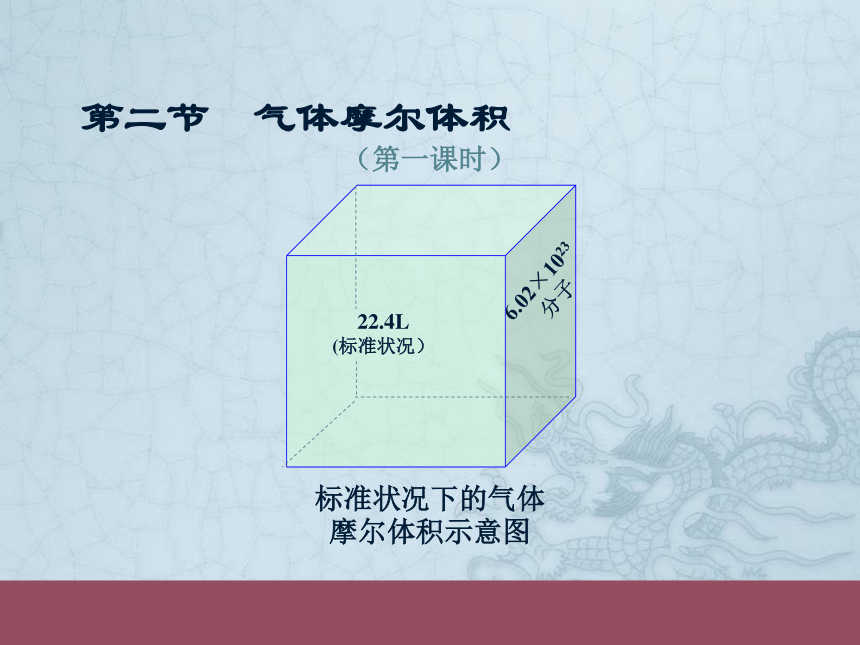
标准状况下的气体摩尔体积示意图
22.4L
(标准状况)
6.02×1023分子
(第一课时)
上一节课我们学习了“物质的量(n)”及其单位摩尔(mol),由n可以求出哪些物理量?
[思考]
?
V(液体)
V(气)
?
质量
物质的量
微粒数
÷M
×M
×NA
÷NA
(m)
(n)
(N)
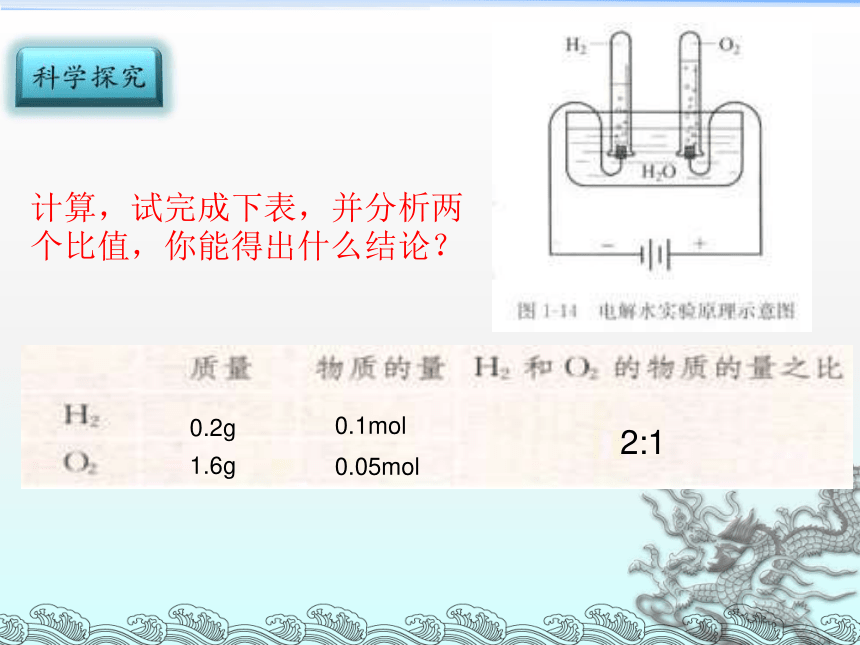
计算,试完成下表,并分析两个比值,你能得出什么结论?
0.2g
1.6g
0.05mol
0.1mol
2:1
试计算1mol氧气和氢气的体积:
对于固态和液态的物质是否也有一样的规律呢?
固体、液体物质粒子间间隔很小,在微粒数目相同的情况下,固体、液体的体积主要由粒子本身大小决定。
①物质的粒子数目;
②粒子的大小;
③粒子之间的距离;
[ 实验启示] 气体分子间的平均距离要比固体和液体中粒子之间的平均距离大得多。
0℃1 mol H2O( 18 mL)
100℃1 mol H2O (g) (3.06×104 mL)
(体积扩大1700倍)
标准状况下气体摩尔体积要点:
条件:标准状况
(S.T.P)
对象:任何气体
物质的量:1mol
结论
体积约占
22.4L
22.4L
(标准状况)
6.02×1023分子
0.282m
标准状况下的气体摩尔体积示意图
常用单位有L/mol(L·mol-1)和m3/mol。
Vm=
V
n
公式:
符号为Vm
概念:单位物质的量气体所占的体积。
V
(标况)
÷vm
×vm
÷Vm×NA
Vm×NA÷
分子
离子
电子
原子
质量
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
m
n
N
÷ρ
× ρ
物质的量与质量、微粒数、体积之间的关系
[练习]
1. 标准状况下,1mol任何物质的体积都约是22.4L。
(错,物质应是气体)
2. 1mol气体的体积约为22.4L。
(错,应标明条件-标准状况)
3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。
(对,气体体积与分子种类无关)
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
(错,未指明气体体积是否在相同条件下测定)
5. 标准状况下,气体的摩尔体积都是22.4L。
(错,“约为”;单位应为L/mol)
6. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,不一定)
[练习]
下列说法正确的是( )
(A)在标准状况下,1mol水和1molH2的体积都约是22.4L
(B)2gH2和44gCO2的体积相等
(C)1mol某气体的体积为22.4L,则该气体一定处于标准状况
(D)在标准状况下,1gH2和11.2LO2的物质的量相等
[答案] (D)
[练习] 在同温同压下,相同质量的下列气体,占有的体积由大到小的顺序是——
[讨论] 在一定温度和压强下,并不一定是标准状况,1mol不同的气体体积是否相同?
①Cl2 ②N2 ③H2 ④CO2 ⑤O2
[答案] ③>②>⑤>④>①
在同温同压下,相同分子数的气体,其体积 ( );
在同温同压下,体积相同的气体,其分子数
在同温同压下,气体体积的大小与分子数目成( )比。
相同
相同
正
[讨论] 请列出标准状况下求算气体体积可能的方法:
1、V=m/ ρ
2、V=n×Vm
(V=m/M×Vm V=N/NA×Vm)
ρ
ρ
[练习] 在标准状况下
(1)0.5molHCl占有的体积是多少? (2)33.6LH2的物质的量是多少?
(3)16gO2的体积是多少?
(4)44.8LN2中含有的N2分子数是多少?
(11.2L)
(1.5mol)
(11.2L)
(2×6.02×1023个)
小 结
2.标准状况下的气体摩尔体积(Vm=22.4L/mol)理解要点:
条件:标准状况(S.T.P)
对象:任何气体
物质的量:1mol
体积约占22.4L
结论
1、气体摩尔体积
常用单位有L/mol(L·mol-1)和m3/mol。
Vm=
V
n
公式:
符号为 Vm
概念:单位物质的量气体所占的体积。
V
(标况)
÷vm
×vm
÷Vm×NA
Vm×NA÷
分子
离子
电子
原子
质量
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
m
n
N
÷ρ
× ρ
4、有关“物质的量”的计算关系
①V=m/ ρ
②V=n×Vm(V=m/M×Vm、V=N/NA×Vm)
3.求S.T.P下的V
第二节 气体摩尔体积
标准状况下的气体摩尔体积示意图
22.4L
(标准状况)
6.02×1023分子
(第一课时)
上一节课我们学习了“物质的量(n)”及其单位摩尔(mol),由n可以求出哪些物理量?
[思考]
?
V(液体)
V(气)
?
质量
物质的量
微粒数
÷M
×M
×NA
÷NA
(m)
(n)
(N)
计算,试完成下表,并分析两个比值,你能得出什么结论?
0.2g
1.6g
0.05mol
0.1mol
2:1
试计算1mol氧气和氢气的体积:
对于固态和液态的物质是否也有一样的规律呢?
固体、液体物质粒子间间隔很小,在微粒数目相同的情况下,固体、液体的体积主要由粒子本身大小决定。
①物质的粒子数目;
②粒子的大小;
③粒子之间的距离;
[ 实验启示] 气体分子间的平均距离要比固体和液体中粒子之间的平均距离大得多。
0℃1 mol H2O( 18 mL)
100℃1 mol H2O (g) (3.06×104 mL)
(体积扩大1700倍)
标准状况下气体摩尔体积要点:
条件:标准状况
(S.T.P)
对象:任何气体
物质的量:1mol
结论
体积约占
22.4L
22.4L
(标准状况)
6.02×1023分子
0.282m
标准状况下的气体摩尔体积示意图
常用单位有L/mol(L·mol-1)和m3/mol。
Vm=
V
n
公式:
符号为Vm
概念:单位物质的量气体所占的体积。
V
(标况)
÷vm
×vm
÷Vm×NA
Vm×NA÷
分子
离子
电子
原子
质量
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
m
n
N
÷ρ
× ρ
物质的量与质量、微粒数、体积之间的关系
[练习]
1. 标准状况下,1mol任何物质的体积都约是22.4L。
(错,物质应是气体)
2. 1mol气体的体积约为22.4L。
(错,应标明条件-标准状况)
3. 标准状况下,1molO2和N2混合气体的体积约为22.4L。
(对,气体体积与分子种类无关)
4. 22.4L气体所含分子数一定大于11.2L气体所含的分子数。
(错,未指明气体体积是否在相同条件下测定)
5. 标准状况下,气体的摩尔体积都是22.4L。
(错,“约为”;单位应为L/mol)
6. 只有在标准状况下,气体的摩尔体积才可能约为22.4L/mol。
(错,不一定)
[练习]
下列说法正确的是( )
(A)在标准状况下,1mol水和1molH2的体积都约是22.4L
(B)2gH2和44gCO2的体积相等
(C)1mol某气体的体积为22.4L,则该气体一定处于标准状况
(D)在标准状况下,1gH2和11.2LO2的物质的量相等
[答案] (D)
[练习] 在同温同压下,相同质量的下列气体,占有的体积由大到小的顺序是——
[讨论] 在一定温度和压强下,并不一定是标准状况,1mol不同的气体体积是否相同?
①Cl2 ②N2 ③H2 ④CO2 ⑤O2
[答案] ③>②>⑤>④>①
在同温同压下,相同分子数的气体,其体积 ( );
在同温同压下,体积相同的气体,其分子数
在同温同压下,气体体积的大小与分子数目成( )比。
相同
相同
正
[讨论] 请列出标准状况下求算气体体积可能的方法:
1、V=m/ ρ
2、V=n×Vm
(V=m/M×Vm V=N/NA×Vm)
ρ
ρ
[练习] 在标准状况下
(1)0.5molHCl占有的体积是多少? (2)33.6LH2的物质的量是多少?
(3)16gO2的体积是多少?
(4)44.8LN2中含有的N2分子数是多少?
(11.2L)
(1.5mol)
(11.2L)
(2×6.02×1023个)
小 结
2.标准状况下的气体摩尔体积(Vm=22.4L/mol)理解要点:
条件:标准状况(S.T.P)
对象:任何气体
物质的量:1mol
体积约占22.4L
结论
1、气体摩尔体积
常用单位有L/mol(L·mol-1)和m3/mol。
Vm=
V
n
公式:
符号为 Vm
概念:单位物质的量气体所占的体积。
V
(标况)
÷vm
×vm
÷Vm×NA
Vm×NA÷
分子
离子
电子
原子
质量
物质的量
微粒数
质子
中子
÷M
×M
×NA
÷NA
m
n
N
÷ρ
× ρ
4、有关“物质的量”的计算关系
①V=m/ ρ
②V=n×Vm(V=m/M×Vm、V=N/NA×Vm)
3.求S.T.P下的V
