人教版(五四制)八年级全一册化学 第二单元 我们周围的空气 复习 课件(68张ppt)
文档属性
| 名称 | 人教版(五四制)八年级全一册化学 第二单元 我们周围的空气 复习 课件(68张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-16 17:05:22 | ||
图片预览










文档简介
(共68张PPT)
第二单元 我们周围的空气
复习课件
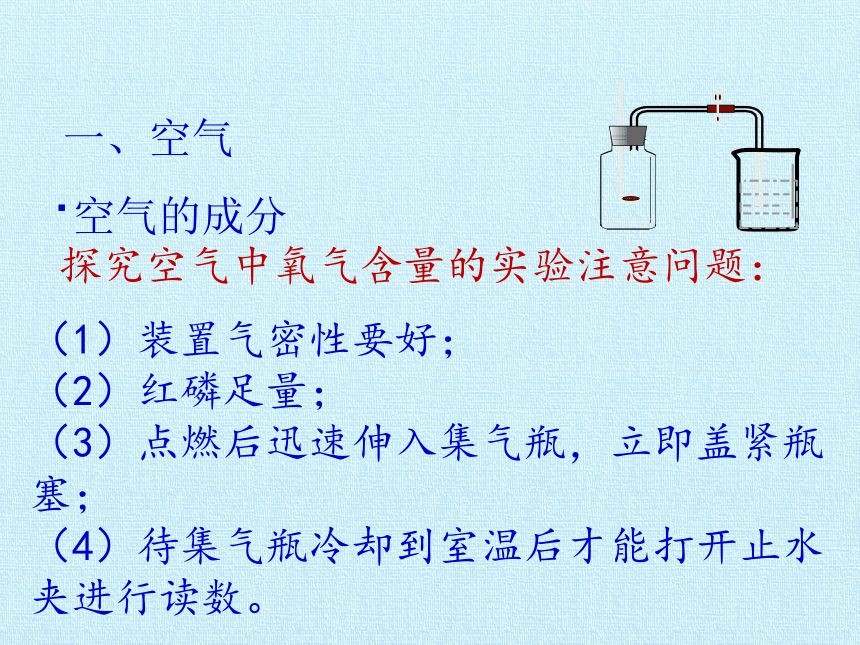
(1)装置气密性要好;
(2)红磷足量;
(3)点燃后迅速伸入集气瓶,立即盖紧瓶塞;
(4)待集气瓶冷却到室温后才能打开止水夹进行读数。
探究空气中氧气含量的实验注意问题:
一、空气
·空气的成分
1.实验中,要求红磷要足量,为什么?
为了确保氧气被消耗完。
2.为什么点燃的红磷要立即伸入集气瓶中?
一是减少实验误差,二是防止白烟污染空气。
3.能否用铁、木炭或硫代替红磷测定空气中氧气的含量?
不能用铁,因为铁在空气中不能燃烧,也不能用木炭或硫,因为木炭和硫在空气中燃烧分别生成气体二氧化碳和二氧化硫,使水不倒流。
对于测定空气中氧气含量的实验用到的反应物的要求是:只能与空气中的氧气反应,生成物是固体。
拉瓦锡通过实验得出的结论是氧气约占空气总体积的1/5,而在我们的实验中,气体减少的体积往往小于1/5,可能的原因有:
1.红磷的量不够,未将集气瓶中的氧气消耗完。
2.未恢复到室温就打开止水夹读数。
3.实验装置漏气。
4.导管中还有一段水柱没有被压入集气瓶中。
【练习1】镁+氮气 → 氮化镁。欲测定空气中氧气的含量,应该选择的最佳物质是( )
A.硫磺 B.红磷
C.铁丝 D.镁带
点燃
B
空气的组成:含有多种气体
氮气(N2) (78%)
氧 气(O2) (21%)
稀有气体
杂质
其他气体
二氧化碳(CO2)
空气主要是由氮气(N2)和氧气(O2)组成的。
(0.94%)
(0.03%)
(0.03%)
体积分数
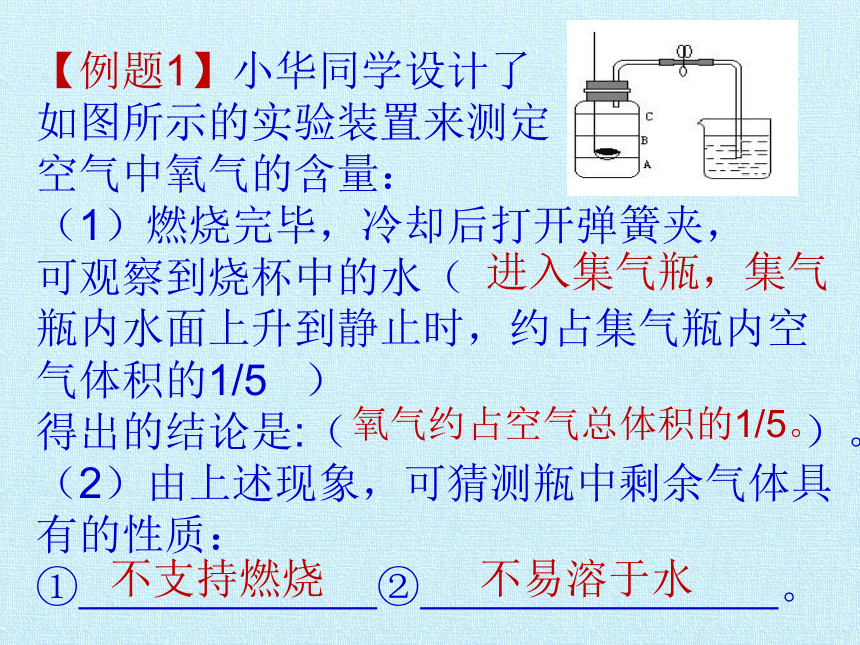
【例题1】小华同学设计了
如图所示的实验装置来测定
空气中氧气的含量:
(1)燃烧完毕,冷却后打开弹簧夹,
可观察到烧杯中的水(
瓶内水面上升到静止时,约占集气瓶内空气体积的1/5 )
得出的结论是:( )。
(2)由上述现象,可猜测瓶中剩余气体具有的性质:
① ② 。
进入集气瓶,集气
氧气约占空气总体积的1/5。
不易溶于水
不支持燃烧
(3)若实验过程中,发现进入瓶内水的体积小于1/5,可能的原因有 。
①红磷用量偏少;②装置漏气;③反应后没有冷却到原来温度;④烧杯中水太少。
【练习2】取容器为1L的集气瓶,将足量的红磷放入密闭瓶中燃烧至熄灭,剩余气体的体积大约为 ( )
A.0.3L B.0.5L
C.0.2 D.0.79L
①②③④
D
【拓展提升1】某课外活动小组在学习了书本“空气中氧气含量的测定”实验,知道P2O5不能随便排放在空气中,否则会对空气造成污染,所以对该实验进行了改进:在由两个注射器组成的密闭系统内共有50mL空气,如右图。然后给装有红磷的玻璃管加热。
同时交替推动两个注射器的活塞,至玻璃管内的红磷变成白烟,且较长时间内无进一步变化时停止。停止加热后,待冷却至室温将气体全部推至一个注射器内。
请根据你对上述实验的理解,回答下列问题:
(1)实验结束后,注射器内的气体体积理论上应该减少
约 mL 。
(2)在实验的加热过程中,交替缓慢推动两个注射器的目的是 。
10
使注射器内的氧气充分与红磷反应
动植物呼吸
氧气的用途之一:供给呼吸
潜水
太空作业
医疗急救
二、空气是一种宝贵的资源
1.氧气(O2)
氧气的用途之二:支持燃烧
炼钢
宇宙航行
气割
气焊
支持燃烧
氧气的用途其它用途:化工生产
2.氮气
①制造硝酸和氮肥的重要原料;
②作保护气(利用其化学性质不活泼,如焊接金属作保护气,灯泡充氮气以延长使用寿命、食品包装中充氮气防腐);
③液氮冷冻麻醉;
④液氮制造低温环境,如超导材料在液氮低温环境下能显示超导性。
氮气的物理性质
氮气的化学性质:不活泼。
颜色 状态 气味 标准状况下的密度 熔点 沸点 是否溶于水
氮气 1.251g/L
熔沸点低
气体
无色
不易溶于水
无味
-209.9℃ -195.8℃
比空气密度小(1.293g/L)
作保护气
氦气(He)
3.稀有气体
氙气(Xe)
氩气(Ar)
氖气(Ne)
氪气(Kr)
氡气(Rn)
颜色的光,可制成多种用途的电光源,如:
稀有气体的性质:
无色、无味、化学性质很不活泼。
航标灯
强照明灯
闪光灯
霓虹灯
激光
稀有气体的用途:
①稀有气体在通电时能发出不同
飞机腹部的氖灯闪烁
验电笔的氖管发光
②氦气可用于制造低温环境,用于飞艇。
③做保护气
稀有气体的用途:
【练习3】空气是一种重要的资源,下列现象跟空气中的哪种成分有关?
(1)支持燃烧,供给呼吸 ;(2)制造化肥或炸药 ;(3)霓虹灯发出不同颜色的光 ;(4)植物的光合作用 。
氧气(O2)
二氧化碳(CO2)
氮气(N2)
稀有气体
空气污染的危害
被污染的空气严重损害人体健康、影响作物生长、破坏生态平衡。全球气候变暖、臭氧层破坏和酸雨等也都与空气污染有关。
·保护空气
有害气体(如CO、SO2和氮氧化物)和烟尘两类。
空气中污染物分为两类:
空气污染物主要来自:
汽车尾气、工业废气、土地沙漠化等。
保护空气的措施:
我们可以采取加强大气质量监测,改善环境状况,使用清洁能源,积极植树、造林、种草等措施,以保护空气。
三大环境问题
(1)酸雨:二氧化硫(SO2)等
(2)温室效应:二氧化碳(CO2)等
(3)臭氧(O3)空洞:氟氯烃(氟利昂)
重点城市某日空气质量日报
城市 污染指数 首要 污染物 空气质量级别 空气质
量状况
郑州 82 可吸入颗粒物 Ⅱ 良
海口 32 二氧化氮 Ⅰ 优
拉萨 37 二氧化硫 Ⅰ 优
北京 104 可吸入颗粒物 Ⅲ 轻度污染
目前计入空气污染指数的项目暂定为:
可吸入颗粒物
和臭氧(O3)等。
二氧化硫(SO2)
、二氧化氮(NO2) 、
、一氧化碳(CO)
可吸入颗粒物:指漂浮在空气中粒径小于10微米的颗粒物(PM10),包括固体,液体颗粒等,能被人体吸入。
【练习4】把下列空气污染物与污染物类型连线。
一氧化碳
建筑工地扬尘 气体污染物
二氧化硫 粉尘污染物
沙尘暴
1.无色、无味的气体
2.密度(1.429 g/L)比空气略大
氧气的物理性质
101kPa,-183 ℃
3. 氧气不易溶于水,在室温下,1L水中只能溶解30mL氧气。
蓝色钢瓶
→
←
←
→
101kPa,-218℃
氧气
液氧
固态氧
(无色)
(淡蓝色)
(淡蓝色雪花状)
4.
三、氧气
【练习5】如图是一瓶用排水法收集好的氧气,据此判断相关的物理性质是( )
A.氧气能供给动植物呼吸
B.不易溶于水,密度比空气大
C.不易溶于水,密度比空气小
D.通常,氧气为淡蓝色气体
B
氧气能使带火星的木条复燃,氧气能支持燃烧。
这种方法可以用来检验氧气:将带火星的木条伸入集气瓶内,如木条复燃,则证明瓶内装的是氧气。
氧气的化学性质
【现象】 ①淡蓝色火焰;②放热;③生成有刺激性气味气体。
硫在空气中燃烧
硫在氧气中燃烧
【现象】 ①蓝紫色火焰;②放热;③生成有刺激性气味气体。
硫 + 氧气 二氧化硫
点燃
S
O2
SO2
二氧化硫是一种空气污染物,且能溶于水,瓶底加少量水是为了吸收产生的二氧化硫,防止扩散到空气中对空气造成污染。
【现象】 ①发红;②放热
木炭与氧气反应
木炭在空气中燃烧
木炭在氧气中燃烧
【现象】 ①发出白光;②放热;③木炭在氧气中燃烧比在空气中燃烧剧烈; ④生成的气体能使澄清石灰水变浑浊。
碳 + 氧气 二氧化碳
点燃
C
O2
CO2
Fe
O2
Fe3O4
【思考】实验前为什么在瓶底放一些水或铺一层细沙?
铁 + 氧气 四氧化三铁
点燃
铁与氧气反应
【实验现象】 ①剧烈燃烧,火星四射;②放出大量热;③生成黑色固体。
为了防止燃烧过程生成的高温熔化物溅落瓶底,使集气瓶炸裂。
硫燃烧要在集气瓶底部装少量水,不能用少量细沙来代替水,因为细沙不能吸收二氧化硫。
木炭、硫、铁分别在空气中和氧气中燃烧的现象不同,说明反应的剧烈程度取决于氧气的含量,氧气含量越高,燃烧越剧烈。也说明氧气的化学性质比较活泼。
检验氧气的方法:将带有火星的木条伸入集气瓶内,如木条复燃,则证明瓶内装的是氧气。
氧气在点燃条件下可以与某些非金属反应,可以与某些金属发生反应,而且可燃物在氧气里燃烧比在空气里燃烧要剧烈,某些在空气里不能燃烧的物质却可以在氧气中燃烧。这说明……
氧气的化学性质比较活泼。
【练习6】不同物质在氧气中燃烧的现象不同。根据下列现象判断并填空:
实验现象和特征
文字表达式
火星四射,生成黑色固体
白光,石灰水变浑浊
产生大量白烟
发出明亮蓝紫色火焰
铁 + 氧气 四氧化三铁
点燃
点燃
硫 + 氧气 二氧化硫
磷 + 氧气 五氧化二磷
点燃
点燃
碳 + 氧气 二氧化碳
过氧化氢 水 + 氧气
氯酸钾 氯化钾+氧气
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
二氧化锰
二氧化锰
加热
(一)实验室制法
O2
K2MnO4
MnO2
KMnO4
H2O
O2
H2O2
KCl
O2
KClO3
1.原理:
氧气实验室制法的三个式子中,都有二氧化锰,但它们的含义却不同,请说出它们的区别。
氧气的制法
气体发生装置
气体收集装置
2.实验装置
因为氧气不易溶于水,所以可以用排水法收集。
【仪器组装顺序】先下后上,先左后右
怎样检查装置的气密性?
【原理】升高温度,使试管内空气受热膨胀。
把一试管与带导管的橡胶塞相连接,导管的另一端放进盛水的烧杯中,用手握紧试管,观察水中的导管口有没有气泡冒出并在导管内形成一段水柱。如果有气泡冒出,说明装置的气密性良好;否则说明装置漏气。
(1)为什么要在试管口放一团棉花?
答:为了防止加热时高锰酸钾粉末进入导管,使导管堵塞。
棉花
3.实验中的注意事项
(3)试管口为什么要略向下倾斜?
防止冷凝的水回流到热的试管底部,使试管炸裂。
(2)导气管伸入发生装置内不能太长,稍露出橡皮塞即可,为什么?
有利于产生的气体排出。
(4)对高锰酸钾所在的部位加热前,先使酒精灯火焰在试管下方来回移动,其目的是什么?
答:让试管均匀受热。
(5)为什么导管口开始有气泡冒出时,不能立即收集氧气?什么时候开始收集?
答:因为开始冒出的气泡是空气。当气泡连续而均匀地放出时,开始收集氧气。
(6)收集满氧气的集气瓶为什么要正立放在桌面上?
答:因为氧气的密度比空气的密度大,倒放会使氧气从瓶口与玻璃片的缝隙中跑掉。
O2
O2
(7)实验结束时为什么要先从水槽中取出导管,后熄灭酒精灯?
防止水倒吸回热的试管,使试管炸裂。
4.实验室制取氧气的步骤
④点燃酒精灯加热;
⑦熄灭酒精灯。
③固定好试管;
②把药品装入试管;
①要检查装置的气密性;
⑥把导管移出水槽;
⑤用排水集气法收集;
息
茶
收
点
利
定
庄
1.如何选择收集气体的装置?
气体收集装置取决于该气体的性质,根据气体的溶解性和密度来选择。排水法适合于收集不易或难溶于水的气体,向下排空气法适合于收集密度比空气小的气体,向上排空气法适合于收集密度比空气大的气体。
几点思考
2.用排水法和排空气法收集气体各有什么优缺点?
3.用排空气法收集氧气如何知道氧气收集满了?
排水法收集气体的优点是收集到的气体比较纯净,缺点是含有水分;排空气法收集气体的优点是收集到的气体比较干燥,缺点是不太纯。
用带火星的木条平放在瓶口,若木条复燃,证明氧气收集满了。
固体加热型气体发生装置
反应物是固体,条件是加热的气体制取,都可以用这样的发生装置,简称固体加热型。
固液常温型
凡是反应物状态是固体和液体,反应条件是常温的气体制取,都可以用这样的发生装置,简称固液常温型。
【讨论】固液常温型使用了长颈漏斗制气体的装置如何检查气密性?
方法一:由长颈漏斗锥形瓶中加水,使长颈漏斗的下端管口在液面以下,然后用弹簧夹夹紧橡皮管,向长颈漏斗中加水至漏斗内有水,若液面不下降,则说明装置的气密性良好。
方法二:向容器中加水,使长颈漏斗的下端管口在液面以下,然后将导管的一端放入水中,再用手握住试管,如果导管口有气泡产生,松开手一段时间后,导管内形成一段水柱,则说明装置的气密性良好。
实验:用过氧化氢溶液制取氧气
【例题2】结合下列实验装置回答相关问题:
(1) 写出A装置中a、b仪器的名称:a 、b 。
(2)利用该装置制取氧气的文字表达式
为 。
(3)若用B作制气装置,与A相比,其优点(写一点)
(4)用氯酸钾和二氧化锰制氧气,若选用A作发生装置,则还要增加 (填仪器名称),并把A作如下改动: 。
(5)若用C收集氧气,检验是否收集满的方法是 。
B中的注射器相当于分液漏斗,便于控制反应速度,想加液体时推动活塞,也可控制液量的多少。
酒精灯
将试管横放并使试管口略向下倾斜
将带火星的木条平放在集气瓶口,木条复燃,则收集满了
铁架台
试管
过氧化氢 → 水+氧气
二氧化锰
【例题2】结合下列实验装置回答相关问题:
(6)若用D收集氧气,收集满氧气后应注意的事项是 。
(7)实验室用加热高锰酸钾制取氧气可分下列步骤:①用带导管的塞子塞紧试管,并把它固定在铁架台;②点燃酒精灯,加热试管;③检查装置的气密性;④将高锰酸钾粉末加入试管,塞上棉花;⑤用排水法收集氧气;⑥熄灭酒精灯;⑦将导管从水槽中取出。正确的操作是(填序号) 。
先从水槽中移出导管,再熄灭酒精灯。
③④①②⑤⑦⑥
【拓展提升2】下图是实验室制取气体的一些装置,据图回答有关问题。(提示:以下所选装置均填装置序号)
(1)写出指定仪器的名称:① ;② 。
(2)写出一个初中化学中用装置C制气体的文字表达式 ;
收集此气体可选用的一种装置是 。
(3)实验室在常温下用块状电石与水反应制取微溶于水的乙炔气体,该反应必须严格控制加水速度,以免剧烈反应放热引起发生装置炸裂。你认为上图中最适合制取乙炔气体的发生装置是 。
试管
集气瓶
氯酸钾 → 氯化钾+氧气
高锰酸钾 → 锰酸钾+二氧化锰+氧气
加热
加热
二氧化锰
或
D或E
A
(二)氧气的工业制法
在低温条件下加压,使空气转化成液态,然后蒸发,利用液态氮(沸点-196℃)和液态氧(沸点-183℃)的沸点不同,氮气先从液态空气中蒸发出来,剩余的主要为氧气。
在一定压力下,让空气通过具有富集氧气功能的薄膜,可得到含氧量较高的富氧空气。
分离液态空气法:
膜分离法:
氧气的工业制法和实验室制法的本质区别是什么?
氧气的工业制法是物理变化,
氧气的实验室制法是化学变化。
【例题3】下图所示装置有许多用途:
(1)用于排空气法收集氧气,氧气应从_____端通入。
(2)用于排水法收集氧气,瓶中先装满水,氧气从_____端通入。
(3)瓶中储存氧气,用水将氧气排出时,水从____端通入。
(4)在医院给病人输氧时,瓶中放约半瓶蒸馏水,这时氧气从_____端通入。
A
A
B
A
催化剂:在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都 没有改变的物质叫做催化剂(又叫触媒)。
催化剂的特点:
一变:
两不变:
改变化学反应速率
质量和化学性质都不变化
催化作用:催化剂在化学反应中所起到的作用。
(一)催化剂
四、几个基本概念
思考:要证明某物质是某反应的催化剂,需从哪几个方面设计实验证明?
磷+氧气 五氧化二磷
点燃
硫+氧气 二氧化硫
点燃
铁+氧气 四氧化三铁
点燃
(二)化学反应基本类型
化合反应:由两种或两种以上的物质生成一种物质的反应。
氧化反应:物质跟氧气发生的反应。
氧气在氧化反应中表现出氧化性。
石蜡 + 氧气 二氧化碳 +水
石蜡燃烧不是化合反应,是氧化反应。
点燃
氢气+氯气 → 氯化氢
点燃
是化合反应,不是氧化反应。
化合反应不一定是氧化反应,氧化反应也不一定是化合反应,化合反应和氧化反应之间没有必然的联系。
一个有氧气参加的化合反应既是化合反应又是氧化反应。
缓慢氧化也要放热,只是不像燃烧那样剧烈,甚至不易觉察。
进行得很慢,不容易被察觉的氧化叫缓慢氧化。
日常生活中的缓慢氧化:动植物的呼吸、食物的腐烂、酒和醋的酿造、农家肥的腐熟。
燃烧和缓慢氧化的区别与联系:
燃烧是指可燃物发生的一种剧烈的发光、发热的氧化反应。进行得很缓慢且不发光甚至不易察觉的氧化反应称为缓慢氧化。从发生的条件来看,都是可以被氧化的物质跟氧气(也可以是其他物质)接触。不同的是反应的剧烈程度不同。从反应的实质来看,都是氧化反应,都有热量产生。从现象来看,燃烧是发光、发热的剧烈反应。缓慢氧化有热量产生,但不易察觉到升温的变化。
三个制取氧气的反应共同特征是……
过氧化氢 水 + 氧气
氯酸钾 氯化钾+氧气
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
二氧化锰
二氧化锰
加热
由一种物质生成两种或两种以上其它物质的反应,叫做分解反应。
分解反应可表示为: AB→A+B
分解反应的特点:一变多
化合反应可表示为: A+B → AB
化合反应的特点是:多变一
注意:化合反应与分解反应都属于化学反应的基本类型,氧化反应不属于化学反应的基本类型。
【练习7】下列化学反应既不属于分解反应又不属于化合反应的是 ( )
A.硫+氧气 → 二氧化硫
B.高锰酸钾 → 锰酸钾+二氧化锰+氧气
C.氢气+氯气 → 氯化氢
D.二氧化碳+氢氧化钙→碳酸钙+水
【练习8】当天空打雷放电时,空气中有极少量的氧气会转变成臭氧,该反应可表示为氧气→臭氧,下列说法正确的是( )
A.该变化是物理变化
B.该变化是化学变化
C.该反应是分解反应
D.该反应是化合反应
D
B
点燃
点燃
加热
纯净物:
混合物:
物质
(三)物质的初步分类
由一种物质组成。
由两种或两种以上的物质混合而成。
如:氮气、氧气、红磷、二氧化碳、五氧化二磷、蒸馏水
如:空气、糖水、盐水、碘酒、加碘盐、食醋、海水、石油、墨水、铝合金
在理解“混合物”、“纯净物”概念时要注意以下几点:
3、纯净物有固定的组成,可以用化学符号来表示。
2、混合物没有固定的组成,没有固定的性质,如熔点、沸点等。
1、混合物中各成分保持着它们各自的性质。
氮气、氧气、红磷、二氧化碳、五氧化二磷、蒸馏水
N2 O2 P CO2 P2O5 H2O
4、自然界中绝对纯净的物质是没有的。所谓纯净物只是指含杂质极少、纯度很高的物质,而且所含杂质的量不会影响科研和生产。但必须注意不能把洁净、清澈的物质误认为是纯净物。
思考:组成混合物的各种物质之间不能发生化学反应,这句话对吗?为什么?
不对。因为混合物的性质之一是混合物中各组分之间没有发生反应,这并不等于各组分之间不能发生反应。如果外界给予一定条件,则各组分之间可能会发生化学变化。例如一般情况下,空气中的氧气和氮气没有发生化学变化。但如果天空中有闪电,则闪电产生的电火花可以使空气中的氧气和氮气发生反应,生成氮氧化合物。因此,不能说混合物中各组分之间不能发生化学变化。
【练习9】水是纯净物的特征是 ( )
A.由一种物质组成
B.是无色的
C.能洗净许多物质
D.是透明的
A
【拓展提升3】第二单元中有下列六个化学反应(其中,D能使带火星的木条复燃):
(1)无色液体A 无色液体C+D;
(2)白色固体E 白色固体F+D;
(3)紫黑色固体G H+B+D;
(4)黄色粉末M+D 刺激性气味的气体N(蓝紫色火焰);
(5)红色粉末P+D 白色固体Q(冒出白烟) ;
(6)银白色金属X+D 黑色固体Y (火星四射)
试判断并写出相应物质的名称:
A ;B ;C ;D ;E ;F ;G ;
H ;M ;N ;P ;Q ;X ;Y 。
过氧化氢
氧气
水
二氧化锰
氯化钾
氯酸钾
锰酸钾
高锰酸钾
二氧化硫
硫
五氧化二磷
红磷
四氧化三铁
铁
加热
点燃
点燃
点燃
加热
B
B
物理性质 通常情况下,氧气是无色、无味的气体,密度比空气略大,不易溶于水,在压强为101KPa时,氧气在-183℃时变为淡蓝色液体,在-218℃时变成淡蓝色雪花状的固体。
化学性质 1 硫+氧气 二氧化硫
2 碳+氧气 二氧化碳
3 铁+氧气 四氧化三铁
化学性质比较活泼,在氧化反应中提供氧,具有氧化性。
单元小结
氧气
实验室制法 反应原理 高锰酸钾 锰酸钾+二氧化锰+氧气
实验装置
收集方法 排水法或向上排空气法
注意事项 ①加热高锰酸钾制氧气要在试管口放一团棉花;②导气管伸入发生装置内不能太长,稍露出橡皮塞即可;③试管口要略向下倾斜;④加热前,先预热热;⑤因为开始冒出气泡时不能立即收集。当气泡连续而均匀地放出时,开始收集氧气;⑥收集好氧气的集气瓶要正放在桌上;⑦实验完毕时,先要把导管移出水面,然后再熄灭酒精灯。
用途 供给呼吸、支持燃烧
谢 谢
第二单元 我们周围的空气
复习课件
(1)装置气密性要好;
(2)红磷足量;
(3)点燃后迅速伸入集气瓶,立即盖紧瓶塞;
(4)待集气瓶冷却到室温后才能打开止水夹进行读数。
探究空气中氧气含量的实验注意问题:
一、空气
·空气的成分
1.实验中,要求红磷要足量,为什么?
为了确保氧气被消耗完。
2.为什么点燃的红磷要立即伸入集气瓶中?
一是减少实验误差,二是防止白烟污染空气。
3.能否用铁、木炭或硫代替红磷测定空气中氧气的含量?
不能用铁,因为铁在空气中不能燃烧,也不能用木炭或硫,因为木炭和硫在空气中燃烧分别生成气体二氧化碳和二氧化硫,使水不倒流。
对于测定空气中氧气含量的实验用到的反应物的要求是:只能与空气中的氧气反应,生成物是固体。
拉瓦锡通过实验得出的结论是氧气约占空气总体积的1/5,而在我们的实验中,气体减少的体积往往小于1/5,可能的原因有:
1.红磷的量不够,未将集气瓶中的氧气消耗完。
2.未恢复到室温就打开止水夹读数。
3.实验装置漏气。
4.导管中还有一段水柱没有被压入集气瓶中。
【练习1】镁+氮气 → 氮化镁。欲测定空气中氧气的含量,应该选择的最佳物质是( )
A.硫磺 B.红磷
C.铁丝 D.镁带
点燃
B
空气的组成:含有多种气体
氮气(N2) (78%)
氧 气(O2) (21%)
稀有气体
杂质
其他气体
二氧化碳(CO2)
空气主要是由氮气(N2)和氧气(O2)组成的。
(0.94%)
(0.03%)
(0.03%)
体积分数
【例题1】小华同学设计了
如图所示的实验装置来测定
空气中氧气的含量:
(1)燃烧完毕,冷却后打开弹簧夹,
可观察到烧杯中的水(
瓶内水面上升到静止时,约占集气瓶内空气体积的1/5 )
得出的结论是:( )。
(2)由上述现象,可猜测瓶中剩余气体具有的性质:
① ② 。
进入集气瓶,集气
氧气约占空气总体积的1/5。
不易溶于水
不支持燃烧
(3)若实验过程中,发现进入瓶内水的体积小于1/5,可能的原因有 。
①红磷用量偏少;②装置漏气;③反应后没有冷却到原来温度;④烧杯中水太少。
【练习2】取容器为1L的集气瓶,将足量的红磷放入密闭瓶中燃烧至熄灭,剩余气体的体积大约为 ( )
A.0.3L B.0.5L
C.0.2 D.0.79L
①②③④
D
【拓展提升1】某课外活动小组在学习了书本“空气中氧气含量的测定”实验,知道P2O5不能随便排放在空气中,否则会对空气造成污染,所以对该实验进行了改进:在由两个注射器组成的密闭系统内共有50mL空气,如右图。然后给装有红磷的玻璃管加热。
同时交替推动两个注射器的活塞,至玻璃管内的红磷变成白烟,且较长时间内无进一步变化时停止。停止加热后,待冷却至室温将气体全部推至一个注射器内。
请根据你对上述实验的理解,回答下列问题:
(1)实验结束后,注射器内的气体体积理论上应该减少
约 mL 。
(2)在实验的加热过程中,交替缓慢推动两个注射器的目的是 。
10
使注射器内的氧气充分与红磷反应
动植物呼吸
氧气的用途之一:供给呼吸
潜水
太空作业
医疗急救
二、空气是一种宝贵的资源
1.氧气(O2)
氧气的用途之二:支持燃烧
炼钢
宇宙航行
气割
气焊
支持燃烧
氧气的用途其它用途:化工生产
2.氮气
①制造硝酸和氮肥的重要原料;
②作保护气(利用其化学性质不活泼,如焊接金属作保护气,灯泡充氮气以延长使用寿命、食品包装中充氮气防腐);
③液氮冷冻麻醉;
④液氮制造低温环境,如超导材料在液氮低温环境下能显示超导性。
氮气的物理性质
氮气的化学性质:不活泼。
颜色 状态 气味 标准状况下的密度 熔点 沸点 是否溶于水
氮气 1.251g/L
熔沸点低
气体
无色
不易溶于水
无味
-209.9℃ -195.8℃
比空气密度小(1.293g/L)
作保护气
氦气(He)
3.稀有气体
氙气(Xe)
氩气(Ar)
氖气(Ne)
氪气(Kr)
氡气(Rn)
颜色的光,可制成多种用途的电光源,如:
稀有气体的性质:
无色、无味、化学性质很不活泼。
航标灯
强照明灯
闪光灯
霓虹灯
激光
稀有气体的用途:
①稀有气体在通电时能发出不同
飞机腹部的氖灯闪烁
验电笔的氖管发光
②氦气可用于制造低温环境,用于飞艇。
③做保护气
稀有气体的用途:
【练习3】空气是一种重要的资源,下列现象跟空气中的哪种成分有关?
(1)支持燃烧,供给呼吸 ;(2)制造化肥或炸药 ;(3)霓虹灯发出不同颜色的光 ;(4)植物的光合作用 。
氧气(O2)
二氧化碳(CO2)
氮气(N2)
稀有气体
空气污染的危害
被污染的空气严重损害人体健康、影响作物生长、破坏生态平衡。全球气候变暖、臭氧层破坏和酸雨等也都与空气污染有关。
·保护空气
有害气体(如CO、SO2和氮氧化物)和烟尘两类。
空气中污染物分为两类:
空气污染物主要来自:
汽车尾气、工业废气、土地沙漠化等。
保护空气的措施:
我们可以采取加强大气质量监测,改善环境状况,使用清洁能源,积极植树、造林、种草等措施,以保护空气。
三大环境问题
(1)酸雨:二氧化硫(SO2)等
(2)温室效应:二氧化碳(CO2)等
(3)臭氧(O3)空洞:氟氯烃(氟利昂)
重点城市某日空气质量日报
城市 污染指数 首要 污染物 空气质量级别 空气质
量状况
郑州 82 可吸入颗粒物 Ⅱ 良
海口 32 二氧化氮 Ⅰ 优
拉萨 37 二氧化硫 Ⅰ 优
北京 104 可吸入颗粒物 Ⅲ 轻度污染
目前计入空气污染指数的项目暂定为:
可吸入颗粒物
和臭氧(O3)等。
二氧化硫(SO2)
、二氧化氮(NO2) 、
、一氧化碳(CO)
可吸入颗粒物:指漂浮在空气中粒径小于10微米的颗粒物(PM10),包括固体,液体颗粒等,能被人体吸入。
【练习4】把下列空气污染物与污染物类型连线。
一氧化碳
建筑工地扬尘 气体污染物
二氧化硫 粉尘污染物
沙尘暴
1.无色、无味的气体
2.密度(1.429 g/L)比空气略大
氧气的物理性质
101kPa,-183 ℃
3. 氧气不易溶于水,在室温下,1L水中只能溶解30mL氧气。
蓝色钢瓶
→
←
←
→
101kPa,-218℃
氧气
液氧
固态氧
(无色)
(淡蓝色)
(淡蓝色雪花状)
4.
三、氧气
【练习5】如图是一瓶用排水法收集好的氧气,据此判断相关的物理性质是( )
A.氧气能供给动植物呼吸
B.不易溶于水,密度比空气大
C.不易溶于水,密度比空气小
D.通常,氧气为淡蓝色气体
B
氧气能使带火星的木条复燃,氧气能支持燃烧。
这种方法可以用来检验氧气:将带火星的木条伸入集气瓶内,如木条复燃,则证明瓶内装的是氧气。
氧气的化学性质
【现象】 ①淡蓝色火焰;②放热;③生成有刺激性气味气体。
硫在空气中燃烧
硫在氧气中燃烧
【现象】 ①蓝紫色火焰;②放热;③生成有刺激性气味气体。
硫 + 氧气 二氧化硫
点燃
S
O2
SO2
二氧化硫是一种空气污染物,且能溶于水,瓶底加少量水是为了吸收产生的二氧化硫,防止扩散到空气中对空气造成污染。
【现象】 ①发红;②放热
木炭与氧气反应
木炭在空气中燃烧
木炭在氧气中燃烧
【现象】 ①发出白光;②放热;③木炭在氧气中燃烧比在空气中燃烧剧烈; ④生成的气体能使澄清石灰水变浑浊。
碳 + 氧气 二氧化碳
点燃
C
O2
CO2
Fe
O2
Fe3O4
【思考】实验前为什么在瓶底放一些水或铺一层细沙?
铁 + 氧气 四氧化三铁
点燃
铁与氧气反应
【实验现象】 ①剧烈燃烧,火星四射;②放出大量热;③生成黑色固体。
为了防止燃烧过程生成的高温熔化物溅落瓶底,使集气瓶炸裂。
硫燃烧要在集气瓶底部装少量水,不能用少量细沙来代替水,因为细沙不能吸收二氧化硫。
木炭、硫、铁分别在空气中和氧气中燃烧的现象不同,说明反应的剧烈程度取决于氧气的含量,氧气含量越高,燃烧越剧烈。也说明氧气的化学性质比较活泼。
检验氧气的方法:将带有火星的木条伸入集气瓶内,如木条复燃,则证明瓶内装的是氧气。
氧气在点燃条件下可以与某些非金属反应,可以与某些金属发生反应,而且可燃物在氧气里燃烧比在空气里燃烧要剧烈,某些在空气里不能燃烧的物质却可以在氧气中燃烧。这说明……
氧气的化学性质比较活泼。
【练习6】不同物质在氧气中燃烧的现象不同。根据下列现象判断并填空:
实验现象和特征
文字表达式
火星四射,生成黑色固体
白光,石灰水变浑浊
产生大量白烟
发出明亮蓝紫色火焰
铁 + 氧气 四氧化三铁
点燃
点燃
硫 + 氧气 二氧化硫
磷 + 氧气 五氧化二磷
点燃
点燃
碳 + 氧气 二氧化碳
过氧化氢 水 + 氧气
氯酸钾 氯化钾+氧气
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
二氧化锰
二氧化锰
加热
(一)实验室制法
O2
K2MnO4
MnO2
KMnO4
H2O
O2
H2O2
KCl
O2
KClO3
1.原理:
氧气实验室制法的三个式子中,都有二氧化锰,但它们的含义却不同,请说出它们的区别。
氧气的制法
气体发生装置
气体收集装置
2.实验装置
因为氧气不易溶于水,所以可以用排水法收集。
【仪器组装顺序】先下后上,先左后右
怎样检查装置的气密性?
【原理】升高温度,使试管内空气受热膨胀。
把一试管与带导管的橡胶塞相连接,导管的另一端放进盛水的烧杯中,用手握紧试管,观察水中的导管口有没有气泡冒出并在导管内形成一段水柱。如果有气泡冒出,说明装置的气密性良好;否则说明装置漏气。
(1)为什么要在试管口放一团棉花?
答:为了防止加热时高锰酸钾粉末进入导管,使导管堵塞。
棉花
3.实验中的注意事项
(3)试管口为什么要略向下倾斜?
防止冷凝的水回流到热的试管底部,使试管炸裂。
(2)导气管伸入发生装置内不能太长,稍露出橡皮塞即可,为什么?
有利于产生的气体排出。
(4)对高锰酸钾所在的部位加热前,先使酒精灯火焰在试管下方来回移动,其目的是什么?
答:让试管均匀受热。
(5)为什么导管口开始有气泡冒出时,不能立即收集氧气?什么时候开始收集?
答:因为开始冒出的气泡是空气。当气泡连续而均匀地放出时,开始收集氧气。
(6)收集满氧气的集气瓶为什么要正立放在桌面上?
答:因为氧气的密度比空气的密度大,倒放会使氧气从瓶口与玻璃片的缝隙中跑掉。
O2
O2
(7)实验结束时为什么要先从水槽中取出导管,后熄灭酒精灯?
防止水倒吸回热的试管,使试管炸裂。
4.实验室制取氧气的步骤
④点燃酒精灯加热;
⑦熄灭酒精灯。
③固定好试管;
②把药品装入试管;
①要检查装置的气密性;
⑥把导管移出水槽;
⑤用排水集气法收集;
息
茶
收
点
利
定
庄
1.如何选择收集气体的装置?
气体收集装置取决于该气体的性质,根据气体的溶解性和密度来选择。排水法适合于收集不易或难溶于水的气体,向下排空气法适合于收集密度比空气小的气体,向上排空气法适合于收集密度比空气大的气体。
几点思考
2.用排水法和排空气法收集气体各有什么优缺点?
3.用排空气法收集氧气如何知道氧气收集满了?
排水法收集气体的优点是收集到的气体比较纯净,缺点是含有水分;排空气法收集气体的优点是收集到的气体比较干燥,缺点是不太纯。
用带火星的木条平放在瓶口,若木条复燃,证明氧气收集满了。
固体加热型气体发生装置
反应物是固体,条件是加热的气体制取,都可以用这样的发生装置,简称固体加热型。
固液常温型
凡是反应物状态是固体和液体,反应条件是常温的气体制取,都可以用这样的发生装置,简称固液常温型。
【讨论】固液常温型使用了长颈漏斗制气体的装置如何检查气密性?
方法一:由长颈漏斗锥形瓶中加水,使长颈漏斗的下端管口在液面以下,然后用弹簧夹夹紧橡皮管,向长颈漏斗中加水至漏斗内有水,若液面不下降,则说明装置的气密性良好。
方法二:向容器中加水,使长颈漏斗的下端管口在液面以下,然后将导管的一端放入水中,再用手握住试管,如果导管口有气泡产生,松开手一段时间后,导管内形成一段水柱,则说明装置的气密性良好。
实验:用过氧化氢溶液制取氧气
【例题2】结合下列实验装置回答相关问题:
(1) 写出A装置中a、b仪器的名称:a 、b 。
(2)利用该装置制取氧气的文字表达式
为 。
(3)若用B作制气装置,与A相比,其优点(写一点)
(4)用氯酸钾和二氧化锰制氧气,若选用A作发生装置,则还要增加 (填仪器名称),并把A作如下改动: 。
(5)若用C收集氧气,检验是否收集满的方法是 。
B中的注射器相当于分液漏斗,便于控制反应速度,想加液体时推动活塞,也可控制液量的多少。
酒精灯
将试管横放并使试管口略向下倾斜
将带火星的木条平放在集气瓶口,木条复燃,则收集满了
铁架台
试管
过氧化氢 → 水+氧气
二氧化锰
【例题2】结合下列实验装置回答相关问题:
(6)若用D收集氧气,收集满氧气后应注意的事项是 。
(7)实验室用加热高锰酸钾制取氧气可分下列步骤:①用带导管的塞子塞紧试管,并把它固定在铁架台;②点燃酒精灯,加热试管;③检查装置的气密性;④将高锰酸钾粉末加入试管,塞上棉花;⑤用排水法收集氧气;⑥熄灭酒精灯;⑦将导管从水槽中取出。正确的操作是(填序号) 。
先从水槽中移出导管,再熄灭酒精灯。
③④①②⑤⑦⑥
【拓展提升2】下图是实验室制取气体的一些装置,据图回答有关问题。(提示:以下所选装置均填装置序号)
(1)写出指定仪器的名称:① ;② 。
(2)写出一个初中化学中用装置C制气体的文字表达式 ;
收集此气体可选用的一种装置是 。
(3)实验室在常温下用块状电石与水反应制取微溶于水的乙炔气体,该反应必须严格控制加水速度,以免剧烈反应放热引起发生装置炸裂。你认为上图中最适合制取乙炔气体的发生装置是 。
试管
集气瓶
氯酸钾 → 氯化钾+氧气
高锰酸钾 → 锰酸钾+二氧化锰+氧气
加热
加热
二氧化锰
或
D或E
A
(二)氧气的工业制法
在低温条件下加压,使空气转化成液态,然后蒸发,利用液态氮(沸点-196℃)和液态氧(沸点-183℃)的沸点不同,氮气先从液态空气中蒸发出来,剩余的主要为氧气。
在一定压力下,让空气通过具有富集氧气功能的薄膜,可得到含氧量较高的富氧空气。
分离液态空气法:
膜分离法:
氧气的工业制法和实验室制法的本质区别是什么?
氧气的工业制法是物理变化,
氧气的实验室制法是化学变化。
【例题3】下图所示装置有许多用途:
(1)用于排空气法收集氧气,氧气应从_____端通入。
(2)用于排水法收集氧气,瓶中先装满水,氧气从_____端通入。
(3)瓶中储存氧气,用水将氧气排出时,水从____端通入。
(4)在医院给病人输氧时,瓶中放约半瓶蒸馏水,这时氧气从_____端通入。
A
A
B
A
催化剂:在化学反应里能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后都 没有改变的物质叫做催化剂(又叫触媒)。
催化剂的特点:
一变:
两不变:
改变化学反应速率
质量和化学性质都不变化
催化作用:催化剂在化学反应中所起到的作用。
(一)催化剂
四、几个基本概念
思考:要证明某物质是某反应的催化剂,需从哪几个方面设计实验证明?
磷+氧气 五氧化二磷
点燃
硫+氧气 二氧化硫
点燃
铁+氧气 四氧化三铁
点燃
(二)化学反应基本类型
化合反应:由两种或两种以上的物质生成一种物质的反应。
氧化反应:物质跟氧气发生的反应。
氧气在氧化反应中表现出氧化性。
石蜡 + 氧气 二氧化碳 +水
石蜡燃烧不是化合反应,是氧化反应。
点燃
氢气+氯气 → 氯化氢
点燃
是化合反应,不是氧化反应。
化合反应不一定是氧化反应,氧化反应也不一定是化合反应,化合反应和氧化反应之间没有必然的联系。
一个有氧气参加的化合反应既是化合反应又是氧化反应。
缓慢氧化也要放热,只是不像燃烧那样剧烈,甚至不易觉察。
进行得很慢,不容易被察觉的氧化叫缓慢氧化。
日常生活中的缓慢氧化:动植物的呼吸、食物的腐烂、酒和醋的酿造、农家肥的腐熟。
燃烧和缓慢氧化的区别与联系:
燃烧是指可燃物发生的一种剧烈的发光、发热的氧化反应。进行得很缓慢且不发光甚至不易察觉的氧化反应称为缓慢氧化。从发生的条件来看,都是可以被氧化的物质跟氧气(也可以是其他物质)接触。不同的是反应的剧烈程度不同。从反应的实质来看,都是氧化反应,都有热量产生。从现象来看,燃烧是发光、发热的剧烈反应。缓慢氧化有热量产生,但不易察觉到升温的变化。
三个制取氧气的反应共同特征是……
过氧化氢 水 + 氧气
氯酸钾 氯化钾+氧气
高锰酸钾 锰酸钾 + 二氧化锰 + 氧气
加热
二氧化锰
二氧化锰
加热
由一种物质生成两种或两种以上其它物质的反应,叫做分解反应。
分解反应可表示为: AB→A+B
分解反应的特点:一变多
化合反应可表示为: A+B → AB
化合反应的特点是:多变一
注意:化合反应与分解反应都属于化学反应的基本类型,氧化反应不属于化学反应的基本类型。
【练习7】下列化学反应既不属于分解反应又不属于化合反应的是 ( )
A.硫+氧气 → 二氧化硫
B.高锰酸钾 → 锰酸钾+二氧化锰+氧气
C.氢气+氯气 → 氯化氢
D.二氧化碳+氢氧化钙→碳酸钙+水
【练习8】当天空打雷放电时,空气中有极少量的氧气会转变成臭氧,该反应可表示为氧气→臭氧,下列说法正确的是( )
A.该变化是物理变化
B.该变化是化学变化
C.该反应是分解反应
D.该反应是化合反应
D
B
点燃
点燃
加热
纯净物:
混合物:
物质
(三)物质的初步分类
由一种物质组成。
由两种或两种以上的物质混合而成。
如:氮气、氧气、红磷、二氧化碳、五氧化二磷、蒸馏水
如:空气、糖水、盐水、碘酒、加碘盐、食醋、海水、石油、墨水、铝合金
在理解“混合物”、“纯净物”概念时要注意以下几点:
3、纯净物有固定的组成,可以用化学符号来表示。
2、混合物没有固定的组成,没有固定的性质,如熔点、沸点等。
1、混合物中各成分保持着它们各自的性质。
氮气、氧气、红磷、二氧化碳、五氧化二磷、蒸馏水
N2 O2 P CO2 P2O5 H2O
4、自然界中绝对纯净的物质是没有的。所谓纯净物只是指含杂质极少、纯度很高的物质,而且所含杂质的量不会影响科研和生产。但必须注意不能把洁净、清澈的物质误认为是纯净物。
思考:组成混合物的各种物质之间不能发生化学反应,这句话对吗?为什么?
不对。因为混合物的性质之一是混合物中各组分之间没有发生反应,这并不等于各组分之间不能发生反应。如果外界给予一定条件,则各组分之间可能会发生化学变化。例如一般情况下,空气中的氧气和氮气没有发生化学变化。但如果天空中有闪电,则闪电产生的电火花可以使空气中的氧气和氮气发生反应,生成氮氧化合物。因此,不能说混合物中各组分之间不能发生化学变化。
【练习9】水是纯净物的特征是 ( )
A.由一种物质组成
B.是无色的
C.能洗净许多物质
D.是透明的
A
【拓展提升3】第二单元中有下列六个化学反应(其中,D能使带火星的木条复燃):
(1)无色液体A 无色液体C+D;
(2)白色固体E 白色固体F+D;
(3)紫黑色固体G H+B+D;
(4)黄色粉末M+D 刺激性气味的气体N(蓝紫色火焰);
(5)红色粉末P+D 白色固体Q(冒出白烟) ;
(6)银白色金属X+D 黑色固体Y (火星四射)
试判断并写出相应物质的名称:
A ;B ;C ;D ;E ;F ;G ;
H ;M ;N ;P ;Q ;X ;Y 。
过氧化氢
氧气
水
二氧化锰
氯化钾
氯酸钾
锰酸钾
高锰酸钾
二氧化硫
硫
五氧化二磷
红磷
四氧化三铁
铁
加热
点燃
点燃
点燃
加热
B
B
物理性质 通常情况下,氧气是无色、无味的气体,密度比空气略大,不易溶于水,在压强为101KPa时,氧气在-183℃时变为淡蓝色液体,在-218℃时变成淡蓝色雪花状的固体。
化学性质 1 硫+氧气 二氧化硫
2 碳+氧气 二氧化碳
3 铁+氧气 四氧化三铁
化学性质比较活泼,在氧化反应中提供氧,具有氧化性。
单元小结
氧气
实验室制法 反应原理 高锰酸钾 锰酸钾+二氧化锰+氧气
实验装置
收集方法 排水法或向上排空气法
注意事项 ①加热高锰酸钾制氧气要在试管口放一团棉花;②导气管伸入发生装置内不能太长,稍露出橡皮塞即可;③试管口要略向下倾斜;④加热前,先预热热;⑤因为开始冒出气泡时不能立即收集。当气泡连续而均匀地放出时,开始收集氧气;⑥收集好氧气的集气瓶要正放在桌上;⑦实验完毕时,先要把导管移出水面,然后再熄灭酒精灯。
用途 供给呼吸、支持燃烧
谢 谢
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
