浙教版科学九年级上第2章第二节物质转化的规律
文档属性
| 名称 | 浙教版科学九年级上第2章第二节物质转化的规律 |  | |
| 格式 | zip | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2012-09-25 15:13:49 | ||
图片预览










文档简介
(共64张PPT)
一、非金属单质与其化合物的转化
硫磺
火山喷射的产物-硫磺
1、实验操作
2、实验的化学方程式
S+O2 SO2
点燃
还有哪些单质可以转化为相应的化合物?
如C、Fe、P、Mg等单质都可以在氧气中燃烧。
C+O2 CO2
点燃
2C+O2 2CO
点燃
O2充足
O2不充足
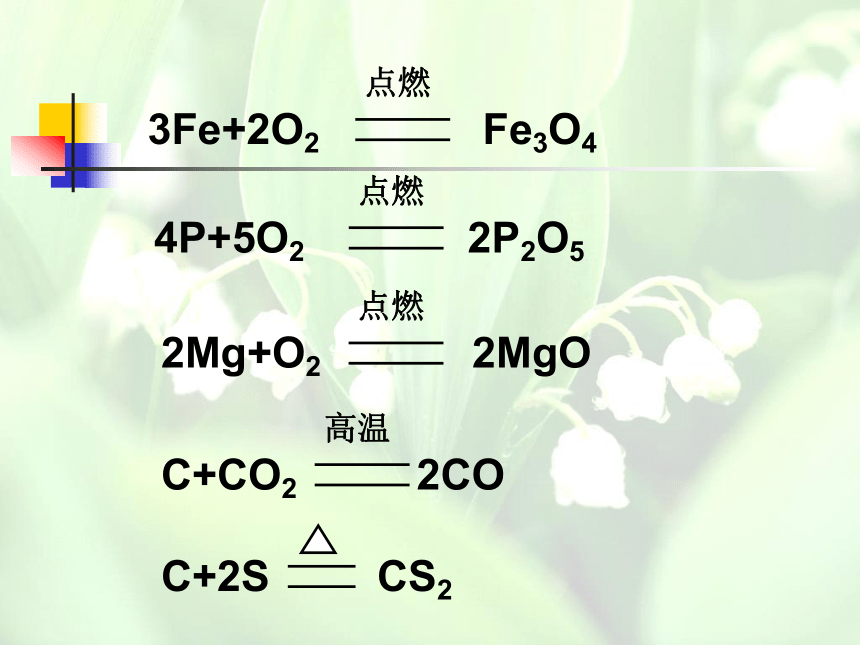
C+CO2 2CO
高温
C+2S CS2
3Fe+2O2 Fe3O4
点燃
4P+5O2 2P2O5
点燃
2Mg+O2 2MgO
点燃
1、实验操作
取2杯蒸馏水,向其中的1杯蒸馏水中吹气或通CO2 。分别向2只烧杯中滴加几滴紫色石蕊试液,观察烧杯中的现象并说明原因。
分别搅拌2只烧杯中的液体,3分钟后,静置片刻,你发现什么?
将盛有液体的2只烧杯分别放到热水中,搅拌3分钟,你又发现什么?
2、化学方程式
CO2+H2O H2CO3
非金属氧化物与酸间的转化
H2CO3 CO2 +H2O
SO2+H2O H2SO3
注意:二氧化硅不能与水化合生成硅酸。
S+O2 SO2
点燃
2H2SO3+O2 2 H2SO4
现在我国的常用能源煤和石油中都含有硫,在燃烧时生成SO2,导致大气污染而降酸雨。
讨论:
CO2+H2O H2CO3
正常的降水是碱性、中性还是酸性的?
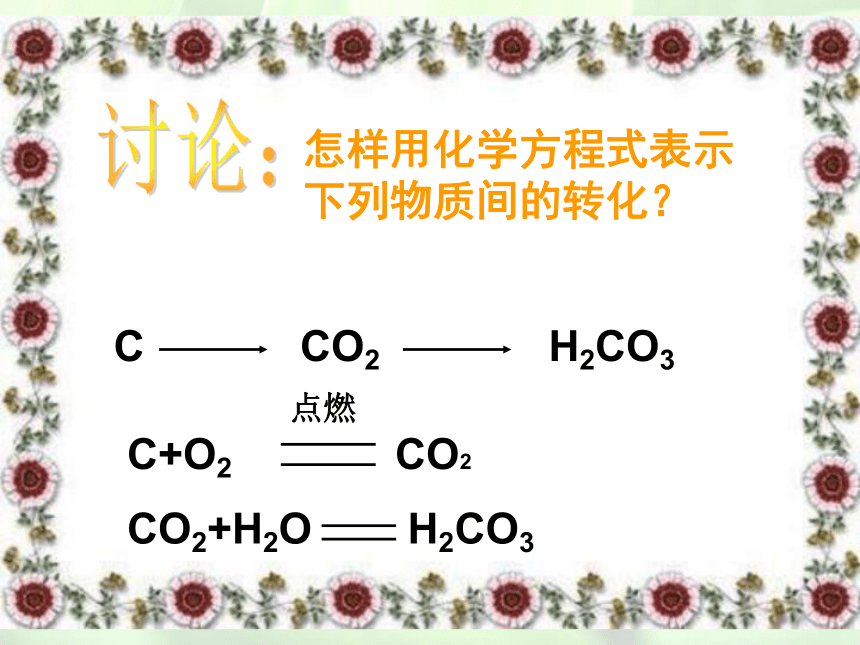
C CO2 H2CO3
怎样用化学方程式表示下列物质间的转化?
C+O2 CO2
点燃
CO2+H2O H2CO3
二、金属单质与其化合物的转化
1、实验操作
2、化学方程式
Fe+S FeS
3Fe+2O2 Fe3O4
点燃
2Mg+O2 2MgO
点燃
2Fe+3Cl2 2FeCl3
点燃
Cu+Cl2 CuCl2
点燃
还有哪些金属单质可以转化为相应的化合物?
金属单质与非金属单质在一定条件下生成相应的盐。
1、实验操作
在蒸发皿中放1小块生石灰,加少量水,搅拌,观察现象。
2、化学方程式
CaO+H2O Ca(OH)2
金属氧化物与碱间的转化
CaO+H2O Ca(OH)2
Na2O+H2O 2NaOH
K2O+H2O 2KOH
BaO+H2O Ba(OH)2
注意:CuO、Fe2O3等与水不能化合成相应的碱。
给生石灰加水-建筑用
给生石灰加水-实验
Ca CaO Ca (OH)2
怎样用化学方程式表示下列物质间的转化?
CaO+H2O Ca(OH)2
2Ca+O2 2CaO
点燃
方铅矿(主要成分PbS)
赤铁矿石
(主要成分Fe2O3)
三、金属的冶炼
孔雀石[主要成分Cu2(OH)2CO3 ]
自然界中少数金属是以游离态(即单质)的形式存在,大多数金属是以化合态(化合物)的形式存在。
金属的冶炼就是把金属从化合态变成游离态。
冶炼的方法:
碳等还原剂与金属氧化物在高温下反应,还原剂夺取金属氧化物中的氧,得到游离的金属单质。
1、实验操作
2、化学方程式
C+2CuO 2Cu+CO2
炽热的炭在高温条件下能与二氧化碳反应,生成一氧化碳。一氧化碳也可以夺取金属氧化物中的氧,产生游离的金属单质。
CO+CuO Cu+CO2
C+CO2 2CO
高温
除了C、CO可以还原金属氧化物外,氢气也可以还原金属氧化物。
H2+CuO Cu+H2O
1、实验操作
2、化学方程式
Cu2(OH)2CO3 2CuO+CO2 +H2O
H2+CuO Cu+H2O
1、由氧化铜制取铜,还可用其他什么方法?
2、为什么在氢气还原氧化铜实验开始时,要先通氢气后给氧化铜加热?
3、实验停止后,为什么还要继续通氢气,直到试管冷却为止?
排尽试管内的空气,防止氢气与空气混合加热时试管
防止灼热的铜被空气中的氧气氧化变成氧化铜
可用C、H2、CO等还原剂在一定条件下还原氧化铜
还可以将氧化铜转化为盐,用活泼金属置换出铜
1、实验操作
2、化学方程式
3CO+Fe2O3 2Fe+3CO2
高温
金属冶炼的原理:
活泼金属
金属氧化物 游离态金属(还原法)
C、H2或CO
活泼金属
金属盐溶液 游离态金属(置换法)
比盐中金属活泼
置换法比还原法优越,因为置换法操作简便,安全,节约原料。
还原反应:含氧化合物里的氧被夺取的反应。
还原剂:具有从含氧化合物里夺取氧的能力,还原性是化学性质。
铁矿石的冶炼是一个复杂的过程,但它的主要反应原理是在高温下,用还原剂(主要是一氧化碳)从铁矿石里把铁还原出来。
3CO+Fe2O3 2Fe+3CO2
高温
四、有关纯度的计算
方法一:
计算分步设计:
(1)根据混合物质量及其纯度,如何计算纯净物质量
纯净物质量=混合物质量×纯度
例题 100吨含Fe2O3质量分数为85%的铁矿石中,可炼出含铁质量分数为96%的生铁为多少吨
解:
铁矿石中含Fe2O3的质量为:
100吨×85% = 85 吨
组成元素的质量=纯净物的质量×
纯净物中某组成元素的质量分数
(2)根据纯净物的质量,求出其中组成元素的质量
2Fe
Fe的质量为:85吨× × 100%
Fe2O3
112
= 85吨× × 100%
160
=59.5吨
例题 100吨含Fe2O3质量分数为85%的铁矿石中,可炼出含铁质量分数为96%的生铁为多少吨
解:
铁矿石中含Fe2O3的质量为:
100吨×85% = 85 吨
纯净物质量
混合物质量=
纯度
(3)求工业产品中的含杂质的物质的质量(即混合物质量)
2Fe
Fe的质量为:85吨× × 100%
Fe2O3
112
= 85吨× × 100%
160
=59.5吨
例题 100吨含Fe2O3质量分数为85%的铁矿石中,可炼出含铁质量分数为96%的生铁为多少吨
解:
铁矿石中含Fe2O3的质量为:
100吨×85% = 85 吨
炼出的生铁的质量为:59.5吨÷96%=62吨
答:炼出的生铁质量为62吨。
方法二
解:设可炼出含铁96%的生铁的质量为 x 。
3CO+Fe2O3 2Fe+3CO2
高温
160 112
100吨×85% x×96%
160:112=100吨×85% : x×96%
112 × 100吨×85%
x= = 62吨
160 ×96%
答:炼出的生铁质量为62吨。
一、金属单质 盐的转变关系:
Ca
Ca(OH)2
CaO
CaCl2
O2
H2O
HCl
碱性
氧化
物
碱
金属
盐
二、非金属单质 盐的转变关系:
O2
酸
C
CO2
H2CO3
CaCO3
H2O
Ca(OH)2
非金属
盐
酸性
氧化物
Fe + S == FeS
金属 + 非金属 盐 (无氧酸盐)
加热
金属
盐
金属
氧化
物
碱
盐
非金属
非金属
氧化物
酸
一、单质、氧化物、酸、碱、盐各类物质的相互关系
盐
一条横线
1 、现有CuSO4、NaOH、HCl、Na2SO4、BaCl2溶液、酚酞试液、
鸡蛋壳等药品。
(1)你能说出它们分别属于哪类物质吗?
(2)认真观察实验,研究它们之间的
相互反应关系如何?
(3)如果能反应的,请写出相关的
化学方程式,并指明反应类型?
一、实验探究:
2、比较分析:
(2)生成物的类别上有什么共同之处?
( 1) 从①—④反应的化学方程式中,对生成物的状态进行分析,为什么有些物质之间能反应,有些却不能?
(3)能否写出反应规律的文字表达式, 并在8点图中用连线表示出来。
(同桌合作互助)
金属
盐
金属
氧化
物
碱
盐
非金属
非金属
氧化物
酸
一、单质、氧化物、酸、碱、盐各类物质的相互关系
盐
盐+水
盐+碱
盐+酸
两种新盐
1、练写化合物相互反应的化学方程式, 归纳8点图中两两反应的文字规律。
(1)熟石灰粉刷后的转化可用下式表示: Ca(OH)2 → CaCO3 ,要生成CaCO3 ,还有哪些方法和途径? 请写出有关的化学方程式:
二、挑战自我:
(2)你写出的化学方程式表示了图中
哪些物质两两之间的相互关系? 写出文字表达式。
(3)你能在图中把这些物质之间的
两两反应关系用连线表示出来吗?
金属
盐
金属
氧化
物
碱
盐
非金属
非金属
氧化物
酸
总结:单质、氧化物、酸、碱、盐各类物质的相互关系
盐
盐+水
盐+碱
盐+酸
两种新盐
观察8点图,联系和思考:
1、 8点图中哪些物质是能够两两反应的?
2、你能列举出相应的化学反应方程式吗?
3、你能在8点图上再添上一些连线吗?
怎样才能做到简洁美观,又能表示
物质的相互反应规律呢?。
三、合作互助,再提高!
金属
盐
金属
氧化
物
碱
盐
非金属
非金属
氧化物
酸
总结:单质、氧化物、酸、碱、盐各类物质的相互关系
盐
盐+水
四条横线
两对叉线
2种新盐
盐 + 盐
盐 + 碱
两条弯线
盐
+
H2
盐
+
金属
总结:单质、氧化物、酸、碱、盐各类物质的相互关系
金属
碱
非金属
盐
盐
盐和水
两种新盐
碱和盐
酸和盐
盐和金属
盐和氢气
酸性
氧化物
盐
酸
碱性
氧化
物
二
三
作业
练1
练2
1、对比:我们自己构建的8点图与课本的图
2、提炼:十大成盐规律:
(1)金属氧化物 + 酸 → 盐 + 水
(2)非金属氧化物 + 碱 →盐 + 水。
(3)酸 + 碱 → 盐 + 水
(4)金属氧化物 + 非金属氧化物 → 含氧酸盐
(5)盐 + 盐 → 新盐 + 新盐
(6)金属 + 盐 → 新金属 + 新盐 。
(7)金属 + 酸 →盐 + 氢气。
(8)酸 + 盐 → 新盐 + 新酸
(9)碱 + 盐 → 新盐 + 新碱
(10)金属 + 非金属 →无氧酸盐
四:观赏自然界绚丽多姿的溶洞景观:
(1)溶洞的形成原因:
在自然界里,含有碳酸钙的石灰石岩层遇到溶有二氧化碳的水时,不溶水的碳酸钙就会变成可溶性的碳酸氢钙〖Ca(HCO3)2〗而被地下水带走,在长年累月的作用下会慢慢地形成溶洞。
CaCO3 +CO2+ H2O = Ca(HCO3)2
1、拓展探究长知识:
当含有碳酸氢钙的地下水从溶洞顶渗出,一滴一滴落下来时,由于水分蒸发,水里的碳酸氢钙又会变成碳酸钙而沉积下来,附在洞顶的石壁上,年深日久,洞顶就垂下乳状石条,这就石钟乳石。滴落地洞底的水也发生着同样的变化,形成了向上生长的石笋。钟乳石和石笋慢慢伸长连在一起成了石柱。
(2)钟乳石、石笋、石柱的形成原因:
Ca(HCO3)2 CaCO3↓ +H2O+ CO2↑
2、想一想 ?
1、溶洞原理体现了哪两种物质之间的相互关系?
2、钟乳石的形成原理又给了我们哪些启示?
CaCO3 +CO2+ H2O = Ca(HCO3)2
Ca(HCO3)2 === CaCO3↓ +H2O+ CO2↑
五、实战演习:
1、设计制备ZnSO4 或 MgCl2的可能方法。
(1)Zn + H2SO4 == ZnSO4 + H2↑
(2)ZnO + H2SO4 == ZnSO4 + H2O
(3)Zn(OH)2 + H2SO4== ZnSO4 + 2H2O
(4)ZnCO3 + H2SO4 == ZnSO4 + CO2↑ + H2O
Zn(OH)2 + CuSO4
MgSO4 + ZnCl2
一、非金属单质与其化合物的转化
硫磺
火山喷射的产物-硫磺
1、实验操作
2、实验的化学方程式
S+O2 SO2
点燃
还有哪些单质可以转化为相应的化合物?
如C、Fe、P、Mg等单质都可以在氧气中燃烧。
C+O2 CO2
点燃
2C+O2 2CO
点燃
O2充足
O2不充足
C+CO2 2CO
高温
C+2S CS2
3Fe+2O2 Fe3O4
点燃
4P+5O2 2P2O5
点燃
2Mg+O2 2MgO
点燃
1、实验操作
取2杯蒸馏水,向其中的1杯蒸馏水中吹气或通CO2 。分别向2只烧杯中滴加几滴紫色石蕊试液,观察烧杯中的现象并说明原因。
分别搅拌2只烧杯中的液体,3分钟后,静置片刻,你发现什么?
将盛有液体的2只烧杯分别放到热水中,搅拌3分钟,你又发现什么?
2、化学方程式
CO2+H2O H2CO3
非金属氧化物与酸间的转化
H2CO3 CO2 +H2O
SO2+H2O H2SO3
注意:二氧化硅不能与水化合生成硅酸。
S+O2 SO2
点燃
2H2SO3+O2 2 H2SO4
现在我国的常用能源煤和石油中都含有硫,在燃烧时生成SO2,导致大气污染而降酸雨。
讨论:
CO2+H2O H2CO3
正常的降水是碱性、中性还是酸性的?
C CO2 H2CO3
怎样用化学方程式表示下列物质间的转化?
C+O2 CO2
点燃
CO2+H2O H2CO3
二、金属单质与其化合物的转化
1、实验操作
2、化学方程式
Fe+S FeS
3Fe+2O2 Fe3O4
点燃
2Mg+O2 2MgO
点燃
2Fe+3Cl2 2FeCl3
点燃
Cu+Cl2 CuCl2
点燃
还有哪些金属单质可以转化为相应的化合物?
金属单质与非金属单质在一定条件下生成相应的盐。
1、实验操作
在蒸发皿中放1小块生石灰,加少量水,搅拌,观察现象。
2、化学方程式
CaO+H2O Ca(OH)2
金属氧化物与碱间的转化
CaO+H2O Ca(OH)2
Na2O+H2O 2NaOH
K2O+H2O 2KOH
BaO+H2O Ba(OH)2
注意:CuO、Fe2O3等与水不能化合成相应的碱。
给生石灰加水-建筑用
给生石灰加水-实验
Ca CaO Ca (OH)2
怎样用化学方程式表示下列物质间的转化?
CaO+H2O Ca(OH)2
2Ca+O2 2CaO
点燃
方铅矿(主要成分PbS)
赤铁矿石
(主要成分Fe2O3)
三、金属的冶炼
孔雀石[主要成分Cu2(OH)2CO3 ]
自然界中少数金属是以游离态(即单质)的形式存在,大多数金属是以化合态(化合物)的形式存在。
金属的冶炼就是把金属从化合态变成游离态。
冶炼的方法:
碳等还原剂与金属氧化物在高温下反应,还原剂夺取金属氧化物中的氧,得到游离的金属单质。
1、实验操作
2、化学方程式
C+2CuO 2Cu+CO2
炽热的炭在高温条件下能与二氧化碳反应,生成一氧化碳。一氧化碳也可以夺取金属氧化物中的氧,产生游离的金属单质。
CO+CuO Cu+CO2
C+CO2 2CO
高温
除了C、CO可以还原金属氧化物外,氢气也可以还原金属氧化物。
H2+CuO Cu+H2O
1、实验操作
2、化学方程式
Cu2(OH)2CO3 2CuO+CO2 +H2O
H2+CuO Cu+H2O
1、由氧化铜制取铜,还可用其他什么方法?
2、为什么在氢气还原氧化铜实验开始时,要先通氢气后给氧化铜加热?
3、实验停止后,为什么还要继续通氢气,直到试管冷却为止?
排尽试管内的空气,防止氢气与空气混合加热时试管
防止灼热的铜被空气中的氧气氧化变成氧化铜
可用C、H2、CO等还原剂在一定条件下还原氧化铜
还可以将氧化铜转化为盐,用活泼金属置换出铜
1、实验操作
2、化学方程式
3CO+Fe2O3 2Fe+3CO2
高温
金属冶炼的原理:
活泼金属
金属氧化物 游离态金属(还原法)
C、H2或CO
活泼金属
金属盐溶液 游离态金属(置换法)
比盐中金属活泼
置换法比还原法优越,因为置换法操作简便,安全,节约原料。
还原反应:含氧化合物里的氧被夺取的反应。
还原剂:具有从含氧化合物里夺取氧的能力,还原性是化学性质。
铁矿石的冶炼是一个复杂的过程,但它的主要反应原理是在高温下,用还原剂(主要是一氧化碳)从铁矿石里把铁还原出来。
3CO+Fe2O3 2Fe+3CO2
高温
四、有关纯度的计算
方法一:
计算分步设计:
(1)根据混合物质量及其纯度,如何计算纯净物质量
纯净物质量=混合物质量×纯度
例题 100吨含Fe2O3质量分数为85%的铁矿石中,可炼出含铁质量分数为96%的生铁为多少吨
解:
铁矿石中含Fe2O3的质量为:
100吨×85% = 85 吨
组成元素的质量=纯净物的质量×
纯净物中某组成元素的质量分数
(2)根据纯净物的质量,求出其中组成元素的质量
2Fe
Fe的质量为:85吨× × 100%
Fe2O3
112
= 85吨× × 100%
160
=59.5吨
例题 100吨含Fe2O3质量分数为85%的铁矿石中,可炼出含铁质量分数为96%的生铁为多少吨
解:
铁矿石中含Fe2O3的质量为:
100吨×85% = 85 吨
纯净物质量
混合物质量=
纯度
(3)求工业产品中的含杂质的物质的质量(即混合物质量)
2Fe
Fe的质量为:85吨× × 100%
Fe2O3
112
= 85吨× × 100%
160
=59.5吨
例题 100吨含Fe2O3质量分数为85%的铁矿石中,可炼出含铁质量分数为96%的生铁为多少吨
解:
铁矿石中含Fe2O3的质量为:
100吨×85% = 85 吨
炼出的生铁的质量为:59.5吨÷96%=62吨
答:炼出的生铁质量为62吨。
方法二
解:设可炼出含铁96%的生铁的质量为 x 。
3CO+Fe2O3 2Fe+3CO2
高温
160 112
100吨×85% x×96%
160:112=100吨×85% : x×96%
112 × 100吨×85%
x= = 62吨
160 ×96%
答:炼出的生铁质量为62吨。
一、金属单质 盐的转变关系:
Ca
Ca(OH)2
CaO
CaCl2
O2
H2O
HCl
碱性
氧化
物
碱
金属
盐
二、非金属单质 盐的转变关系:
O2
酸
C
CO2
H2CO3
CaCO3
H2O
Ca(OH)2
非金属
盐
酸性
氧化物
Fe + S == FeS
金属 + 非金属 盐 (无氧酸盐)
加热
金属
盐
金属
氧化
物
碱
盐
非金属
非金属
氧化物
酸
一、单质、氧化物、酸、碱、盐各类物质的相互关系
盐
一条横线
1 、现有CuSO4、NaOH、HCl、Na2SO4、BaCl2溶液、酚酞试液、
鸡蛋壳等药品。
(1)你能说出它们分别属于哪类物质吗?
(2)认真观察实验,研究它们之间的
相互反应关系如何?
(3)如果能反应的,请写出相关的
化学方程式,并指明反应类型?
一、实验探究:
2、比较分析:
(2)生成物的类别上有什么共同之处?
( 1) 从①—④反应的化学方程式中,对生成物的状态进行分析,为什么有些物质之间能反应,有些却不能?
(3)能否写出反应规律的文字表达式, 并在8点图中用连线表示出来。
(同桌合作互助)
金属
盐
金属
氧化
物
碱
盐
非金属
非金属
氧化物
酸
一、单质、氧化物、酸、碱、盐各类物质的相互关系
盐
盐+水
盐+碱
盐+酸
两种新盐
1、练写化合物相互反应的化学方程式, 归纳8点图中两两反应的文字规律。
(1)熟石灰粉刷后的转化可用下式表示: Ca(OH)2 → CaCO3 ,要生成CaCO3 ,还有哪些方法和途径? 请写出有关的化学方程式:
二、挑战自我:
(2)你写出的化学方程式表示了图中
哪些物质两两之间的相互关系? 写出文字表达式。
(3)你能在图中把这些物质之间的
两两反应关系用连线表示出来吗?
金属
盐
金属
氧化
物
碱
盐
非金属
非金属
氧化物
酸
总结:单质、氧化物、酸、碱、盐各类物质的相互关系
盐
盐+水
盐+碱
盐+酸
两种新盐
观察8点图,联系和思考:
1、 8点图中哪些物质是能够两两反应的?
2、你能列举出相应的化学反应方程式吗?
3、你能在8点图上再添上一些连线吗?
怎样才能做到简洁美观,又能表示
物质的相互反应规律呢?。
三、合作互助,再提高!
金属
盐
金属
氧化
物
碱
盐
非金属
非金属
氧化物
酸
总结:单质、氧化物、酸、碱、盐各类物质的相互关系
盐
盐+水
四条横线
两对叉线
2种新盐
盐 + 盐
盐 + 碱
两条弯线
盐
+
H2
盐
+
金属
总结:单质、氧化物、酸、碱、盐各类物质的相互关系
金属
碱
非金属
盐
盐
盐和水
两种新盐
碱和盐
酸和盐
盐和金属
盐和氢气
酸性
氧化物
盐
酸
碱性
氧化
物
二
三
作业
练1
练2
1、对比:我们自己构建的8点图与课本的图
2、提炼:十大成盐规律:
(1)金属氧化物 + 酸 → 盐 + 水
(2)非金属氧化物 + 碱 →盐 + 水。
(3)酸 + 碱 → 盐 + 水
(4)金属氧化物 + 非金属氧化物 → 含氧酸盐
(5)盐 + 盐 → 新盐 + 新盐
(6)金属 + 盐 → 新金属 + 新盐 。
(7)金属 + 酸 →盐 + 氢气。
(8)酸 + 盐 → 新盐 + 新酸
(9)碱 + 盐 → 新盐 + 新碱
(10)金属 + 非金属 →无氧酸盐
四:观赏自然界绚丽多姿的溶洞景观:
(1)溶洞的形成原因:
在自然界里,含有碳酸钙的石灰石岩层遇到溶有二氧化碳的水时,不溶水的碳酸钙就会变成可溶性的碳酸氢钙〖Ca(HCO3)2〗而被地下水带走,在长年累月的作用下会慢慢地形成溶洞。
CaCO3 +CO2+ H2O = Ca(HCO3)2
1、拓展探究长知识:
当含有碳酸氢钙的地下水从溶洞顶渗出,一滴一滴落下来时,由于水分蒸发,水里的碳酸氢钙又会变成碳酸钙而沉积下来,附在洞顶的石壁上,年深日久,洞顶就垂下乳状石条,这就石钟乳石。滴落地洞底的水也发生着同样的变化,形成了向上生长的石笋。钟乳石和石笋慢慢伸长连在一起成了石柱。
(2)钟乳石、石笋、石柱的形成原因:
Ca(HCO3)2 CaCO3↓ +H2O+ CO2↑
2、想一想 ?
1、溶洞原理体现了哪两种物质之间的相互关系?
2、钟乳石的形成原理又给了我们哪些启示?
CaCO3 +CO2+ H2O = Ca(HCO3)2
Ca(HCO3)2 === CaCO3↓ +H2O+ CO2↑
五、实战演习:
1、设计制备ZnSO4 或 MgCl2的可能方法。
(1)Zn + H2SO4 == ZnSO4 + H2↑
(2)ZnO + H2SO4 == ZnSO4 + H2O
(3)Zn(OH)2 + H2SO4== ZnSO4 + 2H2O
(4)ZnCO3 + H2SO4 == ZnSO4 + CO2↑ + H2O
Zn(OH)2 + CuSO4
MgSO4 + ZnCl2
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
