人教版(五四制)八年级全一册化学 第四单元 课题4 化学式和化合价(课件)(62张PPT)
文档属性
| 名称 | 人教版(五四制)八年级全一册化学 第四单元 课题4 化学式和化合价(课件)(62张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-17 00:00:00 | ||
图片预览









文档简介
(共62张PPT)
1.【概念】用元素符号和数字的组合表示纯净物质组成的式子叫化学式。
一、什么是化学式?
【注意】每种纯净物的组成是固定不变的,所以,一种物质的化学式只有一个。
表示一个水分子由2个氢原子和1个氧原子组成
表示一个水分子
表示水由氢元素和氧元素组成
表示水这种物质
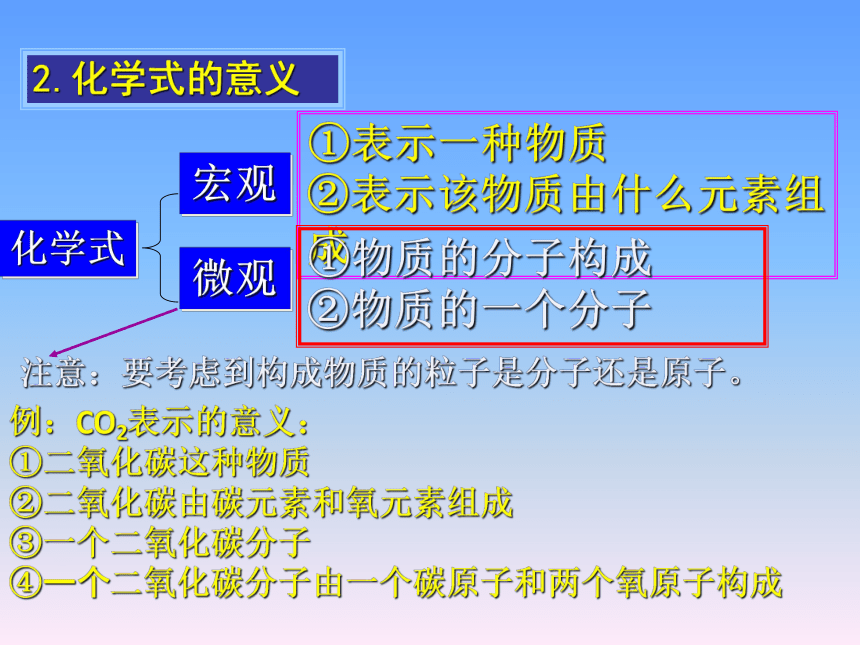
2.化学式的意义
①表示一种物质
②表示该物质由什么元素组成
①物质的分子构成
②物质的一个分子
宏观
微观
化学式
注意:要考虑到构成物质的粒子是分子还是原子。
①二氧化碳这种物质
②二氧化碳由碳元素和氧元素组成
③一个二氧化碳分子
④一个二氧化碳分子由一个碳原子和两个氧原子构成
例:CO2表示的意义:
①表示氢元素;②一个氢原子。
表示两个氢原子。
①表示氢气这种物质②氢气由氢元素组成③一个氢气分子④一个氢气分子由两个氢原子构成。
表示两个氢气分子。
H:
2H:
2H2:
H2:
【课堂练习】
说出下列符号所表示的含义:
化学符号中各数字和含义
1.元素符号前的数字--------原子个数
2.化学式前的数字------------分子个数
3.化学式中元素符号右下角的数字-----原子个数
元素符号(原子团)右上角的数字----- 所带电荷数
3.化学式的书写和读法
单质
(1)金属和某些固态非金属单质(直接用元素符号表示)
如:Fe、Cu、Al,C、S、P等
(3)双原子或多原子分子构成的单质
如:O2、N2、H2、Cl2、O3等
(2)稀有气体
由原子构成,用元素符号表示
如:He、Ne、Ar等
3,化学式的书写和读法
化合物
(1)氧化物中氧元素写后面
如:CO2、Fe3O4、P2O5、 MnO2等
读作:“几氧化几某”或“氧化某”
(2)金属元素写前面,非金属元素写后面“金左非右”如:NaCl、CaCl2等;
读法:从右往左读作“某化某”
(3)正价写前面,负价写后面
如:H2O、SO2、KCl等
强记下列物质名称和化学式
氧气___、氮气____、氢气____、
氦气___、氖气____、氩气____、
碳___、硫磺____、红磷____、
铁___、汞____、铝___、镁___、钠__
水___、二氧化碳____、五氧化二磷__、
二氧化硫____、
四氧化三铁__、氧化镁___、氧化铝___
氧化铜___、氧化汞____、二氧化锰___
氯酸钾___、氯化钾____、高锰酸钾____、锰酸钾____、双氧水___
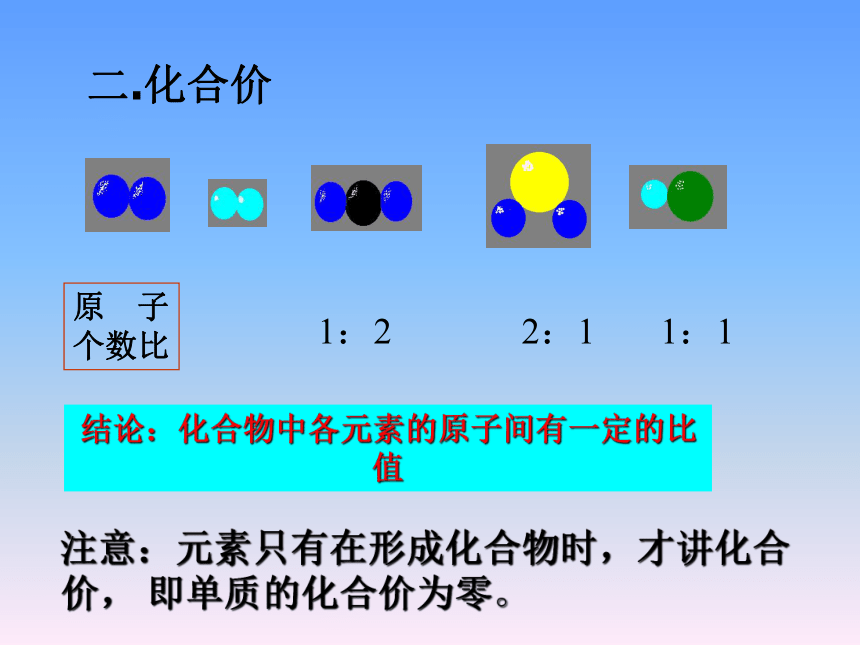
原 子
个数比
1:2 2:1 1:1
结论:化合物中各元素的原子间有一定的比值
注意:元素只有在形成化合物时,才讲化合价, 即单质的化合价为零。
二.化合价
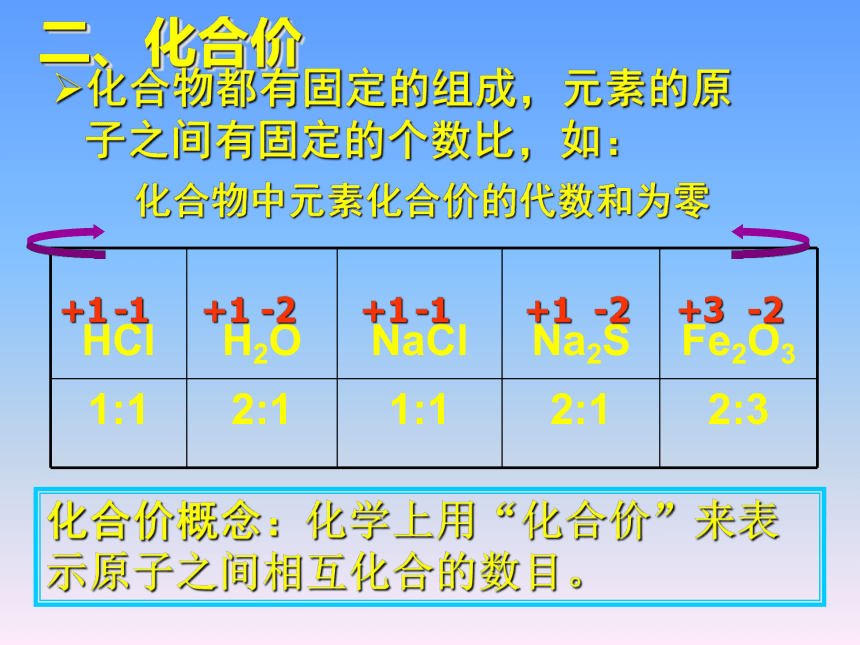
化合价概念:化学上用“化合价”来表示原子之间相互化合的数目。
二、化合价
化合物都有固定的组成,元素的原子之间有固定的个数比,如:
HCl
H2O
NaCl
Na2S
Fe2O3
1:1 2:1 1:1 2:1 2:3
+1
-2
-1
+1
-1
-2
+1
+1
+3
-2
化合物中元素化合价的代数和为零
①在任何化合物里,正负化合价的代数和为零。
②在化合物里氢通常显+1价,氧通常显-2价。
③金属元素通常显正价,非金属元素通常显负价。
④单质里元素的化合价为零。
⑤许多元素具有可变化合价,同种元素在不同的化合物里可显不同的化合价,如:
FeO,Fe2O3
化合价的有关规律:
常见元素化合价表
主要元素化合价口诀
钾钠氢银正一价,钙镁锌钡正二价;
氟氯溴碘负一价,通常氧是负二价;
铜汞正一和正二,铁有正二和正三;
碳有正二和正四,硫有负二、正四和正六;
正三铝,正四硅,正五还有氮和磷
化合价口决
一价氯氢钾钠银 二价氧钡钙镁锌
三铝四硅五价磷 二三铁二四碳
二四六硫锰记心间
化合价口决
常见原子团的化合价
负一硝酸氢氧根,负二硫酸碳酸根,
负三记住磷酸根,正一价的是铵根。
重要技能
1.化合价的标法和含义
+2
Mg
MgO
+2
+2价的镁元素
在氧化镁中镁元素的化合价为+2价
说出下列符号中3的含义
3Al Al Al2O3 Al Al2O3
+3
3+
+3
Na+ Mg2+ Al3+ F- O2-
Na
Mg
Al
F
O
+1
+2
+3
-1
-2
离子符号和化合价的表示方法不同:
离子:数字在前,“+”号在后;写在右上角。
化合价:数字在后,“+”号在前;写头顶上。
化合价与离子所带电荷有关:数字相同
比较并找规律
离子符号和化合价的比较:
化合价的标法与离子符号的区别与联系
化合价的表示
方法 Na 离子符号 Na+
区
别
1.记号的位置不同 标在元素符号
的正上方 标在元素符号的右上角
2.“+ - ”与数字的位置不同 “+ -”在数字之前 “+ -”在数字之后
3. “1”的处理不同 “1”必标 “1”不必标
联系
化合价的数值与离子所带电荷的数值相同,符号一致
+1
例1 试确定氯酸钾(KClO3)中氯元素的化合价
KClO3
-2
X
+1
1+ X +(-2)×3=0
X= +5
解:
答:在氯酸钾里,氯元素的化合价为+5。
重要技能
重要技能
2.根据化学式求化合价
KMnO4、K2MnO4、KClO3、H2SO4
推求的依据:化合物中元素的化合价代数和为零。
(注意:如果求离子中某元素的化合价,则代数和不为零。如:SO42-、NO3-)
+7
+6
+5
+6
求HnRO2n-2 中R的化合价
例2 已知磷有两种氧化物,其中磷的化合价分别为 +3 和 +5 ,写出这两种磷的氧化物的化学式。
P O
+5 -2
两种元素化合价的最小公倍数: 10
P: 10 /5 = 2 O: 10/2 = 5
2
5
验证: +5×2 + (-2)×5=0
书写化学式的步骤
1.写出有关元素符号
2.标出有关元素的化合
价。
3.根据化合物中元素化
合价代数和为零的原
则,用最小公倍数法
求出化学式中各元素
的原子个数。
4.验证所写化学式是否
正确。
2.根据化合价写出化学式
3.根据化合价写化学式
方法:最小公倍数法。(看教材)
已知R元素的化合价为+n,则其形成的氧化物的化学式为
_____________
R2On
ROn/2
根据元素的化合价写出下列物质的化学式 1、氧化铁 2、硫酸铝 3、氧化铜
书写方法
正左负右,
标价交叉,
约简复查。
Fe O
+3 -2
2
3
验证:(+3)×2 +(-2)×3 = 0
Al SO4
Cu O
+3 - 2
2
( )
验证:(+3)×2 + (-2)×3 = 0
+2 -2
验证:(+2) +(-2)= 0
3
Na+ Mg2+ Al3+ F- O2-
Na
Mg
Al
F
O
+1
+2
+3
-1
-2
离子符号和化合价的表示方法不同:
离子:数字在前,“+”号在后;写在右上角。
化合价:数字在后,“+”号在前;写头顶上。
化合价与离子所带电荷有关:数字相同
比较并找规律
离子符号和化合价的比较:
原子团:作为一个整体参加反应的原子集团(就好象一个原子一样),原子团也叫做根。
离子:
OH-:
NH4+:
NO3-:
CO32-:
SO42-:
PO43-:
氢氧根离子
铵根离子
硝酸根离子
碳酸根离子
硫酸根离子
磷酸根离子
原子团
OH
NH4
NO3
CO3
SO4
PO4
氢氧根
铵根
硝酸根
碳酸根
硫酸根
磷酸根
记住
化合价
硫酸根:SO4 -2价
碳酸根:CO3 -2价
氢氧根:OH -1价
硝酸根:NO3 -1价
铵 根:NH4 +1价
推求下列原子团(根)的化合价:
原子团的化合价
NaNO3、NH4NO3、NaOH、
H2SO4、Na2CO3、H3PO4
+1
-1
-1
+1
+1
+1
+1
+1
-1
-2
-2
-3
推求的依据:化合物中元素的化合价代数和为零。
3.根据化合价判断化学式正误
下列化学式有无错误,有错误的请改正 氧化铝 氧化镁 氧化钠 氯化亚铁 氯化铜 Al O MgO 2 Na 2O FeCl3 CaCl2 硫酸铝 硫酸 硫酸钠 碳酸钠 Al2 SO4 SO4 Na SO4 Na CO3 氢氧化钠 氢氧化铜 氢氧化铁 NaOH Cu OH 2 Fe(OH) 2
2
Cu
( )3
H2
2
2
( )
3
3
2
【基础练习】
2H2
2Mg2+
CO2
-2
2H
两个氢分子
两个氢原子
两个镁离子
二氧化碳中氧元素显-2价
一个氢分子由两个氢原子构成
一个镁离子带两个单位正电荷
一个二氧化碳分子中含有两个氧原子
说明下列符号中数字“2”的含义
指出下列符号中“2”的意义
1、 2N ,
2、H2 ,
3、O2 ,
4、2O2 ,
5、2Na+ ,
6、Mg2+ ,
7、Fe2+
8、2Fe3+
9、2NH4+
10、H2O
11、SO42-
12、Mg
13 SO2
+2
-2
要
抄题
请用数字和符号表示
1、两个氢原子 8、三个氢氧根离子
2、一个氮分子 9、两个氧离子
3、两个氧分子 10、三个水分子
4、氖气 11、两个硝酸根离子
5、铁的化学式 12、铜元素
6、三个亚铁离子 13、硫元素的化合价是-2
7、一个硫离子 14、两个铵根离子
15、二氧化碳中氧元素的化合价是-2
写出下列物质的化学式:
1、硫粉 8铁 15锰酸钾
2、水 9氖气 16二氧化锰
3、碳酸钠 10五氧化二磷 17、氧化铝
4、氧气 11四氧化三铁 18 氧化铁
5、氯化亚铁 12双氧水 19 硫酸钾
6、二氧化硫 13氯酸钾 20硝酸镁
7、氯化钾 14高锰酸钾 21氢氧化钙
按要求填写下列空格
1,写出空气中含量最多物质的化学式____
2,写出地壳中含量最多的元素名称______
3,写出最轻气体的物质名称______
4,写出人体中含量最多的金属元素的符号______
5,最易自燃物质的化学式_____
6,3个铁离子的化学符号______
写出下列反应的文字表达式,并在相应的物质下方写出物质的化学式,是分解反应、化合反应的,注明反应类型.
1、用高锰酸钾制氧气
2、用氯酸钾和二氧化锰制氧气
3、用双氧水制氧气
4、电解水
5、氢气在空气中燃烧发生爆炸
6、红磷在空气中燃烧
7、硫在空气中燃烧
8、铁丝在氧气中燃烧
9、镁条在空气中燃烧
10、加热铜绿
三、有关相对分子质量的计算
∴H2O的相对分子质量
=(1+0)×2+(8+8)=18
H2O的意义:一个H2O分子是由两个H原子和一个O原子构成的。
相对分子质量的理解
真实质量:一个H2O分子的质量=两个H原子+一个O原子的质量
相对质量:一个H2O分子的相对分子质量=两个H原子相对原子质量+一个O原子的相对原子质量
定义:化学式中各原子的相对原子质量的总和,就是相对分子质量。
计算 H2SO4和H3PO4的相对分子质量
【解】(NH4)2SO4的相对分子质量
=(14+1×4)×2+32+16×4=132
【说明】每种纯净物的组成是固定不变的,所以,每种纯净物的相对分子质量也是固定不变的。如:H2:2 O2:32 H2O:18 CO2:44
计算 (NH4)2SO4的相对分子质量
题型一:
计算相对分子质量
例:
O2的相对分子质量
=16×2
=32
H2O的相对分子质量
=1×2+16
=18
例2:求2O2 、nH2O的总相对分子质量
2.计算物质组成元素的质量比
例1:求Fe2O3中铁元素和氧元素的质量比。
Fe2O3中铁元素和氧元素的质量比
Fe:O=(56×2):(16×3)=112:48=7:3
例2:计算锰酸钾(K2MnO4)中各元素的质量比。
【解】 K2MnO4中各元素的质量比
K:Mn:O=(39×2):55:(16×4)=78:55:64
题型二:计算物质组成元素的质量比
例:求二氧化碳中碳元素和氧元素的质量比
CO2
12︰16×2
=3︰8
练一练:
计算氧化铝中铝元素和氧元素的质量比
Al O
+3 -2
2 3
27×2︰16×3
= 9︰8
元素的质量之比=一种元素的相对原子质量X原子个数: 另一种元素的相对原子质量X原子个数
3.计算物质中某元素的质量分数
例:⑴计算二氧化硫中硫元素的质量分数
⑵计算64t二氧化硫中含硫元素的质量。
⑴ SO2的相对分子质量=32+16×2=64
SO2中硫元素的质量分数=
S的相对原子质量×1
SO2的相对分子质量
×100%
=
32
64
=50%
×100%
⑵ 64t二氧化硫中含硫元素的质量
=64t×50%=32t
题型三:计算物质中某元素的质量分数
例:计算化肥硝酸铵(NH4NO3)中氮元素的质量分数。
NH4NO3的相对分子质量=
14+1×4+14+16×3
=80
硝酸铵中氮元素的质量分数为:
=35%
练一练:
计算化肥尿素〔CO(NH2)2〕中氮元素的质量分数。
尿素的相对分子质量
=12+16+(14+2) ×2
=60
尿素中氮元素的质量分数为
=46.7%
相对原子质量 ×分子内该原子个数
元素的
质量分数
=
相对分子质量
例:血红蛋白的相对分子质量为68000,已知其中铁元素的质量分数为0.33%,则每个血红蛋白分子中含铁原子的个数为 。
X=4
=元素质量:化合物的质量
例:100g 碳酸钙中含钙多少克?
CaCO3
中钙的质量分数=
40
40+12+16×3
×100%
=40%
∴100g×40%=40g
化合物质量X化合物中某元素的质量分数
=该元素的质量
公式变形、运用
2、 (2002·江西省)下列物质中铁元素的质量分数最高的是( )
A? FeO B? Fe2O3
C? Fe3O4 D? Fe2(SO4)3
FeO Fe2O3 Fe3O4 Fe2(SO4)3
↓ ↓ ↓ ↓
FeO FeO FeO Fe(SO4)
A
题型四:利用化合物中元素的质量分数或各元素的质量比求化学式
例:笑气是由氮、氧两种元素组成的化合物,其相对分子质量为44,氮、氧元素的质量比为7︰4,则它的化学式为 。
7
14
4
16
︰
=2︰1
(N2O)n
(14×2+16) ×n=44
n=1
N2O
题型五:有关混合物中元素质量分数的计算
例:某市场销售的化肥硝铵,经检测知道其含氮量为34.3%,则该化肥含硝酸铵的质量分数为______。(设其它成分不含氮元素)
×
混合物中硝酸铵的质量分数
=
混合物中含氮量
硝酸铵中氮元素的质量分数
34.3 0/0
35 0/0
=
98 0/0
想一想;含铁元素为70 0/0的氧化铁粉末是纯净物还是混合物?
方法一:设硝酸铵样品的质量为m,硝酸铵样品中硝酸铵的质量分数为x。 根据题意得出等式:样品中纯硝酸铵的质量=mx
28
79
28
79
m
X=98%
样品中N元素的质量=mx. X100%
样品中N元素的质量分数: mx. X100%
=34.3%
方法二:NH4NO3——2N
79
x
28
34.3%
79
x
28
34.3%
=
=
混合物中含氮量
34.3%
35 %
=
98 %
想一想;含铁元素为70 0/0的氧化铁粉末是纯净物还是混合物?
混合物中硝酸铵的质量分数
纯硝酸铵中氮元素的质量分数
方法三
【例6】已知某Fe2O3样品中铁元素的质量分数为63%(杂质不含铁元素),求此氧化铁样品中的质量分数。
方法一:设样品的质量为m,氧化铁的质量分数为x。 根据题意得出等式:样品中纯氧化铁的质量=mx
112
160
112
160
m
X=90%
样品中铁元素的质量= mx. X100%
样品中铁元素的质量分数: mx. X100%
=63%
有一不纯的硫酸铵样品(所含杂质不含氮),经分析知道它含有20%的氮,求样品里含(NH4)2SO4的质量分数。
(NH4)2SO4
__
2N
132
28
20%
X
132
28
20%
X
=
X=94.29%
【剖析】 此类题的解题思路一般为:先设出此化合物的化学式,然后利用物质中两元素的质量比和相对原子质量之比的计算关系式,求出原子个数比,写出化学式。(注意:由于A、B的位置不固定,可有两种形式)
【例1】已知由A、B两元素组成的化合物中,A、B两元素的质量比为7﹕3,A、B两元素的相对原子质量之比为7﹕2,求该化合物的化学式。
解:设此化合物的化学式为AxBy,A的相对原子质量为A,B的相对原子质量为B。
由题意可知:
可求得:x﹕y=2﹕3
∴该化合物化学式为A2B3或B2A3。
【例1】已知由A、B两元素组成的化合物中,A、B两元素的质量比为7﹕3,A、B两元素的相对原子质量之比为7﹕2,求该化合物的化学式。
类型2、根据相对分子质量和各元素的质量分数,求化学式。
【例2】已知某有机物的相对分子质量为46,其中C、H、O的质量分数分别为52.2%、13.0%、34.8%,求此有机物的化学式。
【剖析】此类习题首先观察C、H、O三者的含量加在一起为100%,确定物质中只含有C、H、O三种元素,再根据分子质量和各元素的含量,求出化学式中各元素的原子个数,写出化学式。
解:C原子个数=46X52.2%/12=2
H原子个数=46X13.0%/1=6
O原子个数=46X34.8%/16=1
∴此有机物的化学式为C2H6O 。
【例2】已知某有机物的相对分子质量为46,其中C、H、O的质量分数分别为52.2%、13.0%、34.8%,求此有机物的化学式。
【例3】已知FeSO4和Fe2(SO4)3两种物质的混合物中,硫元素
的质量分数为a%,求混合物中铁元素的质量分数。
【剖析】解决此类习题要求学生有敏锐的观察力,因为直接求难以求出。仔细观察两种物质的化学式,不难看出两种物质化学式中硫原子和氧原子的个数比都为1﹕4,所以混合物中两种元素的质量比为 32﹕16×4=1﹕2 ,即氧元素的质量为硫元素的2倍,由硫元素的质量分数,可求出氧元素的质量分数,剩余的则是铁元素的质量分数。
解:由两种物质的化学式可知:物质中氧元素的质量是硫元素的2倍,所以氧元素的质量分数为2a% 。
则铁元素的质量分数为1-a%-2a%=1-3a% 。
【例3】已知FeSO4和Fe2(SO4)3两种物质的混合物中,硫元素的质量分数为a%,求混合物中铁元素的质量分数。
【注意:此类题还有可能再延伸。例如:(NH4)2S、(NH4)2SO4、(NH4)2HPO4三种物质的混合物中,已知氮元素的质量分数为28%,求混
合物中氧元素的质量分数。此题根据H、P、S三元素的相对原子质量关系: 1+31=32,可把(NH4)2HPO4看成(NH4)2SO4,再根据上题方法来求,最终答案为32%。】
例1:原计划用90kg尿素[CO(NH2)2],现因缺货改用硝酸铵(NH4NO3).计算需要用多少千克的硝酸铵才能与90kg尿素的含氮量相等?
解法1:90kg尿素[CO(NH2)2]含氮元素的质量:90kgX28/80X100%=31.5kg
多少千克的NH4NO3中含31.5kg的氮元素:31.5kg/28/79X100%=120kg
解法2:设需要硝酸铵质量为x.
据关系式NH4NO3 ~ CO(NH2)2
80 60
x 90kg
80:60=x:90kg
x=120kg
答:需用NH4NO3120kg.
例4:某硝酸铵样品中混有另一种氮肥,经测定该样品中含氮38%,则该样品中可能混有的氮肥是( )
A.NH4HCO3 B.(NH4)2SO4 C.NH4Cl D.CO(NH2)2
解析:先求出纯净的硝酸铵的含氮量为35%,已知样品中含氮量为38%,所以样品中一定混有含氮量比38%更高的氮肥.计算已知各种氮肥的含氮量分别为:NH4HCO3 17.7% (NH4)2SO4 21.2% NH4Cl 26.2% CO(NH2)2 46.7%
所以答案为D.
84∶11∶4
168
12×28+44+16=396
12×28︰44︰16=84︰11︰4
典型题:维生素是人体必备的营养物质,维生素D2的化学式为C28H44O。试计算:
(1)维生素D2的相对分子质量 ;
(2)维生素D2中的碳、氢、氧三种元素的质量比 ;
(3)198g维生素D2中含碳元素的质量为_____________g。
396
1.【概念】用元素符号和数字的组合表示纯净物质组成的式子叫化学式。
一、什么是化学式?
【注意】每种纯净物的组成是固定不变的,所以,一种物质的化学式只有一个。
表示一个水分子由2个氢原子和1个氧原子组成
表示一个水分子
表示水由氢元素和氧元素组成
表示水这种物质
2.化学式的意义
①表示一种物质
②表示该物质由什么元素组成
①物质的分子构成
②物质的一个分子
宏观
微观
化学式
注意:要考虑到构成物质的粒子是分子还是原子。
①二氧化碳这种物质
②二氧化碳由碳元素和氧元素组成
③一个二氧化碳分子
④一个二氧化碳分子由一个碳原子和两个氧原子构成
例:CO2表示的意义:
①表示氢元素;②一个氢原子。
表示两个氢原子。
①表示氢气这种物质②氢气由氢元素组成③一个氢气分子④一个氢气分子由两个氢原子构成。
表示两个氢气分子。
H:
2H:
2H2:
H2:
【课堂练习】
说出下列符号所表示的含义:
化学符号中各数字和含义
1.元素符号前的数字--------原子个数
2.化学式前的数字------------分子个数
3.化学式中元素符号右下角的数字-----原子个数
元素符号(原子团)右上角的数字----- 所带电荷数
3.化学式的书写和读法
单质
(1)金属和某些固态非金属单质(直接用元素符号表示)
如:Fe、Cu、Al,C、S、P等
(3)双原子或多原子分子构成的单质
如:O2、N2、H2、Cl2、O3等
(2)稀有气体
由原子构成,用元素符号表示
如:He、Ne、Ar等
3,化学式的书写和读法
化合物
(1)氧化物中氧元素写后面
如:CO2、Fe3O4、P2O5、 MnO2等
读作:“几氧化几某”或“氧化某”
(2)金属元素写前面,非金属元素写后面“金左非右”如:NaCl、CaCl2等;
读法:从右往左读作“某化某”
(3)正价写前面,负价写后面
如:H2O、SO2、KCl等
强记下列物质名称和化学式
氧气___、氮气____、氢气____、
氦气___、氖气____、氩气____、
碳___、硫磺____、红磷____、
铁___、汞____、铝___、镁___、钠__
水___、二氧化碳____、五氧化二磷__、
二氧化硫____、
四氧化三铁__、氧化镁___、氧化铝___
氧化铜___、氧化汞____、二氧化锰___
氯酸钾___、氯化钾____、高锰酸钾____、锰酸钾____、双氧水___
原 子
个数比
1:2 2:1 1:1
结论:化合物中各元素的原子间有一定的比值
注意:元素只有在形成化合物时,才讲化合价, 即单质的化合价为零。
二.化合价
化合价概念:化学上用“化合价”来表示原子之间相互化合的数目。
二、化合价
化合物都有固定的组成,元素的原子之间有固定的个数比,如:
HCl
H2O
NaCl
Na2S
Fe2O3
1:1 2:1 1:1 2:1 2:3
+1
-2
-1
+1
-1
-2
+1
+1
+3
-2
化合物中元素化合价的代数和为零
①在任何化合物里,正负化合价的代数和为零。
②在化合物里氢通常显+1价,氧通常显-2价。
③金属元素通常显正价,非金属元素通常显负价。
④单质里元素的化合价为零。
⑤许多元素具有可变化合价,同种元素在不同的化合物里可显不同的化合价,如:
FeO,Fe2O3
化合价的有关规律:
常见元素化合价表
主要元素化合价口诀
钾钠氢银正一价,钙镁锌钡正二价;
氟氯溴碘负一价,通常氧是负二价;
铜汞正一和正二,铁有正二和正三;
碳有正二和正四,硫有负二、正四和正六;
正三铝,正四硅,正五还有氮和磷
化合价口决
一价氯氢钾钠银 二价氧钡钙镁锌
三铝四硅五价磷 二三铁二四碳
二四六硫锰记心间
化合价口决
常见原子团的化合价
负一硝酸氢氧根,负二硫酸碳酸根,
负三记住磷酸根,正一价的是铵根。
重要技能
1.化合价的标法和含义
+2
Mg
MgO
+2
+2价的镁元素
在氧化镁中镁元素的化合价为+2价
说出下列符号中3的含义
3Al Al Al2O3 Al Al2O3
+3
3+
+3
Na+ Mg2+ Al3+ F- O2-
Na
Mg
Al
F
O
+1
+2
+3
-1
-2
离子符号和化合价的表示方法不同:
离子:数字在前,“+”号在后;写在右上角。
化合价:数字在后,“+”号在前;写头顶上。
化合价与离子所带电荷有关:数字相同
比较并找规律
离子符号和化合价的比较:
化合价的标法与离子符号的区别与联系
化合价的表示
方法 Na 离子符号 Na+
区
别
1.记号的位置不同 标在元素符号
的正上方 标在元素符号的右上角
2.“+ - ”与数字的位置不同 “+ -”在数字之前 “+ -”在数字之后
3. “1”的处理不同 “1”必标 “1”不必标
联系
化合价的数值与离子所带电荷的数值相同,符号一致
+1
例1 试确定氯酸钾(KClO3)中氯元素的化合价
KClO3
-2
X
+1
1+ X +(-2)×3=0
X= +5
解:
答:在氯酸钾里,氯元素的化合价为+5。
重要技能
重要技能
2.根据化学式求化合价
KMnO4、K2MnO4、KClO3、H2SO4
推求的依据:化合物中元素的化合价代数和为零。
(注意:如果求离子中某元素的化合价,则代数和不为零。如:SO42-、NO3-)
+7
+6
+5
+6
求HnRO2n-2 中R的化合价
例2 已知磷有两种氧化物,其中磷的化合价分别为 +3 和 +5 ,写出这两种磷的氧化物的化学式。
P O
+5 -2
两种元素化合价的最小公倍数: 10
P: 10 /5 = 2 O: 10/2 = 5
2
5
验证: +5×2 + (-2)×5=0
书写化学式的步骤
1.写出有关元素符号
2.标出有关元素的化合
价。
3.根据化合物中元素化
合价代数和为零的原
则,用最小公倍数法
求出化学式中各元素
的原子个数。
4.验证所写化学式是否
正确。
2.根据化合价写出化学式
3.根据化合价写化学式
方法:最小公倍数法。(看教材)
已知R元素的化合价为+n,则其形成的氧化物的化学式为
_____________
R2On
ROn/2
根据元素的化合价写出下列物质的化学式 1、氧化铁 2、硫酸铝 3、氧化铜
书写方法
正左负右,
标价交叉,
约简复查。
Fe O
+3 -2
2
3
验证:(+3)×2 +(-2)×3 = 0
Al SO4
Cu O
+3 - 2
2
( )
验证:(+3)×2 + (-2)×3 = 0
+2 -2
验证:(+2) +(-2)= 0
3
Na+ Mg2+ Al3+ F- O2-
Na
Mg
Al
F
O
+1
+2
+3
-1
-2
离子符号和化合价的表示方法不同:
离子:数字在前,“+”号在后;写在右上角。
化合价:数字在后,“+”号在前;写头顶上。
化合价与离子所带电荷有关:数字相同
比较并找规律
离子符号和化合价的比较:
原子团:作为一个整体参加反应的原子集团(就好象一个原子一样),原子团也叫做根。
离子:
OH-:
NH4+:
NO3-:
CO32-:
SO42-:
PO43-:
氢氧根离子
铵根离子
硝酸根离子
碳酸根离子
硫酸根离子
磷酸根离子
原子团
OH
NH4
NO3
CO3
SO4
PO4
氢氧根
铵根
硝酸根
碳酸根
硫酸根
磷酸根
记住
化合价
硫酸根:SO4 -2价
碳酸根:CO3 -2价
氢氧根:OH -1价
硝酸根:NO3 -1价
铵 根:NH4 +1价
推求下列原子团(根)的化合价:
原子团的化合价
NaNO3、NH4NO3、NaOH、
H2SO4、Na2CO3、H3PO4
+1
-1
-1
+1
+1
+1
+1
+1
-1
-2
-2
-3
推求的依据:化合物中元素的化合价代数和为零。
3.根据化合价判断化学式正误
下列化学式有无错误,有错误的请改正 氧化铝 氧化镁 氧化钠 氯化亚铁 氯化铜 Al O MgO 2 Na 2O FeCl3 CaCl2 硫酸铝 硫酸 硫酸钠 碳酸钠 Al2 SO4 SO4 Na SO4 Na CO3 氢氧化钠 氢氧化铜 氢氧化铁 NaOH Cu OH 2 Fe(OH) 2
2
Cu
( )3
H2
2
2
( )
3
3
2
【基础练习】
2H2
2Mg2+
CO2
-2
2H
两个氢分子
两个氢原子
两个镁离子
二氧化碳中氧元素显-2价
一个氢分子由两个氢原子构成
一个镁离子带两个单位正电荷
一个二氧化碳分子中含有两个氧原子
说明下列符号中数字“2”的含义
指出下列符号中“2”的意义
1、 2N ,
2、H2 ,
3、O2 ,
4、2O2 ,
5、2Na+ ,
6、Mg2+ ,
7、Fe2+
8、2Fe3+
9、2NH4+
10、H2O
11、SO42-
12、Mg
13 SO2
+2
-2
要
抄题
请用数字和符号表示
1、两个氢原子 8、三个氢氧根离子
2、一个氮分子 9、两个氧离子
3、两个氧分子 10、三个水分子
4、氖气 11、两个硝酸根离子
5、铁的化学式 12、铜元素
6、三个亚铁离子 13、硫元素的化合价是-2
7、一个硫离子 14、两个铵根离子
15、二氧化碳中氧元素的化合价是-2
写出下列物质的化学式:
1、硫粉 8铁 15锰酸钾
2、水 9氖气 16二氧化锰
3、碳酸钠 10五氧化二磷 17、氧化铝
4、氧气 11四氧化三铁 18 氧化铁
5、氯化亚铁 12双氧水 19 硫酸钾
6、二氧化硫 13氯酸钾 20硝酸镁
7、氯化钾 14高锰酸钾 21氢氧化钙
按要求填写下列空格
1,写出空气中含量最多物质的化学式____
2,写出地壳中含量最多的元素名称______
3,写出最轻气体的物质名称______
4,写出人体中含量最多的金属元素的符号______
5,最易自燃物质的化学式_____
6,3个铁离子的化学符号______
写出下列反应的文字表达式,并在相应的物质下方写出物质的化学式,是分解反应、化合反应的,注明反应类型.
1、用高锰酸钾制氧气
2、用氯酸钾和二氧化锰制氧气
3、用双氧水制氧气
4、电解水
5、氢气在空气中燃烧发生爆炸
6、红磷在空气中燃烧
7、硫在空气中燃烧
8、铁丝在氧气中燃烧
9、镁条在空气中燃烧
10、加热铜绿
三、有关相对分子质量的计算
∴H2O的相对分子质量
=(1+0)×2+(8+8)=18
H2O的意义:一个H2O分子是由两个H原子和一个O原子构成的。
相对分子质量的理解
真实质量:一个H2O分子的质量=两个H原子+一个O原子的质量
相对质量:一个H2O分子的相对分子质量=两个H原子相对原子质量+一个O原子的相对原子质量
定义:化学式中各原子的相对原子质量的总和,就是相对分子质量。
计算 H2SO4和H3PO4的相对分子质量
【解】(NH4)2SO4的相对分子质量
=(14+1×4)×2+32+16×4=132
【说明】每种纯净物的组成是固定不变的,所以,每种纯净物的相对分子质量也是固定不变的。如:H2:2 O2:32 H2O:18 CO2:44
计算 (NH4)2SO4的相对分子质量
题型一:
计算相对分子质量
例:
O2的相对分子质量
=16×2
=32
H2O的相对分子质量
=1×2+16
=18
例2:求2O2 、nH2O的总相对分子质量
2.计算物质组成元素的质量比
例1:求Fe2O3中铁元素和氧元素的质量比。
Fe2O3中铁元素和氧元素的质量比
Fe:O=(56×2):(16×3)=112:48=7:3
例2:计算锰酸钾(K2MnO4)中各元素的质量比。
【解】 K2MnO4中各元素的质量比
K:Mn:O=(39×2):55:(16×4)=78:55:64
题型二:计算物质组成元素的质量比
例:求二氧化碳中碳元素和氧元素的质量比
CO2
12︰16×2
=3︰8
练一练:
计算氧化铝中铝元素和氧元素的质量比
Al O
+3 -2
2 3
27×2︰16×3
= 9︰8
元素的质量之比=一种元素的相对原子质量X原子个数: 另一种元素的相对原子质量X原子个数
3.计算物质中某元素的质量分数
例:⑴计算二氧化硫中硫元素的质量分数
⑵计算64t二氧化硫中含硫元素的质量。
⑴ SO2的相对分子质量=32+16×2=64
SO2中硫元素的质量分数=
S的相对原子质量×1
SO2的相对分子质量
×100%
=
32
64
=50%
×100%
⑵ 64t二氧化硫中含硫元素的质量
=64t×50%=32t
题型三:计算物质中某元素的质量分数
例:计算化肥硝酸铵(NH4NO3)中氮元素的质量分数。
NH4NO3的相对分子质量=
14+1×4+14+16×3
=80
硝酸铵中氮元素的质量分数为:
=35%
练一练:
计算化肥尿素〔CO(NH2)2〕中氮元素的质量分数。
尿素的相对分子质量
=12+16+(14+2) ×2
=60
尿素中氮元素的质量分数为
=46.7%
相对原子质量 ×分子内该原子个数
元素的
质量分数
=
相对分子质量
例:血红蛋白的相对分子质量为68000,已知其中铁元素的质量分数为0.33%,则每个血红蛋白分子中含铁原子的个数为 。
X=4
=元素质量:化合物的质量
例:100g 碳酸钙中含钙多少克?
CaCO3
中钙的质量分数=
40
40+12+16×3
×100%
=40%
∴100g×40%=40g
化合物质量X化合物中某元素的质量分数
=该元素的质量
公式变形、运用
2、 (2002·江西省)下列物质中铁元素的质量分数最高的是( )
A? FeO B? Fe2O3
C? Fe3O4 D? Fe2(SO4)3
FeO Fe2O3 Fe3O4 Fe2(SO4)3
↓ ↓ ↓ ↓
FeO FeO FeO Fe(SO4)
A
题型四:利用化合物中元素的质量分数或各元素的质量比求化学式
例:笑气是由氮、氧两种元素组成的化合物,其相对分子质量为44,氮、氧元素的质量比为7︰4,则它的化学式为 。
7
14
4
16
︰
=2︰1
(N2O)n
(14×2+16) ×n=44
n=1
N2O
题型五:有关混合物中元素质量分数的计算
例:某市场销售的化肥硝铵,经检测知道其含氮量为34.3%,则该化肥含硝酸铵的质量分数为______。(设其它成分不含氮元素)
×
混合物中硝酸铵的质量分数
=
混合物中含氮量
硝酸铵中氮元素的质量分数
34.3 0/0
35 0/0
=
98 0/0
想一想;含铁元素为70 0/0的氧化铁粉末是纯净物还是混合物?
方法一:设硝酸铵样品的质量为m,硝酸铵样品中硝酸铵的质量分数为x。 根据题意得出等式:样品中纯硝酸铵的质量=mx
28
79
28
79
m
X=98%
样品中N元素的质量=mx. X100%
样品中N元素的质量分数: mx. X100%
=34.3%
方法二:NH4NO3——2N
79
x
28
34.3%
79
x
28
34.3%
=
=
混合物中含氮量
34.3%
35 %
=
98 %
想一想;含铁元素为70 0/0的氧化铁粉末是纯净物还是混合物?
混合物中硝酸铵的质量分数
纯硝酸铵中氮元素的质量分数
方法三
【例6】已知某Fe2O3样品中铁元素的质量分数为63%(杂质不含铁元素),求此氧化铁样品中的质量分数。
方法一:设样品的质量为m,氧化铁的质量分数为x。 根据题意得出等式:样品中纯氧化铁的质量=mx
112
160
112
160
m
X=90%
样品中铁元素的质量= mx. X100%
样品中铁元素的质量分数: mx. X100%
=63%
有一不纯的硫酸铵样品(所含杂质不含氮),经分析知道它含有20%的氮,求样品里含(NH4)2SO4的质量分数。
(NH4)2SO4
__
2N
132
28
20%
X
132
28
20%
X
=
X=94.29%
【剖析】 此类题的解题思路一般为:先设出此化合物的化学式,然后利用物质中两元素的质量比和相对原子质量之比的计算关系式,求出原子个数比,写出化学式。(注意:由于A、B的位置不固定,可有两种形式)
【例1】已知由A、B两元素组成的化合物中,A、B两元素的质量比为7﹕3,A、B两元素的相对原子质量之比为7﹕2,求该化合物的化学式。
解:设此化合物的化学式为AxBy,A的相对原子质量为A,B的相对原子质量为B。
由题意可知:
可求得:x﹕y=2﹕3
∴该化合物化学式为A2B3或B2A3。
【例1】已知由A、B两元素组成的化合物中,A、B两元素的质量比为7﹕3,A、B两元素的相对原子质量之比为7﹕2,求该化合物的化学式。
类型2、根据相对分子质量和各元素的质量分数,求化学式。
【例2】已知某有机物的相对分子质量为46,其中C、H、O的质量分数分别为52.2%、13.0%、34.8%,求此有机物的化学式。
【剖析】此类习题首先观察C、H、O三者的含量加在一起为100%,确定物质中只含有C、H、O三种元素,再根据分子质量和各元素的含量,求出化学式中各元素的原子个数,写出化学式。
解:C原子个数=46X52.2%/12=2
H原子个数=46X13.0%/1=6
O原子个数=46X34.8%/16=1
∴此有机物的化学式为C2H6O 。
【例2】已知某有机物的相对分子质量为46,其中C、H、O的质量分数分别为52.2%、13.0%、34.8%,求此有机物的化学式。
【例3】已知FeSO4和Fe2(SO4)3两种物质的混合物中,硫元素
的质量分数为a%,求混合物中铁元素的质量分数。
【剖析】解决此类习题要求学生有敏锐的观察力,因为直接求难以求出。仔细观察两种物质的化学式,不难看出两种物质化学式中硫原子和氧原子的个数比都为1﹕4,所以混合物中两种元素的质量比为 32﹕16×4=1﹕2 ,即氧元素的质量为硫元素的2倍,由硫元素的质量分数,可求出氧元素的质量分数,剩余的则是铁元素的质量分数。
解:由两种物质的化学式可知:物质中氧元素的质量是硫元素的2倍,所以氧元素的质量分数为2a% 。
则铁元素的质量分数为1-a%-2a%=1-3a% 。
【例3】已知FeSO4和Fe2(SO4)3两种物质的混合物中,硫元素的质量分数为a%,求混合物中铁元素的质量分数。
【注意:此类题还有可能再延伸。例如:(NH4)2S、(NH4)2SO4、(NH4)2HPO4三种物质的混合物中,已知氮元素的质量分数为28%,求混
合物中氧元素的质量分数。此题根据H、P、S三元素的相对原子质量关系: 1+31=32,可把(NH4)2HPO4看成(NH4)2SO4,再根据上题方法来求,最终答案为32%。】
例1:原计划用90kg尿素[CO(NH2)2],现因缺货改用硝酸铵(NH4NO3).计算需要用多少千克的硝酸铵才能与90kg尿素的含氮量相等?
解法1:90kg尿素[CO(NH2)2]含氮元素的质量:90kgX28/80X100%=31.5kg
多少千克的NH4NO3中含31.5kg的氮元素:31.5kg/28/79X100%=120kg
解法2:设需要硝酸铵质量为x.
据关系式NH4NO3 ~ CO(NH2)2
80 60
x 90kg
80:60=x:90kg
x=120kg
答:需用NH4NO3120kg.
例4:某硝酸铵样品中混有另一种氮肥,经测定该样品中含氮38%,则该样品中可能混有的氮肥是( )
A.NH4HCO3 B.(NH4)2SO4 C.NH4Cl D.CO(NH2)2
解析:先求出纯净的硝酸铵的含氮量为35%,已知样品中含氮量为38%,所以样品中一定混有含氮量比38%更高的氮肥.计算已知各种氮肥的含氮量分别为:NH4HCO3 17.7% (NH4)2SO4 21.2% NH4Cl 26.2% CO(NH2)2 46.7%
所以答案为D.
84∶11∶4
168
12×28+44+16=396
12×28︰44︰16=84︰11︰4
典型题:维生素是人体必备的营养物质,维生素D2的化学式为C28H44O。试计算:
(1)维生素D2的相对分子质量 ;
(2)维生素D2中的碳、氢、氧三种元素的质量比 ;
(3)198g维生素D2中含碳元素的质量为_____________g。
396
同课章节目录
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的构成
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题1 质量守恒定律
- 课题2 如何正确书写化学方程式
- 课题3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动3 燃烧的条件
- 旧版目录
- 第五单元 物质组成的表示
- 课题2 燃料和热量
- 课题3 使用燃料对环境的影响
