2.3重要的碱复习课(课件 12PPT)
文档属性
| 名称 | 2.3重要的碱复习课(课件 12PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-11-17 17:46:13 | ||
图片预览




文档简介
(共12张PPT)
重要的碱
复习课
1.CuO + H2SO4 == CuSO4 + H2O
制取Cu(OH)2
2. CuSO4 + 2NaOH== Cu(OH) 2 ↓ + Na2SO4
提示:
1.酸碱有腐蚀,实验过程中请注意安全。
2. CuO要少量
制取Cu(OH)2
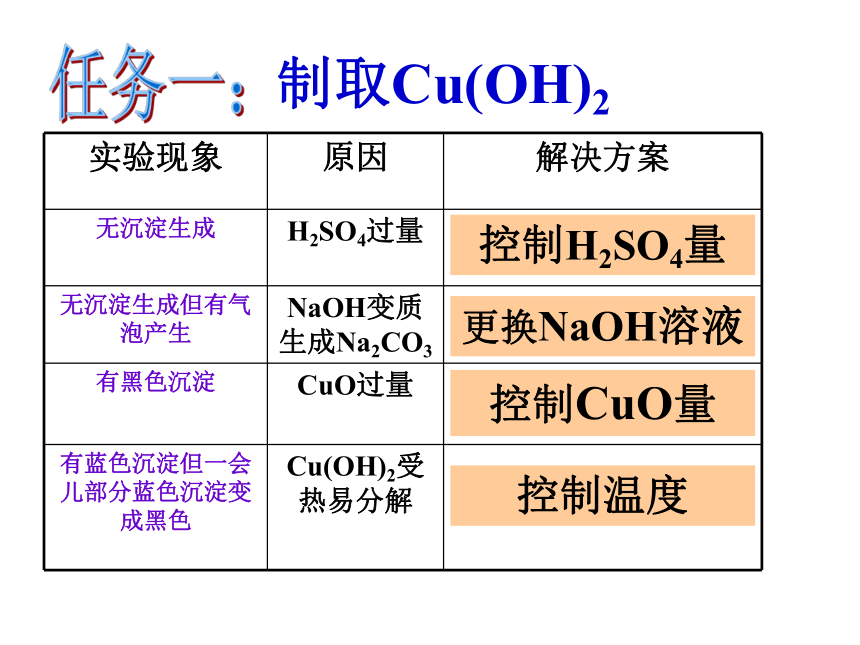
实验现象 原因
无沉淀生成
无沉淀生成但有气泡产生
有黑色沉淀
有蓝色沉淀但一会儿部分蓝色沉淀变成黑色
为什么最终得不到蓝色沉淀Cu(OH)2 ?
H2SO4过量
NaOH变质生成Na2CO3
CuO过量
Cu(OH)2受热易分解
制取Cu(OH)2
实验现象 原因 解决方案
无沉淀生成 H2SO4过量
无沉淀生成但有气泡产生 NaOH变质生成Na2CO3
有黑色沉淀 CuO过量
有蓝色沉淀但一会儿部分蓝色沉淀变成黑色
Cu(OH)2受热易分解
控制H2SO4量
更换NaOH溶液
控制CuO量
控制温度
制取Cu(OH)2
提示:
1.酸碱有腐蚀,实验过程中请注意安全。
2.学会控制反应物的量和反应温度。
3.看看哪些组做的既快又成功。
1.CuO + H2SO4 == CuSO4 + H2O
2. CuSO4 + 2NaOH== Cu(OH) 2 ↓ + Na2SO4
NaOH
H2SO4
CO2
CuSO4
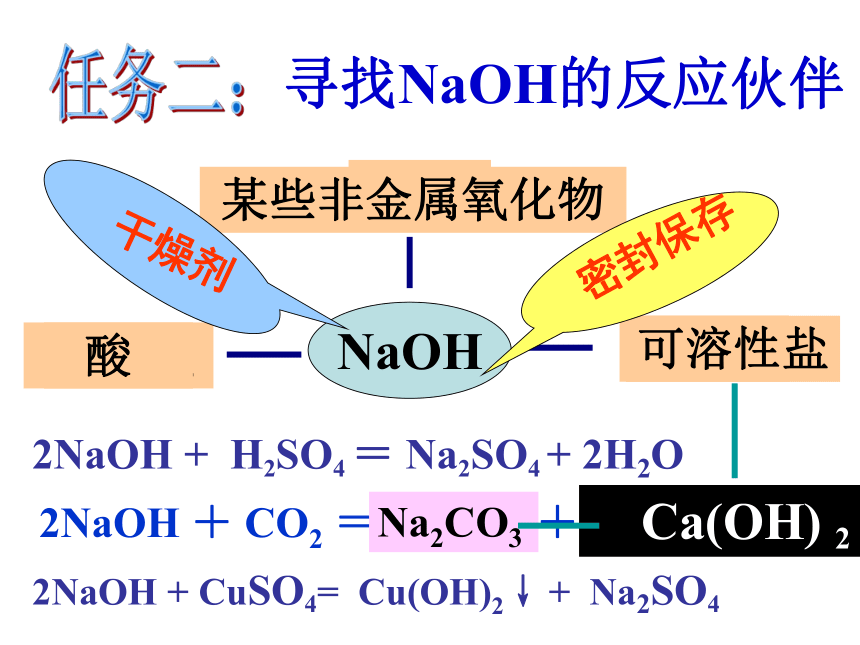
寻找NaOH的反应伙伴
2NaOH + H2SO4 = Na2SO4 + 2H2O
2NaOH + CO2 =Na2CO3 +H2O
2NaOH + CuSO4= Cu(OH)2↓ + Na2SO4
酸
某些非金属氧化物
可溶性盐
Na2CO3
Ca(OH) 2
密封保存
干燥剂
可溶性碱
酸
某些非金属氧化物
可溶性盐
寻找NaOH的反应伙伴
酸碱指示剂
KOH
NaOH
Ba(OH)2
Ca(OH)2(微溶)
NH3.H2O
Ca(OH)2
金属氧化物+水
说说Cu(OH)2及伙伴的规律
Cu(OH)2
不溶性碱
Cu(OH)2 Fe(OH)3 Al(OH)3 Mg(OH)2
………
H2SO4
酸
△
金属氧化物+水
1.碱的涵义:碱是电离时产生的阴离子全部是氢氧根离子的化合物。
可溶性碱
不溶性碱
NaOH KOH
Ba(OH)2 Ca(OH)2(微溶)
NH3.H2O
Cu(OH)2 Fe(OH)3 Al(OH)3 Mg(OH)2 ……
按水溶
性分
2.碱的分类:
可溶性碱 不溶性碱
金属氧化物+水 可溶性碱
1.某同学为了鉴别NaOH溶液和 Ca(OH) 2溶液性质,设计了如图所示的四组实验方案,其中能达到目的的是( )
D
D
C
B
A
通入CO2
酚酞试液
CuSO4溶液
盐酸
2.为了防止食品受潮,可在包装袋中放一小包生石灰做干燥剂,生石灰起干燥作用时发生的化学方程式为
————————————————
CaO + H2O === Ca(OH)2
Na2O + H2O ===2 NaOH
K2O + H2O ===2 KOH
BaO + H2O === Ba(OH)2
3.在实验室用氧化铜、稀硫酸和氢氧化钠溶液制备氢氧化铜.
(1)小芳取少量氧化铜和一定量溶质质量分数较大的硫酸,略微加热后得到蓝色溶液,接着滴入几滴氢氧化钠溶液,结果没有氢氧化铜蓝色沉淀生成.请你帮助小芳分析没有得到蓝色沉淀的原因____________ 并写出滴入氢氧化钠溶液后发生反应的化学方程式
________________________________________________________________
(2)小刚取少量氧化铜和一定量稀硫酸,经过较长时间加热,氧化铜全部溶解后,立即加入氢氧化钠溶液,结果也没有得到蓝色沉淀,试管中却意外出现了黑色固体.请写出黑色固体的化学式________
硫酸过量
CuO
2NaOH + H2SO4 = Na2SO4 + 2H2O
重要的碱
复习课
1.CuO + H2SO4 == CuSO4 + H2O
制取Cu(OH)2
2. CuSO4 + 2NaOH== Cu(OH) 2 ↓ + Na2SO4
提示:
1.酸碱有腐蚀,实验过程中请注意安全。
2. CuO要少量
制取Cu(OH)2
实验现象 原因
无沉淀生成
无沉淀生成但有气泡产生
有黑色沉淀
有蓝色沉淀但一会儿部分蓝色沉淀变成黑色
为什么最终得不到蓝色沉淀Cu(OH)2 ?
H2SO4过量
NaOH变质生成Na2CO3
CuO过量
Cu(OH)2受热易分解
制取Cu(OH)2
实验现象 原因 解决方案
无沉淀生成 H2SO4过量
无沉淀生成但有气泡产生 NaOH变质生成Na2CO3
有黑色沉淀 CuO过量
有蓝色沉淀但一会儿部分蓝色沉淀变成黑色
Cu(OH)2受热易分解
控制H2SO4量
更换NaOH溶液
控制CuO量
控制温度
制取Cu(OH)2
提示:
1.酸碱有腐蚀,实验过程中请注意安全。
2.学会控制反应物的量和反应温度。
3.看看哪些组做的既快又成功。
1.CuO + H2SO4 == CuSO4 + H2O
2. CuSO4 + 2NaOH== Cu(OH) 2 ↓ + Na2SO4
NaOH
H2SO4
CO2
CuSO4
寻找NaOH的反应伙伴
2NaOH + H2SO4 = Na2SO4 + 2H2O
2NaOH + CO2 =Na2CO3 +H2O
2NaOH + CuSO4= Cu(OH)2↓ + Na2SO4
酸
某些非金属氧化物
可溶性盐
Na2CO3
Ca(OH) 2
密封保存
干燥剂
可溶性碱
酸
某些非金属氧化物
可溶性盐
寻找NaOH的反应伙伴
酸碱指示剂
KOH
NaOH
Ba(OH)2
Ca(OH)2(微溶)
NH3.H2O
Ca(OH)2
金属氧化物+水
说说Cu(OH)2及伙伴的规律
Cu(OH)2
不溶性碱
Cu(OH)2 Fe(OH)3 Al(OH)3 Mg(OH)2
………
H2SO4
酸
△
金属氧化物+水
1.碱的涵义:碱是电离时产生的阴离子全部是氢氧根离子的化合物。
可溶性碱
不溶性碱
NaOH KOH
Ba(OH)2 Ca(OH)2(微溶)
NH3.H2O
Cu(OH)2 Fe(OH)3 Al(OH)3 Mg(OH)2 ……
按水溶
性分
2.碱的分类:
可溶性碱 不溶性碱
金属氧化物+水 可溶性碱
1.某同学为了鉴别NaOH溶液和 Ca(OH) 2溶液性质,设计了如图所示的四组实验方案,其中能达到目的的是( )
D
D
C
B
A
通入CO2
酚酞试液
CuSO4溶液
盐酸
2.为了防止食品受潮,可在包装袋中放一小包生石灰做干燥剂,生石灰起干燥作用时发生的化学方程式为
————————————————
CaO + H2O === Ca(OH)2
Na2O + H2O ===2 NaOH
K2O + H2O ===2 KOH
BaO + H2O === Ba(OH)2
3.在实验室用氧化铜、稀硫酸和氢氧化钠溶液制备氢氧化铜.
(1)小芳取少量氧化铜和一定量溶质质量分数较大的硫酸,略微加热后得到蓝色溶液,接着滴入几滴氢氧化钠溶液,结果没有氢氧化铜蓝色沉淀生成.请你帮助小芳分析没有得到蓝色沉淀的原因____________ 并写出滴入氢氧化钠溶液后发生反应的化学方程式
________________________________________________________________
(2)小刚取少量氧化铜和一定量稀硫酸,经过较长时间加热,氧化铜全部溶解后,立即加入氢氧化钠溶液,结果也没有得到蓝色沉淀,试管中却意外出现了黑色固体.请写出黑色固体的化学式________
硫酸过量
CuO
2NaOH + H2SO4 = Na2SO4 + 2H2O
