广东梅县2021-2022学年度高三第一学期中段考试化学试卷(PDF版答案)
文档属性
| 名称 | 广东梅县2021-2022学年度高三第一学期中段考试化学试卷(PDF版答案) |  | |
| 格式 | |||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-18 10:00:19 | ||
图片预览


文档简介
2021-2022 学年度高三第一学期中段考试化学(试卷) 3. 下列有关物质的工业制法中,正确的是
A. 制钠:以海水为原料制得精盐,再电解熔融的 NaCl
B. 炼铜:电解精炼黄铜矿得到纯度为 99.9%的铜
(考试时间:75 分钟 试卷满分:100 分)
C. 制硅:用一氧化碳还原二氧化硅得硅
注意事项:
D. 制铝:电解液态氯化铝得铝
1.本试卷分第 I 卷(选择题)和第 II 卷(非选择题)两部分。
4. 生产、生活中蕴含了丰富的化学知识,下列有关说法错误的是
2.请将各题答案填写在答题卡上。
A. 小苏打可用作食品膨松剂
3.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23
B. K2FeO4具有强氧化性,可以软化硬水
Cl-35.5 Fe-56 Cu-64
C. 利用催化剂可减少汽车尾气中有害气体的排放
第 I 卷 (选择题 共 44 分)
D. 天眼 FAST 用到的碳化硅是一种新型无机非金属材料
一、单项选择题:本题共 10 小题,每题 2 分,共计 20 分。每小题只有一个选项符合题意。
5. 下列实验操作能达到实验目的的是
1. 从石油原料到口罩的生产过程中涉及的下列变化,不属于化学变化的是
A. 用装置甲从碘水中萃取碘
石油催化裂解得到 丙烯催化聚合生 聚丙烯熔融后喷丝 用环氧乙烷与微生物
B. 用装置乙验证 SO2的漂白性
丙烯 成聚丙烯 压成熔喷布 蛋白质发生反应消毒
C. 用装置丙检验溶液中是否有 +K
D. 用装置丁将 FeCl3溶液蒸干制备 FeCl3
A B C D
6. 设 NA为阿伏加德罗常数的值。下列有关叙述错误的是
A. A B. B C. C D. D
A. 某温度和压强下,48 g O2和 O3 的混合气体中含有的氧原子总数为 3NA
2. 中华民族为人类文明进步做出了巨大贡献,运用化学知识对下列事例进行分析,错误的是
B. 在合成氨反应中,当有 2.24 L 氨气(标准状况下)生成时,转移的电子数为 0.3NA
A. 闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成 -1
C. 1 L 1 mol·L Na2CO3水溶液中含有的氧原子数为 3NA
B. 李白有诗云“日照香炉生紫烟”,这是描写“碘的升华”
D. 4.6 g 乙醇中含有 O-H 键数目为 0.1NA
C. 北宋沈括《梦溪笔谈》中记载“熬胆矾铁釜,久之亦化为铜”,是发生了置换反应
D. 屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
1
7. 下列叙述 I 和 II 均正确并且有因果关系的是 A.反应Ⅰ的关键是隔绝空气和水
B.反应Ⅱ的产物 LiOH 是离子化合物
叙述 I 叙述 II
C.整个流程中,金属锂是催化剂
A NH3能使酚酞溶液变红 NH3可用于设计喷泉实验
D.整个流程的总化学方程式为
B 1-己醇的沸点比己烷的沸点高 1-己醇和己烷可通过蒸馏初步分离 2N2+6H2O 4NH3+3O2
二、单选选择题:本题包括 6 小题,每小题 4 分,共计 24 分。每小题只有一个选项符合题意。
C SO2有漂白性 SO2能使溴水褪色
11. 手性碳原子是指连有四个不同基团的碳原子。一种天然化合物 X 的结构简式如图所示,,下列有
D Na 在 Cl2中燃烧的生成物含离子键 NaCl 固体可导电 关该化合物的说法中错误的是
A. A B. B C. C D. D A.化合物 X 的分子式为 C19H18O7
8. 下列离子方程式错误的是 B. 每个 X 分子中含有 1 个手性碳原子
- 2- - C. 化合物 X 能发生加成、取代、消去、氧化反应
A. 少量 SO2气体通入次氯酸钠溶液中:SO2 +3C1O +H2O=SO4 +Cl +2HClO
D. 1 mol 化合物 X 最多能与 4 mol NaOH 发生反应
3+ -
B. 向 Fe2(SO4)3 饱和溶液中滴加几滴 NaOH 溶液:Fe +3OH =Fe OH 3 12. 对下列选项中的操作和现象,其解释与结论错误的是
Fe O +6H+ =2Fe3+C. 氧化铁溶于 HI 溶液: 2 3 +3H2O 选项 操作 现象 解释与结论
2- -
D. 向硅酸钠水溶液中通入过量 CO2气体:SiO3 +2H2O+2CO2 =2HCO3+H2SiO3 上层溶液呈紫
A 向 NaI 溶液中滴入少量新制氯水和苯,振荡、静置 - I 还原性强于 -Cl
9. 在给定条件下,下列选项所示物质间不满足每一步转化均能实现的是 红色
O g NaOH aq
A. N 22(g) NO(g) NaNO放电 3
(aq) 无水乙醇与浓硫酸共热至 170℃,将产生的气体通 乙烯和溴水发生加
B 溴水褪色
NaOH aq
B. SiO2(s) Na2SiO3(aq)
CO2 g H 入溴水
成反应
2
SiO3(s)
NaOH aq
C. Al(s) NaAlO2(aq)
CO
2
g
Al(OH)3(s) 向物质的量浓度、体积均相同的 Na 水解程度: 2CO3和 NaHCO3 变红,前者红
C
2
Al s 稀HNO aq 溶液中各滴加 1 滴酚酞 色更深 CO 3 >HCO 3 D. Fe2O3(s) Fe(s) 3 Fe(NO3)3(aq) 高温
10.一种基于锂元素的电化学过程合成氨的方法,其效率能达到 88.5%,其工艺流程如图所示。 -1室温下,向浓度均为 0.01mol·L 的 KCl 和 KI 混合
D 出现黄色沉淀 Ksp(AgCl)>Ksp(AgI)
反应Ⅲ的条件是电解。下列说法错误的是 溶液中滴加少量 AgNO3溶液
A.A B. B C. C D. D
2
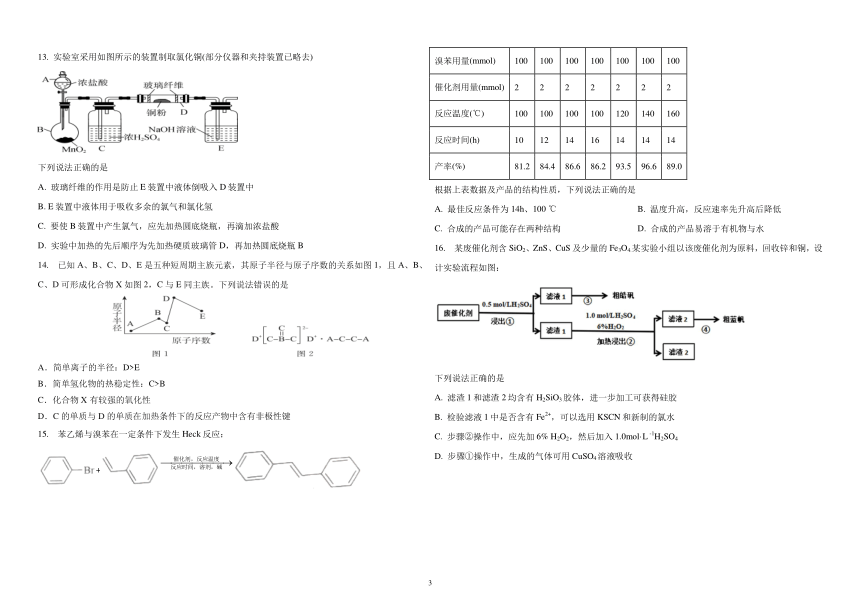
13. 实验室采用如图所示的装置制取氯化铜(部分仪器和夹持装置已略去) 溴苯用量(mmol) 100 100 100 100 100 100 100
催化剂用量(mmol) 2 2 2 2 2 2 2
反应温度(℃) 100 100 100 100 120 140 160
反应时间(h) 10 12 14 16 14 14 14
下列说法正确的是 产率(%) 81.2 84.4 86.6 86.2 93.5 96.6 89.0
A. 玻璃纤维的作用是防止 E 装置中液体倒吸入 D 装置中 根据上表数据及产品的结构性质,下列说法正确的是
B. E 装置中液体用于吸收多余的氯气和氯化氢 A. 最佳反应条件为 14h、100 ℃ B. 温度升高,反应速率先升高后降低
C. 要使 B 装置中产生氯气,应先加热圆底烧瓶,再滴加浓盐酸 C. 合成的产品可能存在两种结构 D. 合成的产品易溶于有机物与水
D. 实验中加热的先后顺序为先加热硬质玻璃管 D,再加热圆底烧瓶 B 16. 某废催化剂含 SiO2、ZnS、CuS 及少量的 Fe3O4.某实验小组以该废催化剂为原料,回收锌和铜,设
14. 已知 A、B、C、D、E 是五种短周期主族元素,其原子半径与原子序数的关系如图 1,且 A、B、 计实验流程如图:
C、D 可形成化合物 X 如图 2,C 与 E 同主族。下列说法错误的是
A.简单离子的半径:D>E
下列说法正确的是
B.简单氢化物的热稳定性:C>B
C.化合物 X 有较强的氧化性 A. 滤渣 1 和滤渣 2 均含有 H2SiO3胶体,进一步加工可获得硅胶
D.C 的单质与 D 的单质在加热条件下的反应产物中含有非极性键 2+B. 检验滤液 1 中是否含有 Fe ,可以选用 KSCN 和新制的氯水
15. 苯乙烯与溴苯在一定条件下发生 Heck 反应: -1C. 步骤②操作中,应先加 6% H2O2,然后加入 1.0mol·L H2SO4
催化 剂, 反应温度
D. 步骤①操作中,生成的气体可用 CuSO4溶液吸收
+ 反应时间,溶剂,碱
3
第Ⅱ卷 (非选择题 共 56 分) 18. ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。某兴趣小组通过下图所示装置(夹
三、非选择题 持装置略)对其进行制备、收集、吸收并制取 NaClO2。
17. 某小组同学设计如下实验,研究亚铁盐与 H2O2溶液的反应。
-1
【实验Ⅰ】试剂:酸化的 0.5 mol·L FeSO4 溶液(pH=0.2),5%H2O2溶液(pH=5)。
操作 现象
取 2 mL 上述 FeSO4 溶液于试管中,加入 5 溶液立即变为棕黄色,稍后产生气泡,测得
滴 5% H2O2 溶液 反应后溶液 pH=0.9
向反应后的溶液中加入 KSCN 溶液 溶液变红 (1)仪器的 B 名称是_____________。
(1)产生气泡的原因是 。 (2)打开B的活塞,A中有ClO2生成,若制备1 mol ClO2,理论上消耗的硫酸的物质的量为_____________;
Ⅱ -1【实验 】试剂:未酸化的 0.5 mol·L FeSO4 溶液(pH=3),5% H O 溶液(pH=5)。 D 中吸收 ClO2后生成 NaClO2,写出 D 中所发生反应的离子方程式:______________________________ 2 2 。
操作 现象 (3)E 中溶液出现黄色 (填“能”或“否”)说明 ClO2未被 H2O2和 NaOH 的混合溶液充分吸收,
取 2 mL 5% H2O2溶液于试管中,加入 5 溶液立即变为棕黄色,产生大量气泡并放热,反应混 说明理由:______________________________________。
滴上述 FeSO4 溶液 合物颜色加深且有浑浊。测得反应后溶液 pH=1.4 (4) 已知:当 pH≤2.0时,ClO
- 能被 -I 还原。E 装置吸收逸出的少量 ClO2气体后所得溶液(pH 为 5.52 ~
-1
(2)将上述反应后的混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加 4 mol·L 盐
6.5)中存在少量ClO-2 。请补充完整检验 E 装置溶液中存在少量ClO
-
2 的实验方案:取一定体积 E 装置中
酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有 Fe2O3,经检验还含有 S 。检验棕黄色沉淀中 S
的溶液于分液漏斗中, ,则溶液中存在ClO- 。(实验中须使用的试剂有:
的方法是 。 2
(3)对于生成红褐色胶体的原因,提出两种假设: CCl4、稀硫酸、淀粉溶液)
ⅰ 2+ + 2+.H2O2溶液氧化 Fe 消耗 H ⅱ.Fe 的氧化产物发生了水解 19. ZrO2是重要的耐高温材料,可用作陶瓷遮光剂和良好的催化剂。天然锆英石(ZrSiO4)含有铁、铝、
①根据实验Ⅱ记录否定假设ⅰ,理由是 。 铜等金属元素的氧化物杂质,工业以锆英石为原料制备 ZrO2的工艺流程如下:
②验证假设ⅱ:取 2 mL 蒸馏水于试管中,加入 5 滴 加热,溶液变为红褐色,pH 下降,
证明假设ⅱ成立。
【实验Ⅲ】若用 FeCl2 溶液替代 FeSO4 溶液,其余操作与实验Ⅱ相同,除了产生与Ⅱ相同的现象外,还生成
有刺激性气味的气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(4)产生刺激性气味气体的原因是 。 已知:
2+
(5)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与 H2O2反应的现象与 (至少写两点)有关。 ①锆英石能与烧碱高温反应生成可溶于水的 Na2ZrO3,Na2ZrO3与酸反应生成 ZrO 。
4
②部分离子在实验条件下开始沉淀和完全沉淀时的 pH 如下表: 回答下列问题:
(1)C 中官能团 名称有______________ 。
(2)碳原子上连有 4 个不同的原子或基团时,该碳称为手性碳。则有机物Ⅰ中的手性碳数目有____个。
(3)G→H 的反应类型为______________;B→C 反应需要的试剂和条件为______________
(4)C→D 中步骤①反应的化学方程式为_______________。
(1)ZrSiO4中 Zr 的化合价为__________滤渣 2 的主要成分为__________ 。
(5)E 的结构简式为______________
(2)“碱熔”过程中 ZrSiO4发生反应的化学方程式_______________________________。
2 6 X F X ______________
本流程使用 除铜,若盐酸溶解后溶液中 + -
1 2
= +
( ) 是 的同分异构体,则满足下列条件的 的结构有
(3) NaCN c(Cu ) 0.01 mol·L ,当溶液中 Cu 开始沉淀时,
- -10 ①能发生水解反应和银镜反应;
c(CN )=__________。(已知 Ksp[Cu(CN)2]=4×10 )
②能与 FeCl3溶液发生显色反应,且苯环上有三个取代基。
(4)向除 Cu 后所得滤液中加氨水调 pH=b,发生的离子方程式为_______________________ 。
(5)过滤时需要用到的玻璃仪器_______________ 。
(6)由氢氧化锆制备高纯二氧化锆的方法是 。 (7)参照上述合成路线,设计以 、CH3OH 和 为主要原料制
20. 有机物Ⅰ(英文名为 Esmolol)是治疗快速室上性心律失常、急性心肌缺血、术后高血压等的理想药
物,Esmolol 的合成路线如图:
备 的的合成路线。
已知:
5
2021-2022 学年度高三第一学期中段考试化学(答案) (5) 漏斗、烧杯、玻璃棒 (3 分)
(6) 高温焙烧
题号 1 2 3 4 5 6 7 8 9 10
20.(15 分) (除特别注明外,其余每空 2 分)
答案 C B A B A C B C A C
(1) 酯基、氯原子
题号 11 12 13 14 15 16
(2) 1 (1 分)
答案 C B B A C D
(3) 取代反应 (1 分) 氯气,光照 (1 分)
17.(12 分) (每空 2 分)
2+ 3+ 3+
(1)Fe 被 H2O2氧化成 Fe (或 2Fe
2++2H++H O 2Fe3+2 2 +2H2O),在 Fe 催化下 H2O2分解生成 O2
(4) +4NaOH +2NaCl+CH COONa+2H O (3 分)
(2)取少许加入盐酸后的黄色溶液于试管中,加入 BaCl2 溶液,若产生白色沉淀
3 2
,
说明棕黄色沉淀中含有 S
(3)①反应后溶液的 pH 降低
② -1
(5)
0.25 mol·L Fe2(SO4)3 溶液
3+
(4)H2O2 分解反应放热,促进 Fe 的水解平衡正向移动,产生的 HCl 受热挥发
(6)20
(5) pH、阴离子种类、温度、反应物用量(任写两点)
18.(13 分) (除特别注明外,其余每空 2 分) (7)
(1) 分液漏斗 (1 分)
- -
(2)0.5 mol 2ClO2 +H2O2 +2OH =2ClO2 +O2 +2H2O (3 分)
(3)否,(1 分) 因为 D 装置中有氧气产生,氧气也可能将 I 氧化为 I2
(4) 用 CCl4多次萃取、分液,直至溶液中滴加淀粉溶液不显蓝色。(1 分)向溶液中滴加稀硫酸至
溶液的 pH≤2,(1 分)滴加淀粉溶液,(1 分)溶液变蓝(1 分)
(3 分)
19. (16 分) (除特别注明外,其余每空 2 分)
(1) +4 (1 分) Al(OH)3和 Fe(OH)3
高温
(2)ZrSiO4+4NaOH Na2ZrO3 + Na2SiO3 + 2H2O (3 分)
4 1
(3)2×10 mol·L
(4) ZrO
2+ +2NH3 H2O+ H2O = Zr OH ↓+2NH
+
4 (3 分) 4
6
A. 制钠:以海水为原料制得精盐,再电解熔融的 NaCl
B. 炼铜:电解精炼黄铜矿得到纯度为 99.9%的铜
(考试时间:75 分钟 试卷满分:100 分)
C. 制硅:用一氧化碳还原二氧化硅得硅
注意事项:
D. 制铝:电解液态氯化铝得铝
1.本试卷分第 I 卷(选择题)和第 II 卷(非选择题)两部分。
4. 生产、生活中蕴含了丰富的化学知识,下列有关说法错误的是
2.请将各题答案填写在答题卡上。
A. 小苏打可用作食品膨松剂
3.可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23
B. K2FeO4具有强氧化性,可以软化硬水
Cl-35.5 Fe-56 Cu-64
C. 利用催化剂可减少汽车尾气中有害气体的排放
第 I 卷 (选择题 共 44 分)
D. 天眼 FAST 用到的碳化硅是一种新型无机非金属材料
一、单项选择题:本题共 10 小题,每题 2 分,共计 20 分。每小题只有一个选项符合题意。
5. 下列实验操作能达到实验目的的是
1. 从石油原料到口罩的生产过程中涉及的下列变化,不属于化学变化的是
A. 用装置甲从碘水中萃取碘
石油催化裂解得到 丙烯催化聚合生 聚丙烯熔融后喷丝 用环氧乙烷与微生物
B. 用装置乙验证 SO2的漂白性
丙烯 成聚丙烯 压成熔喷布 蛋白质发生反应消毒
C. 用装置丙检验溶液中是否有 +K
D. 用装置丁将 FeCl3溶液蒸干制备 FeCl3
A B C D
6. 设 NA为阿伏加德罗常数的值。下列有关叙述错误的是
A. A B. B C. C D. D
A. 某温度和压强下,48 g O2和 O3 的混合气体中含有的氧原子总数为 3NA
2. 中华民族为人类文明进步做出了巨大贡献,运用化学知识对下列事例进行分析,错误的是
B. 在合成氨反应中,当有 2.24 L 氨气(标准状况下)生成时,转移的电子数为 0.3NA
A. 闻名世界的秦兵马俑是陶制品,由黏土经高温烧结而成 -1
C. 1 L 1 mol·L Na2CO3水溶液中含有的氧原子数为 3NA
B. 李白有诗云“日照香炉生紫烟”,这是描写“碘的升华”
D. 4.6 g 乙醇中含有 O-H 键数目为 0.1NA
C. 北宋沈括《梦溪笔谈》中记载“熬胆矾铁釜,久之亦化为铜”,是发生了置换反应
D. 屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
1
7. 下列叙述 I 和 II 均正确并且有因果关系的是 A.反应Ⅰ的关键是隔绝空气和水
B.反应Ⅱ的产物 LiOH 是离子化合物
叙述 I 叙述 II
C.整个流程中,金属锂是催化剂
A NH3能使酚酞溶液变红 NH3可用于设计喷泉实验
D.整个流程的总化学方程式为
B 1-己醇的沸点比己烷的沸点高 1-己醇和己烷可通过蒸馏初步分离 2N2+6H2O 4NH3+3O2
二、单选选择题:本题包括 6 小题,每小题 4 分,共计 24 分。每小题只有一个选项符合题意。
C SO2有漂白性 SO2能使溴水褪色
11. 手性碳原子是指连有四个不同基团的碳原子。一种天然化合物 X 的结构简式如图所示,,下列有
D Na 在 Cl2中燃烧的生成物含离子键 NaCl 固体可导电 关该化合物的说法中错误的是
A. A B. B C. C D. D A.化合物 X 的分子式为 C19H18O7
8. 下列离子方程式错误的是 B. 每个 X 分子中含有 1 个手性碳原子
- 2- - C. 化合物 X 能发生加成、取代、消去、氧化反应
A. 少量 SO2气体通入次氯酸钠溶液中:SO2 +3C1O +H2O=SO4 +Cl +2HClO
D. 1 mol 化合物 X 最多能与 4 mol NaOH 发生反应
3+ -
B. 向 Fe2(SO4)3 饱和溶液中滴加几滴 NaOH 溶液:Fe +3OH =Fe OH 3 12. 对下列选项中的操作和现象,其解释与结论错误的是
Fe O +6H+ =2Fe3+C. 氧化铁溶于 HI 溶液: 2 3 +3H2O 选项 操作 现象 解释与结论
2- -
D. 向硅酸钠水溶液中通入过量 CO2气体:SiO3 +2H2O+2CO2 =2HCO3+H2SiO3 上层溶液呈紫
A 向 NaI 溶液中滴入少量新制氯水和苯,振荡、静置 - I 还原性强于 -Cl
9. 在给定条件下,下列选项所示物质间不满足每一步转化均能实现的是 红色
O g NaOH aq
A. N 22(g) NO(g) NaNO放电 3
(aq) 无水乙醇与浓硫酸共热至 170℃,将产生的气体通 乙烯和溴水发生加
B 溴水褪色
NaOH aq
B. SiO2(s) Na2SiO3(aq)
CO2 g H 入溴水
成反应
2
SiO3(s)
NaOH aq
C. Al(s) NaAlO2(aq)
CO
2
g
Al(OH)3(s) 向物质的量浓度、体积均相同的 Na 水解程度: 2CO3和 NaHCO3 变红,前者红
C
2
Al s 稀HNO aq 溶液中各滴加 1 滴酚酞 色更深 CO 3 >HCO 3 D. Fe2O3(s) Fe(s) 3 Fe(NO3)3(aq) 高温
10.一种基于锂元素的电化学过程合成氨的方法,其效率能达到 88.5%,其工艺流程如图所示。 -1室温下,向浓度均为 0.01mol·L 的 KCl 和 KI 混合
D 出现黄色沉淀 Ksp(AgCl)>Ksp(AgI)
反应Ⅲ的条件是电解。下列说法错误的是 溶液中滴加少量 AgNO3溶液
A.A B. B C. C D. D
2
13. 实验室采用如图所示的装置制取氯化铜(部分仪器和夹持装置已略去) 溴苯用量(mmol) 100 100 100 100 100 100 100
催化剂用量(mmol) 2 2 2 2 2 2 2
反应温度(℃) 100 100 100 100 120 140 160
反应时间(h) 10 12 14 16 14 14 14
下列说法正确的是 产率(%) 81.2 84.4 86.6 86.2 93.5 96.6 89.0
A. 玻璃纤维的作用是防止 E 装置中液体倒吸入 D 装置中 根据上表数据及产品的结构性质,下列说法正确的是
B. E 装置中液体用于吸收多余的氯气和氯化氢 A. 最佳反应条件为 14h、100 ℃ B. 温度升高,反应速率先升高后降低
C. 要使 B 装置中产生氯气,应先加热圆底烧瓶,再滴加浓盐酸 C. 合成的产品可能存在两种结构 D. 合成的产品易溶于有机物与水
D. 实验中加热的先后顺序为先加热硬质玻璃管 D,再加热圆底烧瓶 B 16. 某废催化剂含 SiO2、ZnS、CuS 及少量的 Fe3O4.某实验小组以该废催化剂为原料,回收锌和铜,设
14. 已知 A、B、C、D、E 是五种短周期主族元素,其原子半径与原子序数的关系如图 1,且 A、B、 计实验流程如图:
C、D 可形成化合物 X 如图 2,C 与 E 同主族。下列说法错误的是
A.简单离子的半径:D>E
下列说法正确的是
B.简单氢化物的热稳定性:C>B
C.化合物 X 有较强的氧化性 A. 滤渣 1 和滤渣 2 均含有 H2SiO3胶体,进一步加工可获得硅胶
D.C 的单质与 D 的单质在加热条件下的反应产物中含有非极性键 2+B. 检验滤液 1 中是否含有 Fe ,可以选用 KSCN 和新制的氯水
15. 苯乙烯与溴苯在一定条件下发生 Heck 反应: -1C. 步骤②操作中,应先加 6% H2O2,然后加入 1.0mol·L H2SO4
催化 剂, 反应温度
D. 步骤①操作中,生成的气体可用 CuSO4溶液吸收
+ 反应时间,溶剂,碱
3
第Ⅱ卷 (非选择题 共 56 分) 18. ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。某兴趣小组通过下图所示装置(夹
三、非选择题 持装置略)对其进行制备、收集、吸收并制取 NaClO2。
17. 某小组同学设计如下实验,研究亚铁盐与 H2O2溶液的反应。
-1
【实验Ⅰ】试剂:酸化的 0.5 mol·L FeSO4 溶液(pH=0.2),5%H2O2溶液(pH=5)。
操作 现象
取 2 mL 上述 FeSO4 溶液于试管中,加入 5 溶液立即变为棕黄色,稍后产生气泡,测得
滴 5% H2O2 溶液 反应后溶液 pH=0.9
向反应后的溶液中加入 KSCN 溶液 溶液变红 (1)仪器的 B 名称是_____________。
(1)产生气泡的原因是 。 (2)打开B的活塞,A中有ClO2生成,若制备1 mol ClO2,理论上消耗的硫酸的物质的量为_____________;
Ⅱ -1【实验 】试剂:未酸化的 0.5 mol·L FeSO4 溶液(pH=3),5% H O 溶液(pH=5)。 D 中吸收 ClO2后生成 NaClO2,写出 D 中所发生反应的离子方程式:______________________________ 2 2 。
操作 现象 (3)E 中溶液出现黄色 (填“能”或“否”)说明 ClO2未被 H2O2和 NaOH 的混合溶液充分吸收,
取 2 mL 5% H2O2溶液于试管中,加入 5 溶液立即变为棕黄色,产生大量气泡并放热,反应混 说明理由:______________________________________。
滴上述 FeSO4 溶液 合物颜色加深且有浑浊。测得反应后溶液 pH=1.4 (4) 已知:当 pH≤2.0时,ClO
- 能被 -I 还原。E 装置吸收逸出的少量 ClO2气体后所得溶液(pH 为 5.52 ~
-1
(2)将上述反应后的混合物分离,得到棕黄色沉淀和红褐色胶体。取部分棕黄色沉淀洗净,加 4 mol·L 盐
6.5)中存在少量ClO-2 。请补充完整检验 E 装置溶液中存在少量ClO
-
2 的实验方案:取一定体积 E 装置中
酸,沉淀溶解得到黄色溶液。初步判断该沉淀中含有 Fe2O3,经检验还含有 S 。检验棕黄色沉淀中 S
的溶液于分液漏斗中, ,则溶液中存在ClO- 。(实验中须使用的试剂有:
的方法是 。 2
(3)对于生成红褐色胶体的原因,提出两种假设: CCl4、稀硫酸、淀粉溶液)
ⅰ 2+ + 2+.H2O2溶液氧化 Fe 消耗 H ⅱ.Fe 的氧化产物发生了水解 19. ZrO2是重要的耐高温材料,可用作陶瓷遮光剂和良好的催化剂。天然锆英石(ZrSiO4)含有铁、铝、
①根据实验Ⅱ记录否定假设ⅰ,理由是 。 铜等金属元素的氧化物杂质,工业以锆英石为原料制备 ZrO2的工艺流程如下:
②验证假设ⅱ:取 2 mL 蒸馏水于试管中,加入 5 滴 加热,溶液变为红褐色,pH 下降,
证明假设ⅱ成立。
【实验Ⅲ】若用 FeCl2 溶液替代 FeSO4 溶液,其余操作与实验Ⅱ相同,除了产生与Ⅱ相同的现象外,还生成
有刺激性气味的气体,该气体能使湿润的蓝色石蕊试纸变红但不褪色。
(4)产生刺激性气味气体的原因是 。 已知:
2+
(5)由实验Ⅰ、Ⅱ、Ⅲ可知,亚铁盐与 H2O2反应的现象与 (至少写两点)有关。 ①锆英石能与烧碱高温反应生成可溶于水的 Na2ZrO3,Na2ZrO3与酸反应生成 ZrO 。
4
②部分离子在实验条件下开始沉淀和完全沉淀时的 pH 如下表: 回答下列问题:
(1)C 中官能团 名称有______________ 。
(2)碳原子上连有 4 个不同的原子或基团时,该碳称为手性碳。则有机物Ⅰ中的手性碳数目有____个。
(3)G→H 的反应类型为______________;B→C 反应需要的试剂和条件为______________
(4)C→D 中步骤①反应的化学方程式为_______________。
(1)ZrSiO4中 Zr 的化合价为__________滤渣 2 的主要成分为__________ 。
(5)E 的结构简式为______________
(2)“碱熔”过程中 ZrSiO4发生反应的化学方程式_______________________________。
2 6 X F X ______________
本流程使用 除铜,若盐酸溶解后溶液中 + -
1 2
= +
( ) 是 的同分异构体,则满足下列条件的 的结构有
(3) NaCN c(Cu ) 0.01 mol·L ,当溶液中 Cu 开始沉淀时,
- -10 ①能发生水解反应和银镜反应;
c(CN )=__________。(已知 Ksp[Cu(CN)2]=4×10 )
②能与 FeCl3溶液发生显色反应,且苯环上有三个取代基。
(4)向除 Cu 后所得滤液中加氨水调 pH=b,发生的离子方程式为_______________________ 。
(5)过滤时需要用到的玻璃仪器_______________ 。
(6)由氢氧化锆制备高纯二氧化锆的方法是 。 (7)参照上述合成路线,设计以 、CH3OH 和 为主要原料制
20. 有机物Ⅰ(英文名为 Esmolol)是治疗快速室上性心律失常、急性心肌缺血、术后高血压等的理想药
物,Esmolol 的合成路线如图:
备 的的合成路线。
已知:
5
2021-2022 学年度高三第一学期中段考试化学(答案) (5) 漏斗、烧杯、玻璃棒 (3 分)
(6) 高温焙烧
题号 1 2 3 4 5 6 7 8 9 10
20.(15 分) (除特别注明外,其余每空 2 分)
答案 C B A B A C B C A C
(1) 酯基、氯原子
题号 11 12 13 14 15 16
(2) 1 (1 分)
答案 C B B A C D
(3) 取代反应 (1 分) 氯气,光照 (1 分)
17.(12 分) (每空 2 分)
2+ 3+ 3+
(1)Fe 被 H2O2氧化成 Fe (或 2Fe
2++2H++H O 2Fe3+2 2 +2H2O),在 Fe 催化下 H2O2分解生成 O2
(4) +4NaOH +2NaCl+CH COONa+2H O (3 分)
(2)取少许加入盐酸后的黄色溶液于试管中,加入 BaCl2 溶液,若产生白色沉淀
3 2
,
说明棕黄色沉淀中含有 S
(3)①反应后溶液的 pH 降低
② -1
(5)
0.25 mol·L Fe2(SO4)3 溶液
3+
(4)H2O2 分解反应放热,促进 Fe 的水解平衡正向移动,产生的 HCl 受热挥发
(6)20
(5) pH、阴离子种类、温度、反应物用量(任写两点)
18.(13 分) (除特别注明外,其余每空 2 分) (7)
(1) 分液漏斗 (1 分)
- -
(2)0.5 mol 2ClO2 +H2O2 +2OH =2ClO2 +O2 +2H2O (3 分)
(3)否,(1 分) 因为 D 装置中有氧气产生,氧气也可能将 I 氧化为 I2
(4) 用 CCl4多次萃取、分液,直至溶液中滴加淀粉溶液不显蓝色。(1 分)向溶液中滴加稀硫酸至
溶液的 pH≤2,(1 分)滴加淀粉溶液,(1 分)溶液变蓝(1 分)
(3 分)
19. (16 分) (除特别注明外,其余每空 2 分)
(1) +4 (1 分) Al(OH)3和 Fe(OH)3
高温
(2)ZrSiO4+4NaOH Na2ZrO3 + Na2SiO3 + 2H2O (3 分)
4 1
(3)2×10 mol·L
(4) ZrO
2+ +2NH3 H2O+ H2O = Zr OH ↓+2NH
+
4 (3 分) 4
6
同课章节目录
