江苏省扬州市邗江区2021-2022学年高一上学期期中考试化学试题(Word版含答案)
文档属性
| 名称 | 江苏省扬州市邗江区2021-2022学年高一上学期期中考试化学试题(Word版含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 369.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-18 10:04:53 | ||
图片预览


文档简介
扬州市邗江区2021-2022学年高一上学期期中考试
化学 2021.11
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Na-23 Mg-24 Cl-35.5 Cu-64
选 择 题 (共42分)
单项选择题(本题包括14小题,每题3分,共42分。每小题只有一个选项符合题意。)
1.我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。下列措施对实现“碳中和”不具有直接贡献的是
A. 推行生活垃圾分类 B. 植树造林增加绿色植被
C. 采取节能低碳生活方式 D. 创新CO2转化为碳燃料的技术
2.重铬酸钾(K2Cr2O7)是一种重要的着色剂、强氧化剂。它属于
A.酸 B.碱 C.盐 D.氧化物
3.下列化学用语使用正确的是
A.硝酸钡的化学式:BaNO3 B.钠离子的结构示意图:
C.质子数为6,中子数为8的微粒: D.NaHCO3电离:NaHCO3=Na++H++CO32-
4.下列反应既是化合反应,又是氧化还原反应的是
A.CaO+H2O=Ca(OH)2 B.2CO+O22CO2
C.C+H2OCO+H2 D.CO2+ Ca(OH)2=CaCO3↓+H2O
5.在盛放酒精的试剂瓶的标签上应印有的警示标志是
6.下列物质中属于电解质的是
A.氯化钠溶液 B.乙醇
C.铜 D.氯化镁晶体
7.下列叙述中正确的是
A.硫酸的摩尔质量是98 g
B.同温同压下,相同体积的任何气体所含的分子数目相同
C.焰色反应一定是化学变化
D.20%的NaOH溶液的物质的量浓度是10%的NaOH溶液的物质的量浓度的2倍
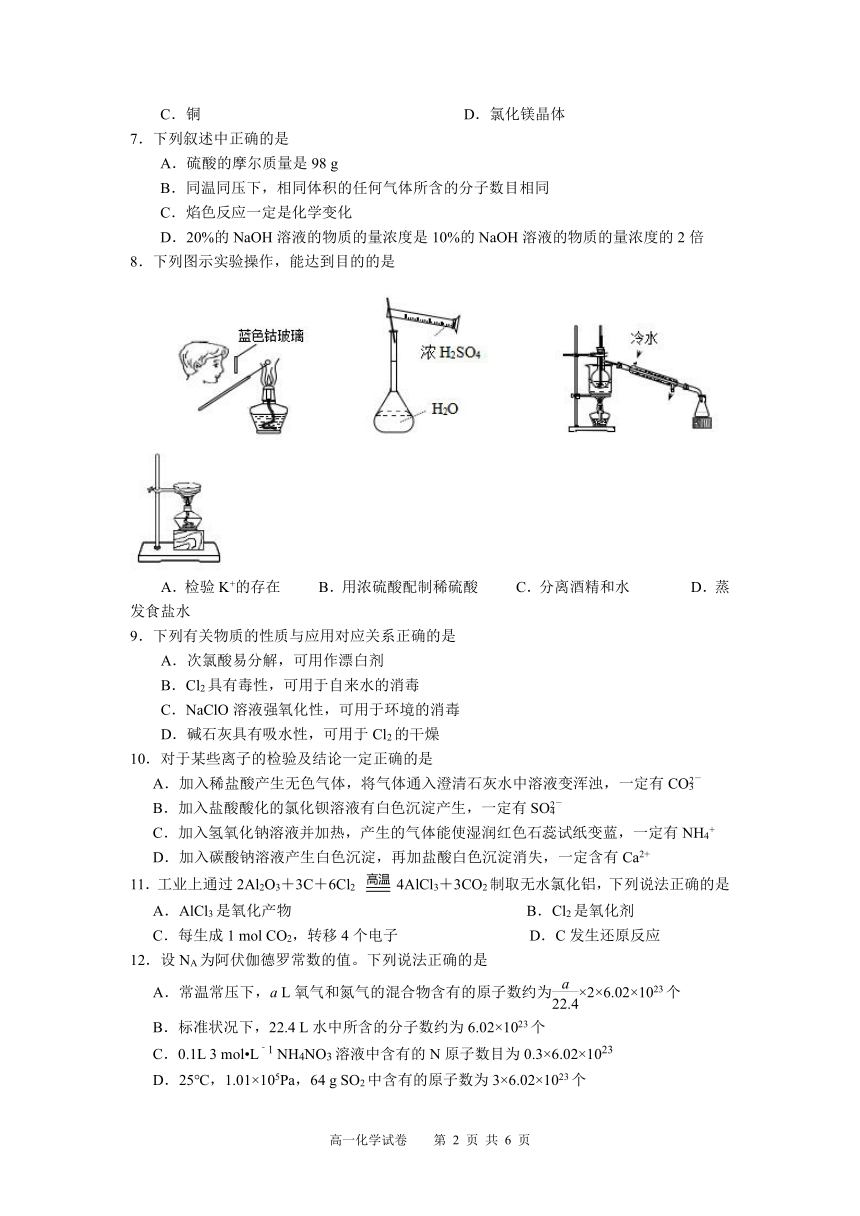
8.下列图示实验操作,能达到目的的是
A.检验K+的存在 B.用浓硫酸配制稀硫酸 C.分离酒精和水 D.蒸发食盐水
9.下列有关物质的性质与应用对应关系正确的是
A.次氯酸易分解,可用作漂白剂
B.Cl2具有毒性,可用于自来水的消毒
C.NaClO溶液强氧化性,可用于环境的消毒
D.碱石灰具有吸水性,可用于Cl2的干燥
10.对于某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中溶液变浑浊,一定有CO
B.加入盐酸酸化的氯化钡溶液有白色沉淀产生,一定有SO
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定含有Ca2+
11.工业上通过2Al2O3+3C+6Cl2 4AlCl3+3CO2制取无水氯化铝,下列说法正确的是
A.AlCl3是氧化产物 B.Cl2是氧化剂
C.每生成1 mol CO2,转移4个电子 D.C发生还原反应
12.设NA为阿伏伽德罗常数的值。下列说法正确的是
A.常温常压下,a L氧气和氮气的混合物含有的原子数约为×2×6.02×1023个
B.标准状况下,22.4 L水中所含的分子数约为6.02×1023个
C.0.1L 3 mol L﹣1 NH4NO3溶液中含有的N原子数目为0.3×6.02×1023
D.25℃,1.01×105Pa,64 g SO2中含有的原子数为3×6.02×1023个
13.下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)
选项 待提纯的物质 选用的试剂 操作方法
A NaCl(Na2CO3) 盐酸 蒸发结晶
B KCl(MgCl2) NaOH 过滤
C NaCl(I2) 乙醇 萃取分液
D KNO3(KCl) 水 溶解、过滤、蒸发结晶
14. 有BaCl2和NaCl的混合溶液a L,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl— 完全沉淀。反应中消耗x molH2SO4、y molAgNO3。据此得知原混合溶液中c(Na+)为
A. mol·L—1 B. mol·L—1
C. mol·L—1 D. mol·L—1
非 选 择 题(共58分)
15.(16分)按要求回答下列问题:
(1)可用 ▲ 效应区别FeCl3溶液和Fe(OH)3胶体。
(2)新制氯水在阳光照射下产生的无色气体是 ▲ (填名称)。
(3)用四氯化碳萃取溴水后,分液时水层从分液漏斗的 ▲ (填“下口放出”或“上口倒出”)。
(4)工业上制漂白粉的化学方程式为 ▲ 。
(5)等质量的NH3和H2S中,氢原子的个数比是 ▲ 。
(6)将100 mL 2.50 mol/L BaCl2溶液加水稀释至500 mL,所得溶液中Cl-物质的量浓度为 ▲ 。
(7)10.8 g R2O5中氧原子的数目为3.01×1023,则R的摩尔质量为 ▲ 。
(8)某光卤石(KCl·MgCl2·6H2O)中含5.3250 g Cl-,则该光卤石的物质的量为 ▲ 。
16.(12分)“中国芯”的主要原料是高纯单晶硅,反应SiCl4 (g) + 2H2 (g)Si (s) + 4HCl (g)可用于纯硅的制备:
(1)氯元素的一个原子中含18个中子,该氯原子是 ▲ (用化学符号表示)。Si原子的结构示意图是 ▲ 。
(2)反应物SiCl4中硅的化合价是 ▲ ,被氧化的元素是 ▲ (写元素名称)。
(3)用双线桥法表示该反应电子转移的方向和数目:
SiCl4 (g) + 2H2 (g)Si (s) + 4HCl (g)
(4)将反应生成的HCl气体通入到适量水中制取盐酸。若要制取500 mL 1 mol·L-1的盐酸,则需要HCl的体积(标准状况下)是 ▲ 。
17.(14分)二氯化二硫(S2Cl2)是一种常用于橡胶硫化、有机物氯化的试剂,查阅资料:①将干燥的氯气在110~140 ℃间与硫反应,即可得S2Cl2粗品;②有关物质的部分性质如表所示:
物质 熔点/ 沸点/ 化学性质
S 112.8 444.6 略
S2Cl2 -77 137 一种橙黄色的液体,遇水易水解,有淡黄色固体出现,同时产生能使品红溶液褪色的气体;300以上完全分解;S2Cl2 + Cl2 2SCl2 。
设计如图所示实验装置在实验室合成S2Cl2:
回答以下问题:
(1)a的作用是 ▲ 。B中所发生反应的化学方程式为 ▲ 。
(2)C装置的作用是 ▲ 。S2Cl2粗品中可能混有的杂质是 ▲ 。
(3)乙同学发现,该装置中除了E处的温度不能过高外,还有一处重大缺陷需改进,否则会导致S2Cl2的产率大大降低,原因是 ▲ (用化学方程式表示);请简要提出改进方案: ▲ 。
(4)H中的溶液可以选择下列试剂中的 ▲ (填序号)。
①碳酸钠溶液 ②NaOH溶液 ③饱和NaCl溶液
18.(16分)已知:硫代硫酸钠(化学式为Na2S2O3)易溶于水,具有强还原性,其相对分子质量是158。某实验室配制500 mL 0.100 mol·L-1 Na2S2O3溶液,并测定样品中CuSO4·5H2O的纯度:
(1)使用无水硫代硫酸钠进行配制,需要固体的质量是 ▲ 。配制过程中需要的玻璃仪器有玻璃棒、烧杯、胶头滴管和 ▲ 。
(2)配制时使用的蒸馏水需先烧开再冷却,其目的是 ▲ 。
(3)定容时仰视刻度线,则配制得到的Na2S2O3溶液的浓度将 ▲ (填“偏大”、“偏小”或“不变”)。定容时,如果不小心加水超过了刻度线,则处理的方法是 ▲ 。
(4)测定样品CuSO4·5H2O的纯度:准确称取0.5000 g CuSO4·5H2O样品,加入适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀硫酸酸化,以淀粉溶液为指示剂,用0.100 mol·L-1 Na2S2O3溶液反应至终点,消耗Na2S2O3溶液19.20 mL。
过程中发生下列反应:2CuSO4 + 4KI = 2CuI↓+ I2 + 2K2SO4; 2Na2S2O3 + I2 = Na2S4O6 + 2NaI
计算CuSO4·5H2O样品的纯度(纯度 =,写出计算过程)。
扬州市邗江区2021-2022学年高一上学期期中考试
化学参考答案与评分建议
选 择 题 (共42分)
单项选择题(本题包括14小题,每题3分,共42分。每小题只有一个选项符合题意)
1 2 3 4 5 6 7 8 9 10 11 12 13 14
A C B B C D B A C C B D A A
非 选 择 题(共58分)
15.(16分)(每空2分)
(1)丁达尔 (2)氧气
(3)上口倒出 (4)2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
(5)3:1 (6)1 mol/L
(7)14 g/mol (8)0.05 mol
16.(12分)(每空2分)
(1)
(2)+4 氢元素
(4)11.2 L
17.(14分)(每空2分)
(1)平衡压强,使液体顺利滴下 MnO2 + 4HCl(浓) MnCl2 + Cl2 ↑+ 2H2O
(2)除去Cl2中的HCl S、SCl2、Cl2 (写对一个得1分,写对两个得2分)
(3)2S2Cl2 + 2H2O = 3S↓ + SO2↑ + 4HCl 在G和H之间之间增加干燥装置
(4)①②
18.(16分)(每空2分)
(1)7.9 g 500 mL容量瓶
(2)除去水中的溶解氧,防止硫代硫酸钠被氧化
(3)偏大 重新配制
(4)
解: n(Na2S2O3) = c(Na2S2O3)·V(Na2S2O3)
=0.100 mol·L-1×0.0192 L
=0.00192 mol 2分
2CuSO4 ~ I2 ~ 2Na2S2O3
2 2
n(CuSO4) 0.00192 mol
n(CuSO4) =0.00192 mol
n(CuSO4·5H2O) =n(CuSO4) =0.00192 mol 2分
m(CuSO4·5H2O) = n (CuSO4·5H2O) ·M(CuSO4·5H2O)
= 0.00192 mol×250g/mol
=0.48 g 1分
该CuSO4·5H2O样品的纯度=×100%
=96% 1分
(其他合理答案也给分)
▲
注 意 事 项
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共6页,包含选择题[第1题~第14题,共42分]、非选择题[第15题~第18题,共58分]两部分。本次考试时间为75分钟,满分100分。考试结束后,请将答题卡交回。
2.答题前,请考生务必将自己的学校、班级、姓名、学号、考生号、座位号用0.5毫米的黑色签字笔写在答题卡上相应的位置,并贴上条形码。
3.选择题每小题选出答案后,请用2B铅笔在答题纸指定区域填涂,如需改动,用橡皮擦干净后,再填涂其它答案。非选择题请用0.5毫米的黑色签字笔在答题纸指定区域作答。在试卷或草稿纸上作答一律无效。
4.如有作图需要,可用2B铅笔作答,并请加黑加粗,描写清楚。
高一化学试卷 第 1 页 共 3 页
化学 2021.11
可能用到的相对原子质量:H-1 C-12 N-14 O-16 S-32 Na-23 Mg-24 Cl-35.5 Cu-64
选 择 题 (共42分)
单项选择题(本题包括14小题,每题3分,共42分。每小题只有一个选项符合题意。)
1.我国力争在2060年前实现“碳中和”,体现了中国对解决气候问题的大国担当。下列措施对实现“碳中和”不具有直接贡献的是
A. 推行生活垃圾分类 B. 植树造林增加绿色植被
C. 采取节能低碳生活方式 D. 创新CO2转化为碳燃料的技术
2.重铬酸钾(K2Cr2O7)是一种重要的着色剂、强氧化剂。它属于
A.酸 B.碱 C.盐 D.氧化物
3.下列化学用语使用正确的是
A.硝酸钡的化学式:BaNO3 B.钠离子的结构示意图:
C.质子数为6,中子数为8的微粒: D.NaHCO3电离:NaHCO3=Na++H++CO32-
4.下列反应既是化合反应,又是氧化还原反应的是
A.CaO+H2O=Ca(OH)2 B.2CO+O22CO2
C.C+H2OCO+H2 D.CO2+ Ca(OH)2=CaCO3↓+H2O
5.在盛放酒精的试剂瓶的标签上应印有的警示标志是
6.下列物质中属于电解质的是
A.氯化钠溶液 B.乙醇
C.铜 D.氯化镁晶体
7.下列叙述中正确的是
A.硫酸的摩尔质量是98 g
B.同温同压下,相同体积的任何气体所含的分子数目相同
C.焰色反应一定是化学变化
D.20%的NaOH溶液的物质的量浓度是10%的NaOH溶液的物质的量浓度的2倍
8.下列图示实验操作,能达到目的的是
A.检验K+的存在 B.用浓硫酸配制稀硫酸 C.分离酒精和水 D.蒸发食盐水
9.下列有关物质的性质与应用对应关系正确的是
A.次氯酸易分解,可用作漂白剂
B.Cl2具有毒性,可用于自来水的消毒
C.NaClO溶液强氧化性,可用于环境的消毒
D.碱石灰具有吸水性,可用于Cl2的干燥
10.对于某些离子的检验及结论一定正确的是
A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中溶液变浑浊,一定有CO
B.加入盐酸酸化的氯化钡溶液有白色沉淀产生,一定有SO
C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+
D.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定含有Ca2+
11.工业上通过2Al2O3+3C+6Cl2 4AlCl3+3CO2制取无水氯化铝,下列说法正确的是
A.AlCl3是氧化产物 B.Cl2是氧化剂
C.每生成1 mol CO2,转移4个电子 D.C发生还原反应
12.设NA为阿伏伽德罗常数的值。下列说法正确的是
A.常温常压下,a L氧气和氮气的混合物含有的原子数约为×2×6.02×1023个
B.标准状况下,22.4 L水中所含的分子数约为6.02×1023个
C.0.1L 3 mol L﹣1 NH4NO3溶液中含有的N原子数目为0.3×6.02×1023
D.25℃,1.01×105Pa,64 g SO2中含有的原子数为3×6.02×1023个
13.下列除杂所选用的试剂及操作方法均正确的一组是(括号内为杂质)
选项 待提纯的物质 选用的试剂 操作方法
A NaCl(Na2CO3) 盐酸 蒸发结晶
B KCl(MgCl2) NaOH 过滤
C NaCl(I2) 乙醇 萃取分液
D KNO3(KCl) 水 溶解、过滤、蒸发结晶
14. 有BaCl2和NaCl的混合溶液a L,将它分成两等份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl— 完全沉淀。反应中消耗x molH2SO4、y molAgNO3。据此得知原混合溶液中c(Na+)为
A. mol·L—1 B. mol·L—1
C. mol·L—1 D. mol·L—1
非 选 择 题(共58分)
15.(16分)按要求回答下列问题:
(1)可用 ▲ 效应区别FeCl3溶液和Fe(OH)3胶体。
(2)新制氯水在阳光照射下产生的无色气体是 ▲ (填名称)。
(3)用四氯化碳萃取溴水后,分液时水层从分液漏斗的 ▲ (填“下口放出”或“上口倒出”)。
(4)工业上制漂白粉的化学方程式为 ▲ 。
(5)等质量的NH3和H2S中,氢原子的个数比是 ▲ 。
(6)将100 mL 2.50 mol/L BaCl2溶液加水稀释至500 mL,所得溶液中Cl-物质的量浓度为 ▲ 。
(7)10.8 g R2O5中氧原子的数目为3.01×1023,则R的摩尔质量为 ▲ 。
(8)某光卤石(KCl·MgCl2·6H2O)中含5.3250 g Cl-,则该光卤石的物质的量为 ▲ 。
16.(12分)“中国芯”的主要原料是高纯单晶硅,反应SiCl4 (g) + 2H2 (g)Si (s) + 4HCl (g)可用于纯硅的制备:
(1)氯元素的一个原子中含18个中子,该氯原子是 ▲ (用化学符号表示)。Si原子的结构示意图是 ▲ 。
(2)反应物SiCl4中硅的化合价是 ▲ ,被氧化的元素是 ▲ (写元素名称)。
(3)用双线桥法表示该反应电子转移的方向和数目:
SiCl4 (g) + 2H2 (g)Si (s) + 4HCl (g)
(4)将反应生成的HCl气体通入到适量水中制取盐酸。若要制取500 mL 1 mol·L-1的盐酸,则需要HCl的体积(标准状况下)是 ▲ 。
17.(14分)二氯化二硫(S2Cl2)是一种常用于橡胶硫化、有机物氯化的试剂,查阅资料:①将干燥的氯气在110~140 ℃间与硫反应,即可得S2Cl2粗品;②有关物质的部分性质如表所示:
物质 熔点/ 沸点/ 化学性质
S 112.8 444.6 略
S2Cl2 -77 137 一种橙黄色的液体,遇水易水解,有淡黄色固体出现,同时产生能使品红溶液褪色的气体;300以上完全分解;S2Cl2 + Cl2 2SCl2 。
设计如图所示实验装置在实验室合成S2Cl2:
回答以下问题:
(1)a的作用是 ▲ 。B中所发生反应的化学方程式为 ▲ 。
(2)C装置的作用是 ▲ 。S2Cl2粗品中可能混有的杂质是 ▲ 。
(3)乙同学发现,该装置中除了E处的温度不能过高外,还有一处重大缺陷需改进,否则会导致S2Cl2的产率大大降低,原因是 ▲ (用化学方程式表示);请简要提出改进方案: ▲ 。
(4)H中的溶液可以选择下列试剂中的 ▲ (填序号)。
①碳酸钠溶液 ②NaOH溶液 ③饱和NaCl溶液
18.(16分)已知:硫代硫酸钠(化学式为Na2S2O3)易溶于水,具有强还原性,其相对分子质量是158。某实验室配制500 mL 0.100 mol·L-1 Na2S2O3溶液,并测定样品中CuSO4·5H2O的纯度:
(1)使用无水硫代硫酸钠进行配制,需要固体的质量是 ▲ 。配制过程中需要的玻璃仪器有玻璃棒、烧杯、胶头滴管和 ▲ 。
(2)配制时使用的蒸馏水需先烧开再冷却,其目的是 ▲ 。
(3)定容时仰视刻度线,则配制得到的Na2S2O3溶液的浓度将 ▲ (填“偏大”、“偏小”或“不变”)。定容时,如果不小心加水超过了刻度线,则处理的方法是 ▲ 。
(4)测定样品CuSO4·5H2O的纯度:准确称取0.5000 g CuSO4·5H2O样品,加入适量水溶解,转移至碘量瓶中,加过量KI溶液并用稀硫酸酸化,以淀粉溶液为指示剂,用0.100 mol·L-1 Na2S2O3溶液反应至终点,消耗Na2S2O3溶液19.20 mL。
过程中发生下列反应:2CuSO4 + 4KI = 2CuI↓+ I2 + 2K2SO4; 2Na2S2O3 + I2 = Na2S4O6 + 2NaI
计算CuSO4·5H2O样品的纯度(纯度 =,写出计算过程)。
扬州市邗江区2021-2022学年高一上学期期中考试
化学参考答案与评分建议
选 择 题 (共42分)
单项选择题(本题包括14小题,每题3分,共42分。每小题只有一个选项符合题意)
1 2 3 4 5 6 7 8 9 10 11 12 13 14
A C B B C D B A C C B D A A
非 选 择 题(共58分)
15.(16分)(每空2分)
(1)丁达尔 (2)氧气
(3)上口倒出 (4)2Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O
(5)3:1 (6)1 mol/L
(7)14 g/mol (8)0.05 mol
16.(12分)(每空2分)
(1)
(2)+4 氢元素
(4)11.2 L
17.(14分)(每空2分)
(1)平衡压强,使液体顺利滴下 MnO2 + 4HCl(浓) MnCl2 + Cl2 ↑+ 2H2O
(2)除去Cl2中的HCl S、SCl2、Cl2 (写对一个得1分,写对两个得2分)
(3)2S2Cl2 + 2H2O = 3S↓ + SO2↑ + 4HCl 在G和H之间之间增加干燥装置
(4)①②
18.(16分)(每空2分)
(1)7.9 g 500 mL容量瓶
(2)除去水中的溶解氧,防止硫代硫酸钠被氧化
(3)偏大 重新配制
(4)
解: n(Na2S2O3) = c(Na2S2O3)·V(Na2S2O3)
=0.100 mol·L-1×0.0192 L
=0.00192 mol 2分
2CuSO4 ~ I2 ~ 2Na2S2O3
2 2
n(CuSO4) 0.00192 mol
n(CuSO4) =0.00192 mol
n(CuSO4·5H2O) =n(CuSO4) =0.00192 mol 2分
m(CuSO4·5H2O) = n (CuSO4·5H2O) ·M(CuSO4·5H2O)
= 0.00192 mol×250g/mol
=0.48 g 1分
该CuSO4·5H2O样品的纯度=×100%
=96% 1分
(其他合理答案也给分)
▲
注 意 事 项
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共6页,包含选择题[第1题~第14题,共42分]、非选择题[第15题~第18题,共58分]两部分。本次考试时间为75分钟,满分100分。考试结束后,请将答题卡交回。
2.答题前,请考生务必将自己的学校、班级、姓名、学号、考生号、座位号用0.5毫米的黑色签字笔写在答题卡上相应的位置,并贴上条形码。
3.选择题每小题选出答案后,请用2B铅笔在答题纸指定区域填涂,如需改动,用橡皮擦干净后,再填涂其它答案。非选择题请用0.5毫米的黑色签字笔在答题纸指定区域作答。在试卷或草稿纸上作答一律无效。
4.如有作图需要,可用2B铅笔作答,并请加黑加粗,描写清楚。
高一化学试卷 第 1 页 共 3 页
同课章节目录
