鲁教版九年级全册(2012年秋使用)第3节 原子的构成
文档属性
| 名称 | 鲁教版九年级全册(2012年秋使用)第3节 原子的构成 |  | |
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-25 21:10:37 | ||
图片预览







文档简介
(共33张PPT)
第二单元 探秘水世界
第三节 原子的结构
200多年前,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。(他被称为化学之父)
原子并不是构成物质的最小微粒 ——汤姆森发现原子中还有电子(1897年)
汤姆森认为:
电子是一种带负电、有一定质量的微粒,普遍存在于各种原子之中。
提出了新的问题:
原子的内部究竟是什么样呢?
电子就像西瓜子一样
镶嵌在原子中。
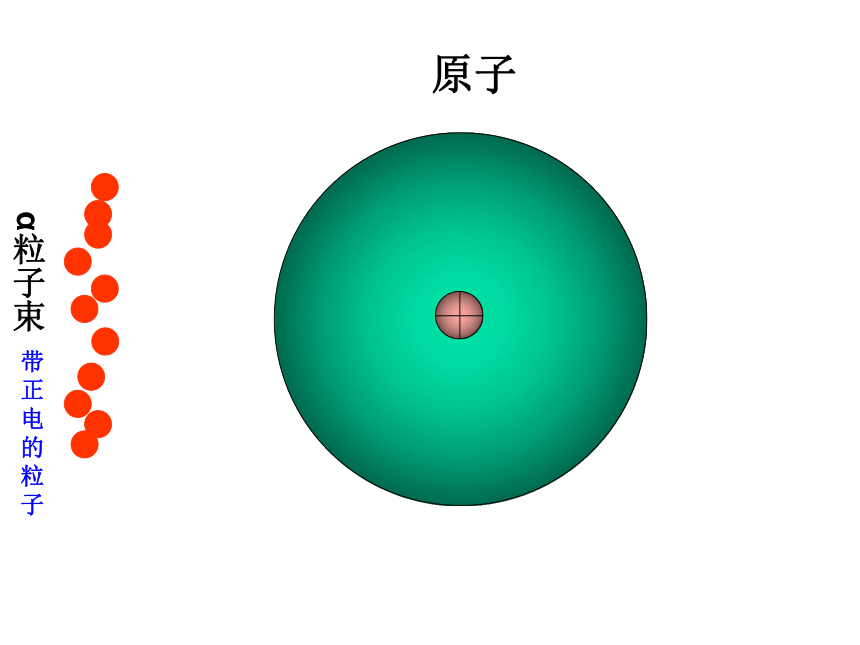
原子
α粒子束
带正电的粒子
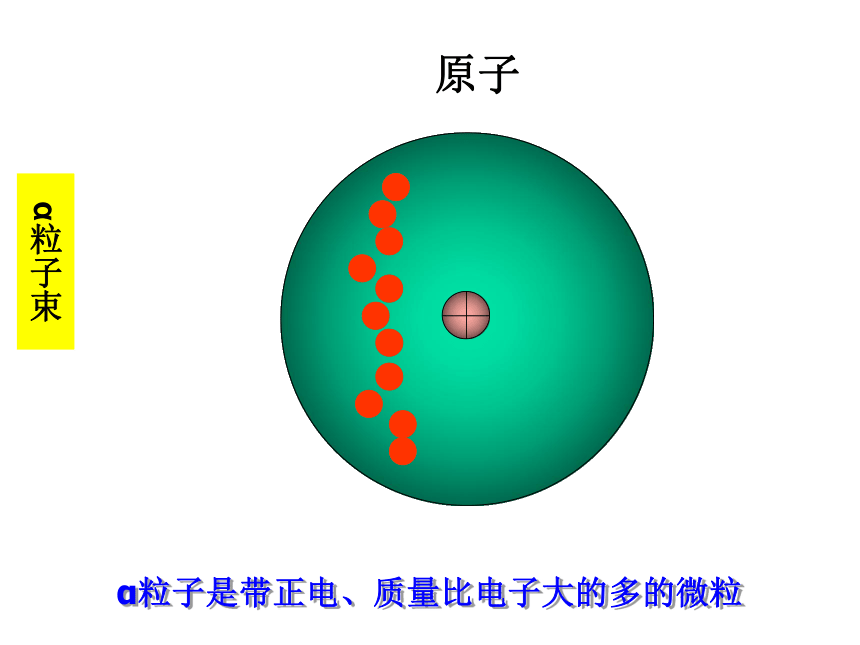
原子
α粒子束
α粒子是带正电、质量比电子大的多的微粒
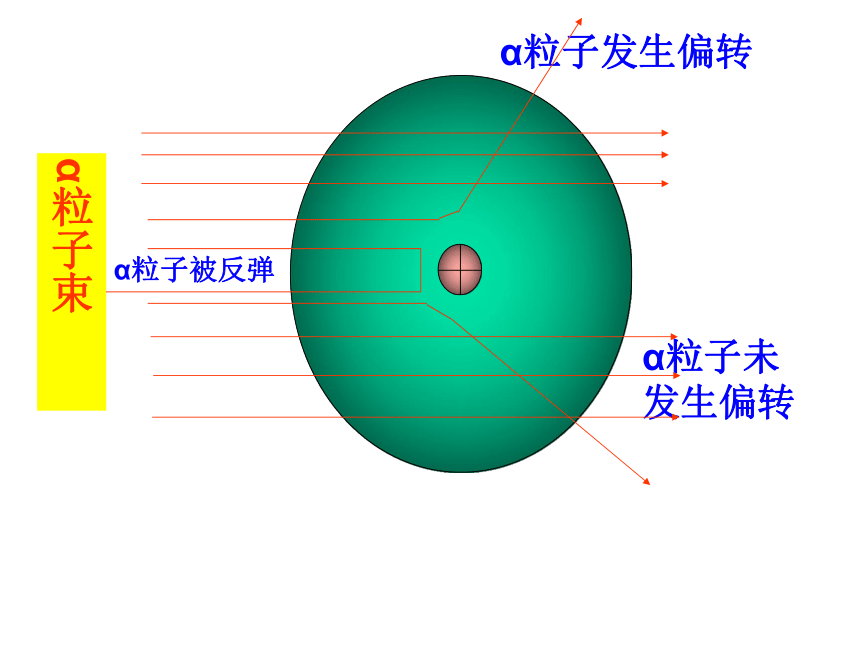
α粒子未发生偏转
α粒子发生偏转
α粒子束
α粒子被反弹
卢瑟福α粒子散射实验
α粒子是带正电的质量比电子大的多
1、大多数α粒子顺利穿透金箔
2、一小部分α粒子改变原来的方向
原子核体积很小,原子内部空间很大
原子核带正电,当带正电的α粒子经过原子核附近时受到排斥而改变方向
3、极少数α粒子被反弹回来
原子核的质量比α粒子大得多,当α粒子正面撞击原子核时, α粒子被反弹回来
假如当时你在现场,你能试着对上述现象加以解释吗?
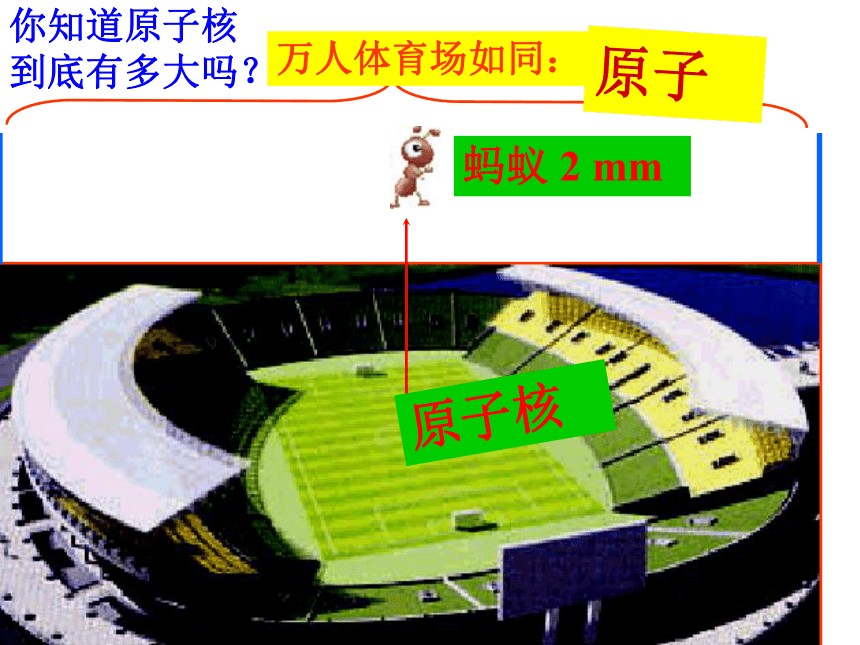
你知道原子核
到底有多大吗?
万人体育场如同:
原子
蚂蚁 2 mm
原子核
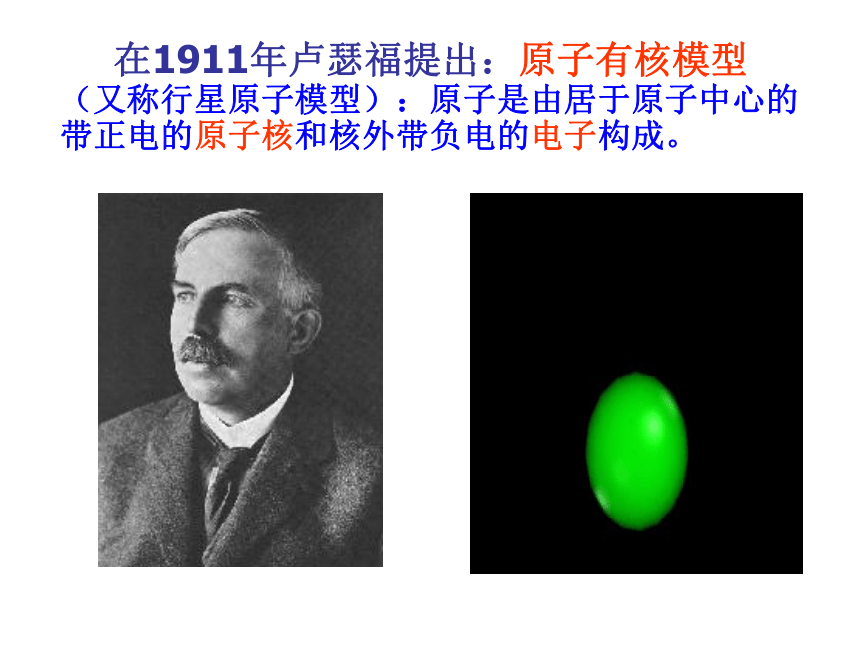
在1911年卢瑟福提出:原子有核模型
(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。
一、原子的结构
原子
原子核(带正电)
核外电子(带负电)
原子核带的正电荷数=核外电子带的负电荷数
(核电荷数) = 核外电子数
原子不显电性
原子核内有什么?
自从发现原子核和电子后,卢瑟福一直在考虑一个问题:能否打开原子核?原子核内究竟有什么?
1919年,卢瑟福和他的助手用α粒子“轰击”了氮原子核等,发现原子核里面有质子,1个质子带1个单位正电荷。1920年,卢瑟福又预言:原子核中有不带电荷的中性粒子。1932年,经过不少科学家的反复实验后确实发现,α粒子打在铍原子核上,产生了一种高速的不显电性的中性粒子,他们将其命名为中子。中子的质量与质子的质量几乎相等。卢瑟福的预言再一次被证实了。实验证明,原子核确实可以再分为质子和中子。
原子弹的爆炸是由原子核的裂变,释放出巨大的能量引起的.
原子核的构成:
质子
中子
原子
原子核
核外电子
1个质子带一个单位正电荷
1个电子带一个单位负电荷
不带电
在原子中:核电荷数=核内质子数=核外电子数
粒子种类 质量(kg)
质子 =1.6726×10-27
中子 =1.6749×10-27
电子 =质子质量的1/1836
原子的质量几乎全部集中在原子核上
根据表格你得到什么启示?
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
镁 12 12 12
氯 17 18 17
铁 26 30 26
观察表格,你发现了哪些规律?
二、电子的分层排布:
电子层
电子层 第一层 第二层 第三层 ……
离核远近
能量高低
近
低
远
高
一个氧原子的原子核内有8个质子和8个中子。核外有8个电子,其中有2个电子能量相近都较低,另外6个电子能量相近且能量稍高。这些电子都同时绕原子核高速运动。
根据刚才的理解,请你把氧原子的结构以
最简洁的方式画出来。
资料介绍:
2
+8
6
原子核
质子数
该层电子数
原子结构示意图表示的意义
氧原 子 结 构 示 意 图:
第一层
第二层(最外层)
学以致用:
资料介绍:一个镁原子核内有12个质子,它的原子核外有12个电子,其中有2个电子能量相近都较低且离核最近,8个电子能量略高且离核稍远,还有2个电子能量最高且离核最远。这些电子都同时绕镁的原子核运动。
2
2
8
+12
Mg
镁
原子结构示意图
提示:原子的最外层电子数等于 8 的时候,最稳定。
故事分析:
有一天,你和你的好朋友一起去买书,当时你有11元钱,而她有9元钱,你们俩都选中了一样的书,如果那本书是10元钱,你会怎么办呢?
氧化镁的形成:
在化学世界里,原子之间也会发扬互帮互助的精神的。
2
2
8
+12
Mg
镁原子
2
6
+8
O 氧
原子
氧化镁的形成
Mg2+
O2-
2
2
8
+12
Mg镁
原子
+12
2
8
Mg2+
镁离子
2
6
+8
O 氧
原子
2
8
+8
O2-
氧离子
提示:原子的最外层电子数等于 8 的时候,最稳定。
失去两个电子
得到两个电子
2
7
8
+17
2
1
8
+11
+11
2
8
2
8
8
+17
钠原子(Na)
氯原子(Cl )
钠离子( )
氯离子( )
失去一
个电子
得到一
个电子
Na+
Cl-
食盐氯化钠的形成过程
NaCl
原子结构示意图
金属原子
非金属原子
请将以下原子进行分类,并说出分类的依据。
分析各类原子的最外层电子数,分析它们的特点
稀有气体
元 素 最外 层 电 子 数 原子
结 构 变 化
趋 势
化学性 质
稀 有 气 体
金 属
非 金属
8个(氦 为2个 )
稳 定 结 构
稳 定
稳 定
一般
﹤ 4 个
不稳 定 结 构
易 失 去 电 子
活 泼
一 般≥4 个
不 稳 定 结 构
易 获 得 电 子
活 泼
三、 原子最外电子数与结构、性质的关系:
最外层电子数 决定 原子的化学性质
原子
原子核
核外电子(带负电)
质子(带正电)
中子(不带电)
不显电性
1、在原子中 核电荷数=核内质子数=核外电子数
原子的构成
2、不同的原子,质子数(核电荷数)不同
3、原子的质量主要集中在原子核上
清点收获:
通过以上学习,你对原子中的电子有哪些新的认识?
1、电子是有能量的。
2、电子是分层排布的
3、电子决定原子的体积大小。
4、最外层电子数决定得失电子的数值。
5、电子决定原子在化学变化中的表现。
……
构成物质的一种新微粒:离子
(1)离子:
(2)分类:
阳离子
阴离子
(3)表示:
(4)离子是构成物质的一种粒子。
离子符号 Na+ Cl-
离子结构示意图
+17
2
8
8
氯化钠(NaCl)是由 和
构成的。
带电的原子
(带正电荷的离子)如:Na+
(带负电荷的离子)如:Cl-
钠离子(Na+)
氯离子( Cl- )
反思总结:
通过以上探究,你对原子的构成还有哪些疑问?
对于科学家们研究原子构成的过程与所用方法,你受到哪些启发?
和同学们交流一下吧!
结合本节课的学习,如果你是氧原子中的一个电子,请你描述一下你在原子大家庭里的见闻。
我们从洪荒中走来,
祖先没有给我们飞翔的翅膀。
我们从平凡中走来,
命运没有给我们辉煌的门第。
但是——
我们有雄鹰搏击长空的梦想,
我们有夸父逐日的宏图大志。
智慧是我们翱翔蓝天的翅膀,
世纪中学是我们腾飞的起点。
我们从大浪中走来,
时代没有给我们避风的港湾。
我们从风雨中走来,
上苍没有给我们遮天的广宇。
但是——
我们有扬帆远航的豪情,
我们有撑起晴空的壮志。
创新是我们书海远航的动力,
进取是我们同舟共济的旗帜。
祝愿:同学们,每天快乐地学习。快乐地探究。在快乐中成长!
第二单元 探秘水世界
第三节 原子的结构
200多年前,英国科学家道尔顿提出近代原子学说,他认为原子是微小的不可分割的实心球体。(他被称为化学之父)
原子并不是构成物质的最小微粒 ——汤姆森发现原子中还有电子(1897年)
汤姆森认为:
电子是一种带负电、有一定质量的微粒,普遍存在于各种原子之中。
提出了新的问题:
原子的内部究竟是什么样呢?
电子就像西瓜子一样
镶嵌在原子中。
原子
α粒子束
带正电的粒子
原子
α粒子束
α粒子是带正电、质量比电子大的多的微粒
α粒子未发生偏转
α粒子发生偏转
α粒子束
α粒子被反弹
卢瑟福α粒子散射实验
α粒子是带正电的质量比电子大的多
1、大多数α粒子顺利穿透金箔
2、一小部分α粒子改变原来的方向
原子核体积很小,原子内部空间很大
原子核带正电,当带正电的α粒子经过原子核附近时受到排斥而改变方向
3、极少数α粒子被反弹回来
原子核的质量比α粒子大得多,当α粒子正面撞击原子核时, α粒子被反弹回来
假如当时你在现场,你能试着对上述现象加以解释吗?
你知道原子核
到底有多大吗?
万人体育场如同:
原子
蚂蚁 2 mm
原子核
在1911年卢瑟福提出:原子有核模型
(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。
一、原子的结构
原子
原子核(带正电)
核外电子(带负电)
原子核带的正电荷数=核外电子带的负电荷数
(核电荷数) = 核外电子数
原子不显电性
原子核内有什么?
自从发现原子核和电子后,卢瑟福一直在考虑一个问题:能否打开原子核?原子核内究竟有什么?
1919年,卢瑟福和他的助手用α粒子“轰击”了氮原子核等,发现原子核里面有质子,1个质子带1个单位正电荷。1920年,卢瑟福又预言:原子核中有不带电荷的中性粒子。1932年,经过不少科学家的反复实验后确实发现,α粒子打在铍原子核上,产生了一种高速的不显电性的中性粒子,他们将其命名为中子。中子的质量与质子的质量几乎相等。卢瑟福的预言再一次被证实了。实验证明,原子核确实可以再分为质子和中子。
原子弹的爆炸是由原子核的裂变,释放出巨大的能量引起的.
原子核的构成:
质子
中子
原子
原子核
核外电子
1个质子带一个单位正电荷
1个电子带一个单位负电荷
不带电
在原子中:核电荷数=核内质子数=核外电子数
粒子种类 质量(kg)
质子 =1.6726×10-27
中子 =1.6749×10-27
电子 =质子质量的1/1836
原子的质量几乎全部集中在原子核上
根据表格你得到什么启示?
原子种类 质子数 中子数 核外电子数
氢 1 0 1
碳 6 6 6
氧 8 8 8
钠 11 12 11
镁 12 12 12
氯 17 18 17
铁 26 30 26
观察表格,你发现了哪些规律?
二、电子的分层排布:
电子层
电子层 第一层 第二层 第三层 ……
离核远近
能量高低
近
低
远
高
一个氧原子的原子核内有8个质子和8个中子。核外有8个电子,其中有2个电子能量相近都较低,另外6个电子能量相近且能量稍高。这些电子都同时绕原子核高速运动。
根据刚才的理解,请你把氧原子的结构以
最简洁的方式画出来。
资料介绍:
2
+8
6
原子核
质子数
该层电子数
原子结构示意图表示的意义
氧原 子 结 构 示 意 图:
第一层
第二层(最外层)
学以致用:
资料介绍:一个镁原子核内有12个质子,它的原子核外有12个电子,其中有2个电子能量相近都较低且离核最近,8个电子能量略高且离核稍远,还有2个电子能量最高且离核最远。这些电子都同时绕镁的原子核运动。
2
2
8
+12
Mg
镁
原子结构示意图
提示:原子的最外层电子数等于 8 的时候,最稳定。
故事分析:
有一天,你和你的好朋友一起去买书,当时你有11元钱,而她有9元钱,你们俩都选中了一样的书,如果那本书是10元钱,你会怎么办呢?
氧化镁的形成:
在化学世界里,原子之间也会发扬互帮互助的精神的。
2
2
8
+12
Mg
镁原子
2
6
+8
O 氧
原子
氧化镁的形成
Mg2+
O2-
2
2
8
+12
Mg镁
原子
+12
2
8
Mg2+
镁离子
2
6
+8
O 氧
原子
2
8
+8
O2-
氧离子
提示:原子的最外层电子数等于 8 的时候,最稳定。
失去两个电子
得到两个电子
2
7
8
+17
2
1
8
+11
+11
2
8
2
8
8
+17
钠原子(Na)
氯原子(Cl )
钠离子( )
氯离子( )
失去一
个电子
得到一
个电子
Na+
Cl-
食盐氯化钠的形成过程
NaCl
原子结构示意图
金属原子
非金属原子
请将以下原子进行分类,并说出分类的依据。
分析各类原子的最外层电子数,分析它们的特点
稀有气体
元 素 最外 层 电 子 数 原子
结 构 变 化
趋 势
化学性 质
稀 有 气 体
金 属
非 金属
8个(氦 为2个 )
稳 定 结 构
稳 定
稳 定
一般
﹤ 4 个
不稳 定 结 构
易 失 去 电 子
活 泼
一 般≥4 个
不 稳 定 结 构
易 获 得 电 子
活 泼
三、 原子最外电子数与结构、性质的关系:
最外层电子数 决定 原子的化学性质
原子
原子核
核外电子(带负电)
质子(带正电)
中子(不带电)
不显电性
1、在原子中 核电荷数=核内质子数=核外电子数
原子的构成
2、不同的原子,质子数(核电荷数)不同
3、原子的质量主要集中在原子核上
清点收获:
通过以上学习,你对原子中的电子有哪些新的认识?
1、电子是有能量的。
2、电子是分层排布的
3、电子决定原子的体积大小。
4、最外层电子数决定得失电子的数值。
5、电子决定原子在化学变化中的表现。
……
构成物质的一种新微粒:离子
(1)离子:
(2)分类:
阳离子
阴离子
(3)表示:
(4)离子是构成物质的一种粒子。
离子符号 Na+ Cl-
离子结构示意图
+17
2
8
8
氯化钠(NaCl)是由 和
构成的。
带电的原子
(带正电荷的离子)如:Na+
(带负电荷的离子)如:Cl-
钠离子(Na+)
氯离子( Cl- )
反思总结:
通过以上探究,你对原子的构成还有哪些疑问?
对于科学家们研究原子构成的过程与所用方法,你受到哪些启发?
和同学们交流一下吧!
结合本节课的学习,如果你是氧原子中的一个电子,请你描述一下你在原子大家庭里的见闻。
我们从洪荒中走来,
祖先没有给我们飞翔的翅膀。
我们从平凡中走来,
命运没有给我们辉煌的门第。
但是——
我们有雄鹰搏击长空的梦想,
我们有夸父逐日的宏图大志。
智慧是我们翱翔蓝天的翅膀,
世纪中学是我们腾飞的起点。
我们从大浪中走来,
时代没有给我们避风的港湾。
我们从风雨中走来,
上苍没有给我们遮天的广宇。
但是——
我们有扬帆远航的豪情,
我们有撑起晴空的壮志。
创新是我们书海远航的动力,
进取是我们同舟共济的旗帜。
祝愿:同学们,每天快乐地学习。快乐地探究。在快乐中成长!
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
