1.2__混合物的分离和提纯
文档属性
| 名称 | 1.2__混合物的分离和提纯 |  | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-09-26 13:39:13 | ||
图片预览






文档简介
(共28张PPT)
混合物的分离和提纯
蒸馏——物质的分离和提纯方法之三
蒸馏
原理:利用液体混合物中各物质的沸点不同,用加热的方法将沸点低的物质变成气态挥发分离出来。用蒸馏原理进行多种混合液的分离,叫分馏。
对于液态混合物的分离和提纯,可用蒸馏和萃取的方法。
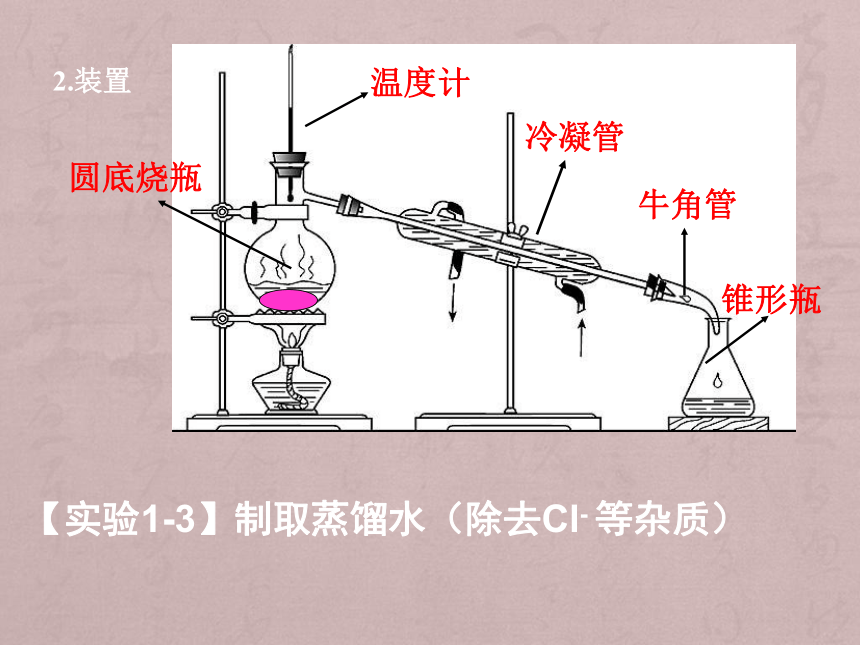
2.装置
冷凝管
圆底烧瓶
牛角管
锥形瓶
温度计
【实验1-3】制取蒸馏水(除去Cl- 等杂质)
[注意事项]
①所盛液体不超过蒸馏瓶球部容积的 2/3,也不能少于1/3 ,加热时,不能将液体蒸干。
②温度计的水银球应位于蒸馏烧瓶的支管口下沿。
③蒸馏瓶内要加几粒沸石或碎瓷片,防止液体暴沸。
④冷凝管中通冷却水时,下口( ),
上口( )。
进水
出水
⑤加热温度不能超过混合物中沸点最高物质的沸点。
[问题]
①温度计作用?
②产物收集方式?
③自来水蒸馏后蒸馏
烧瓶内物质?
控温显示加热范围。
但制取蒸馏水时可以不用温度计。
冷凝收集
在100℃难于挥发的杂质。
实验步骤 现象
1、在试管中加入少量自来水,滴入几滴AgNO3(硝酸银)溶液和几滴稀硝酸。
2、在烧瓶中加入约2/3体积的自来水,再加入几粒沸石,按图1-4连接好装置,向冷凝管中通入冷却水。加热烧瓶,弃去开始馏出的部分液体,用锥形瓶收集约10mL液体,停止加热。
3、取少量蒸馏出的液体加入试管中,然后加入几滴AgNO3溶液和几滴稀硝酸。(得到的液体中含有Cl-吗?)
加AgNO3后有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,证明样品含有Cl-
烧瓶中的水变成水蒸气,水蒸气经过冷凝管后变成液态水,流到锥形瓶里。
加AgNO3和稀硝酸,没有白色沉淀生成,说明经蒸馏冷凝后得到的液体没有Cl-
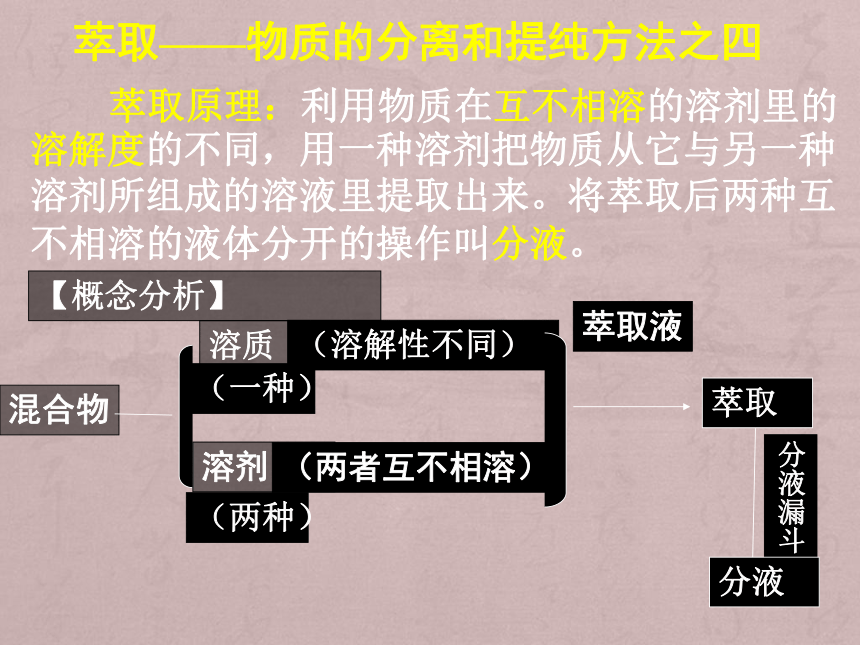
萃取原理:利用物质在互不相溶的溶剂里的溶解度的不同,用一种溶剂把物质从它与另一种溶剂所组成的溶液里提取出来。将萃取后两种互不相溶的液体分开的操作叫分液。
【概念分析】
混合物
溶质
溶剂
(一种)
(两种)
(溶解性不同)
(两者互不相溶)
萃取液
萃取
分液漏斗
分液
萃取——物质的分离和提纯方法之四
注意事项
萃取剂的选择条件:
1.萃取剂与原溶液中的溶剂互不相溶。
如:Ccl4与H2O互不相溶
2.萃取剂与原溶液中的溶质互不反应。
如:Ccl4不与I2反应
3.溶质在两溶剂中的溶解度要有较大的差别(在萃取剂中的溶解度大)
如:Ccl4(I2)>H2O (I2)
4、两种溶剂的密度要有差异。
如:ρ水> ρ苯; ρ(ccl4)> ρ水;
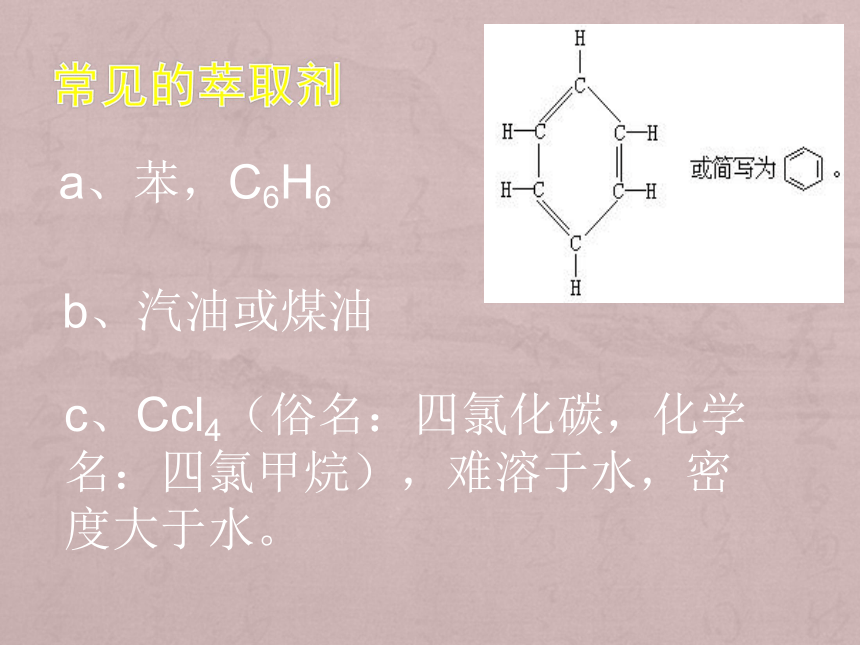
a、苯,C6H6
b、汽油或煤油
c、Ccl4(俗名:四氯化碳,化学名:四氯甲烷),难溶于水,密度大于水。
仪器介绍
分液漏斗
分液漏斗——用于分离互不相溶的液体。
普通漏斗
长颈漏斗
【分液漏斗使用注意事项】
1、使用前检查上口和活塞是否漏水。
2、加入萃取液后要先倒转分液漏斗用力
振荡,再静置。
3、分液时,分液漏斗下端紧贴烧杯内壁,当
分液漏斗内的下层液体恰好流尽时,要立
即关闭分液漏斗的活塞,防止上层液体流出。
要将上层液体由上口倒出。
1.分液漏斗使用之前要检验是否漏水,如何检验?
2.为何要振荡?振荡过程中还有一步什么操作?
3.静置分层之后,为什么要打开上口的玻璃塞?液体分别是如何倒出的?
1.
2.使液体充分混合;打开活塞,放出产生的气体。
3.使漏斗内外压强相等,便于液体流出。
下层液体从下端放出,上层液体从上口倒出。
【实验1-4 】用Ccl4萃取碘水(饱和)中的 I2
现象:
液体分层
上层液体显( )色
下层液体显( )色
浅黄
紫
(详细步骤见教材)
仪器:分液漏斗,带铁圈的铁架台,烧杯
碘水与CCl4刚刚混合
静置以后
用力振荡
为什么会出现颜色的转变?
I2从原先的水层中转移到了CCl4中。
【分析讨论】
1、上层液体中的溶剂是( ),下层液体
中溶剂是( )
2、碘单质(I2)在哪种溶剂中的溶解度大?
3、 Ccl4与H2O比较有何异同?
H2O
Ccl4
四氯化碳(Ccl4)
都能溶解碘单质( I2);都不与
碘单质( I2)反应。
异:
Ccl4与H2O互不相溶;碘单质在Ccl4中的溶解度大。
同:
[ 思考与讨论]
1、根据实验1-4分析,请分总结CCl4性质?
2、将实验1-4中的萃取剂换为酒精是否可以?
请说明原因。
①无色液体,不溶于H2O
②ρ(CCl4)>ρ(H2O)
不可以,酒精与水互溶。
【小结】
分离提纯方法 原理 实例
过滤 固体与液体不互溶的混合物 粗盐的提纯
结晶 混合物中各成分在溶剂中溶解度不同,包括蒸发溶剂结晶和降温结晶 海水晒盐
KCl和KNO3混合物的分离
分液 两种溶剂互不混溶 CCl4和水的分离
萃取 溶质在互不相溶的溶剂里溶解度不同 利用CCl4从溴水中萃取溴
蒸馏 液体混合物中各成分的沸点不同 分离乙醇和醋酸
物质的分离和提纯
方法 适用范围 装置 注意事项
过滤 从液体中分离出不溶的固体物质 注意事项:
1、“一贴二低三靠”
2、必要时洗涤沉淀物
蒸发 获得溶液中的溶质(分离溶剂和溶质) 1、溶质稳定
2、不断搅拌
3、余热蒸干
方法 适用范围 装置 注意事项
蒸馏 分离沸点不同而又相溶的液态混合物(分离固液混合物) 1、温度计水银球的位置
2、加沸石
3、冷凝水进出口
4、不可蒸干
萃取 溶质在两种互不相溶的溶剂里溶解度的不同 1、互不相溶
2、互不反应
3、溶解度要有差异
4、密度要有差异
现需要分离下列物质,请用直线将分离实例、分离方法和选择分离方法的依据连接起来。
实 例 分离方法 选择的依据
除去澄清石灰水中的碳酸钙 蒸馏 溶解度随温度变化的差异
用CCl4提取溴水中溴单质 过滤 在不同溶剂中溶解度的差异
分离醋酸 与 乙醇 分液 沸点的差异较大
(沸点118℃) (沸点78.5℃)
分离汽油和水 结晶 两溶剂互不相溶
从含有氯化钠的硝酸钾溶液中 萃取 物质在水中溶解度的不同
提取硝酸钾
B
课堂练习
B
B
B
化学与生活
为什么双氧水能用于伤口消毒:
双氧水的学名叫过氧化氢,是无色有刺激性气味的液体,医疗上常用质量分数为3%的双氧水对伤口消毒。因为过氧化物不稳定,与伤口、脓液或污物接触时,会立即生成氧原子,氧原子具有强氧化性,能破坏细菌菌体,杀死细菌。双氧水杀菌后生成水,不会造成二次污染,因此是理想的消毒剂。
混合物的分离和提纯
蒸馏——物质的分离和提纯方法之三
蒸馏
原理:利用液体混合物中各物质的沸点不同,用加热的方法将沸点低的物质变成气态挥发分离出来。用蒸馏原理进行多种混合液的分离,叫分馏。
对于液态混合物的分离和提纯,可用蒸馏和萃取的方法。
2.装置
冷凝管
圆底烧瓶
牛角管
锥形瓶
温度计
【实验1-3】制取蒸馏水(除去Cl- 等杂质)
[注意事项]
①所盛液体不超过蒸馏瓶球部容积的 2/3,也不能少于1/3 ,加热时,不能将液体蒸干。
②温度计的水银球应位于蒸馏烧瓶的支管口下沿。
③蒸馏瓶内要加几粒沸石或碎瓷片,防止液体暴沸。
④冷凝管中通冷却水时,下口( ),
上口( )。
进水
出水
⑤加热温度不能超过混合物中沸点最高物质的沸点。
[问题]
①温度计作用?
②产物收集方式?
③自来水蒸馏后蒸馏
烧瓶内物质?
控温显示加热范围。
但制取蒸馏水时可以不用温度计。
冷凝收集
在100℃难于挥发的杂质。
实验步骤 现象
1、在试管中加入少量自来水,滴入几滴AgNO3(硝酸银)溶液和几滴稀硝酸。
2、在烧瓶中加入约2/3体积的自来水,再加入几粒沸石,按图1-4连接好装置,向冷凝管中通入冷却水。加热烧瓶,弃去开始馏出的部分液体,用锥形瓶收集约10mL液体,停止加热。
3、取少量蒸馏出的液体加入试管中,然后加入几滴AgNO3溶液和几滴稀硝酸。(得到的液体中含有Cl-吗?)
加AgNO3后有白色沉淀生成,再加稀硝酸,白色沉淀不溶解,证明样品含有Cl-
烧瓶中的水变成水蒸气,水蒸气经过冷凝管后变成液态水,流到锥形瓶里。
加AgNO3和稀硝酸,没有白色沉淀生成,说明经蒸馏冷凝后得到的液体没有Cl-
萃取原理:利用物质在互不相溶的溶剂里的溶解度的不同,用一种溶剂把物质从它与另一种溶剂所组成的溶液里提取出来。将萃取后两种互不相溶的液体分开的操作叫分液。
【概念分析】
混合物
溶质
溶剂
(一种)
(两种)
(溶解性不同)
(两者互不相溶)
萃取液
萃取
分液漏斗
分液
萃取——物质的分离和提纯方法之四
注意事项
萃取剂的选择条件:
1.萃取剂与原溶液中的溶剂互不相溶。
如:Ccl4与H2O互不相溶
2.萃取剂与原溶液中的溶质互不反应。
如:Ccl4不与I2反应
3.溶质在两溶剂中的溶解度要有较大的差别(在萃取剂中的溶解度大)
如:Ccl4(I2)>H2O (I2)
4、两种溶剂的密度要有差异。
如:ρ水> ρ苯; ρ(ccl4)> ρ水;
a、苯,C6H6
b、汽油或煤油
c、Ccl4(俗名:四氯化碳,化学名:四氯甲烷),难溶于水,密度大于水。
仪器介绍
分液漏斗
分液漏斗——用于分离互不相溶的液体。
普通漏斗
长颈漏斗
【分液漏斗使用注意事项】
1、使用前检查上口和活塞是否漏水。
2、加入萃取液后要先倒转分液漏斗用力
振荡,再静置。
3、分液时,分液漏斗下端紧贴烧杯内壁,当
分液漏斗内的下层液体恰好流尽时,要立
即关闭分液漏斗的活塞,防止上层液体流出。
要将上层液体由上口倒出。
1.分液漏斗使用之前要检验是否漏水,如何检验?
2.为何要振荡?振荡过程中还有一步什么操作?
3.静置分层之后,为什么要打开上口的玻璃塞?液体分别是如何倒出的?
1.
2.使液体充分混合;打开活塞,放出产生的气体。
3.使漏斗内外压强相等,便于液体流出。
下层液体从下端放出,上层液体从上口倒出。
【实验1-4 】用Ccl4萃取碘水(饱和)中的 I2
现象:
液体分层
上层液体显( )色
下层液体显( )色
浅黄
紫
(详细步骤见教材)
仪器:分液漏斗,带铁圈的铁架台,烧杯
碘水与CCl4刚刚混合
静置以后
用力振荡
为什么会出现颜色的转变?
I2从原先的水层中转移到了CCl4中。
【分析讨论】
1、上层液体中的溶剂是( ),下层液体
中溶剂是( )
2、碘单质(I2)在哪种溶剂中的溶解度大?
3、 Ccl4与H2O比较有何异同?
H2O
Ccl4
四氯化碳(Ccl4)
都能溶解碘单质( I2);都不与
碘单质( I2)反应。
异:
Ccl4与H2O互不相溶;碘单质在Ccl4中的溶解度大。
同:
[ 思考与讨论]
1、根据实验1-4分析,请分总结CCl4性质?
2、将实验1-4中的萃取剂换为酒精是否可以?
请说明原因。
①无色液体,不溶于H2O
②ρ(CCl4)>ρ(H2O)
不可以,酒精与水互溶。
【小结】
分离提纯方法 原理 实例
过滤 固体与液体不互溶的混合物 粗盐的提纯
结晶 混合物中各成分在溶剂中溶解度不同,包括蒸发溶剂结晶和降温结晶 海水晒盐
KCl和KNO3混合物的分离
分液 两种溶剂互不混溶 CCl4和水的分离
萃取 溶质在互不相溶的溶剂里溶解度不同 利用CCl4从溴水中萃取溴
蒸馏 液体混合物中各成分的沸点不同 分离乙醇和醋酸
物质的分离和提纯
方法 适用范围 装置 注意事项
过滤 从液体中分离出不溶的固体物质 注意事项:
1、“一贴二低三靠”
2、必要时洗涤沉淀物
蒸发 获得溶液中的溶质(分离溶剂和溶质) 1、溶质稳定
2、不断搅拌
3、余热蒸干
方法 适用范围 装置 注意事项
蒸馏 分离沸点不同而又相溶的液态混合物(分离固液混合物) 1、温度计水银球的位置
2、加沸石
3、冷凝水进出口
4、不可蒸干
萃取 溶质在两种互不相溶的溶剂里溶解度的不同 1、互不相溶
2、互不反应
3、溶解度要有差异
4、密度要有差异
现需要分离下列物质,请用直线将分离实例、分离方法和选择分离方法的依据连接起来。
实 例 分离方法 选择的依据
除去澄清石灰水中的碳酸钙 蒸馏 溶解度随温度变化的差异
用CCl4提取溴水中溴单质 过滤 在不同溶剂中溶解度的差异
分离醋酸 与 乙醇 分液 沸点的差异较大
(沸点118℃) (沸点78.5℃)
分离汽油和水 结晶 两溶剂互不相溶
从含有氯化钠的硝酸钾溶液中 萃取 物质在水中溶解度的不同
提取硝酸钾
B
课堂练习
B
B
B
化学与生活
为什么双氧水能用于伤口消毒:
双氧水的学名叫过氧化氢,是无色有刺激性气味的液体,医疗上常用质量分数为3%的双氧水对伤口消毒。因为过氧化物不稳定,与伤口、脓液或污物接触时,会立即生成氧原子,氧原子具有强氧化性,能破坏细菌菌体,杀死细菌。双氧水杀菌后生成水,不会造成二次污染,因此是理想的消毒剂。
同课章节目录
- 第一单元 从实验走进化学
- 课题一 实验化学起步
- 实验1-1 蓝瓶子实验
- 课题二 化学实验的绿色追求
- 实验1-2 氯气的生成及其性质的微型实验
- 实验1-3 污水处理--电浮选凝聚法
- 第二单元 物质的获取
- 课题一 物质的分离和提纯
- 实验2-1 纸上层析分离甲基橙和酚酞
- 实验2-2 海水的蒸馏
- 实验2-3 从海带中提取碘
- 课题二 物质的制备
- 实验2-4 硫酸亚铁铵的制备
- 实验2-5 乙酸乙酯的制备及反应条件探究
- 实验2-6 氢氧化铝的制备
- 第三单元 物质的检测
- 课题一 物质的检验
- 实验3-1 几种无机离子的检验
- 实验3-2 几种有机物的检验
- 实验3-3 植物体中某些元素的检验
- 课题二 物质含量的测定
- 实验3-4 酸碱滴定曲线的测绘
- 实验3-5 比色法测定抗贫血药物中铁的含量
- 实验3-6 食醋中总酸量的测定
- 第四单元 研究型实验
- 课题一 物质性质的研究
- 实验4-1 纯净物与混合物性质的比较
- 实验4-2 金属镁、铝、锌化学性质的探究
- 课题二 身边化学问题的探究
- 实验4-3 含氯消毒液性质、作用的探究
- 实验4-4 饮料的研究
