电解池33
图片预览







文档简介
(共44张PPT)
氢气
氧气
电解
电解水 :2 H2O ====2 H2 ↑+ O2↑
+
_
第 三 节
电 解 池
1、电解质是指在_____________能够导电的化合物。
2、电离是指电解质在_____________或__________状态下离解成____________的过程。
3、原电池是_____________ 的装置 。
4、构成原电池的条件是
水溶液或熔融状态下
水溶液
熔融
自由移动离子
把化学能转化为电能
两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还原反应
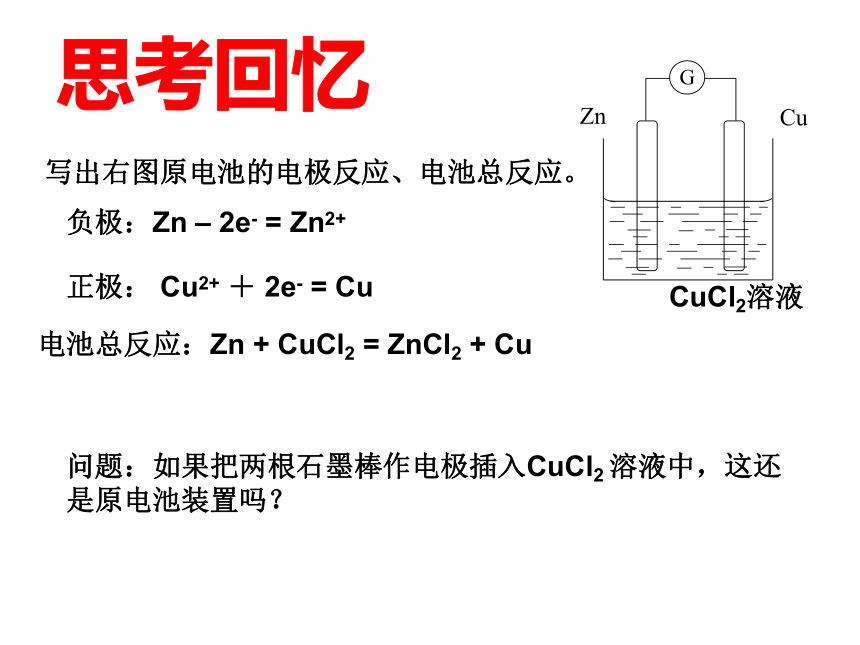
G
Zn
Cu
CuCl2溶液
写出右图原电池的电极反应、电池总反应。
负极:Zn – 2e- = Zn2+
正极: Cu2+ + 2e- = Cu
电池总反应:Zn + CuCl2 = ZnCl2 + Cu
问题:如果把两根石墨棒作电极插入CuCl2 溶液中,这还是原电池装置吗?
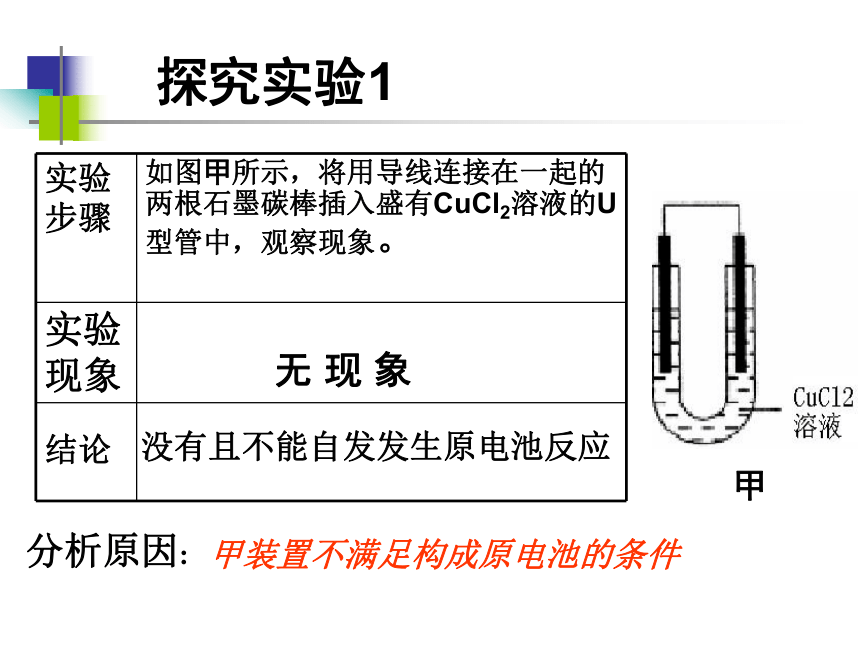
探究实验1
甲
实验步骤 如图甲所示,将用导线连接在一起的两根石墨碳棒插入盛有CuCl2溶液的U型管中,观察现象。
实验现象
结论
无 现 象
没有且不能自发发生原电池反应
甲装置不满足构成原电池的条件
分析原因:
超 级 猜 想
CuCl2溶液在导电时会不会发生化学反应?
会
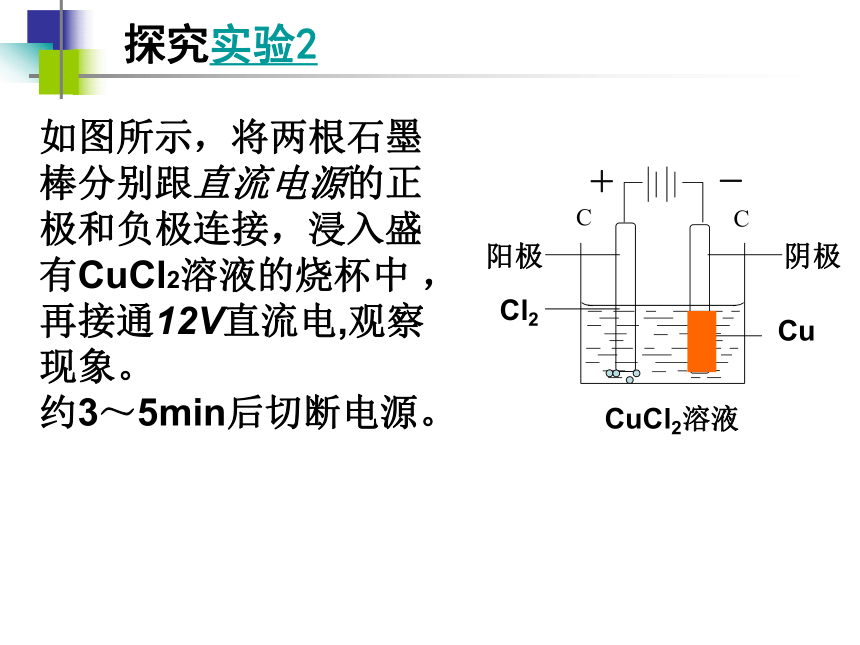
探究实验2
--
如图所示,将两根石墨棒分别跟直流电源的正极和负极连接,浸入盛有CuCl2溶液的烧杯中 ,再接通12V直流电,观察现象。
约3~5min后切断电源。
C
C
Cu
Cl2
阴极
阳极
CuCl2溶液
+
-
电解氯化铜:
一、电解原理
1、电解原理
实验现象:
阴极石墨棒周围CuCl2溶液绿色变深,阳极石墨棒周围CuCl2溶液绿色变浅;阴极石墨棒上逐渐覆盖了一层红色固体,阳极石墨棒上有气泡放出,并可闻到刺激性的气味,同时看到湿润的碘化钾淀粉试纸变为蓝色。
实验结论:
在通直流电的条件下,溶液里的CuCl2发生了分解反应:
CuCl2 = Cu+Cl2↑
Cu生成于阴极的石墨棒上,Cl2生成于阳极的石墨棒上。
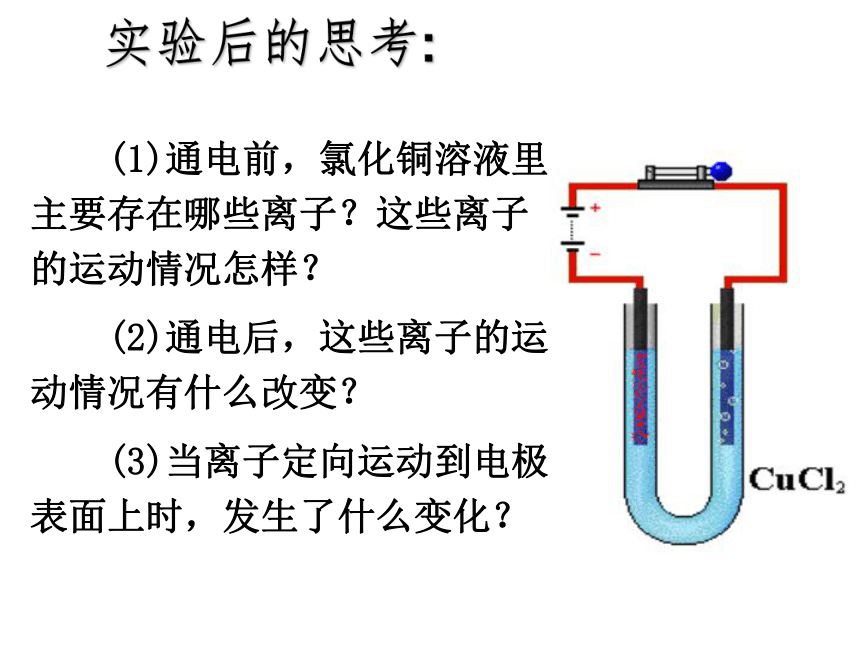
实验后的思考:
(1)通电前,氯化铜溶液里主要存在哪些离子?这些离子的运动情况怎样?
(2)通电后,这些离子的运动情况有什么改变?
(3)当离子定向运动到电极表面上时,发生了什么变化?
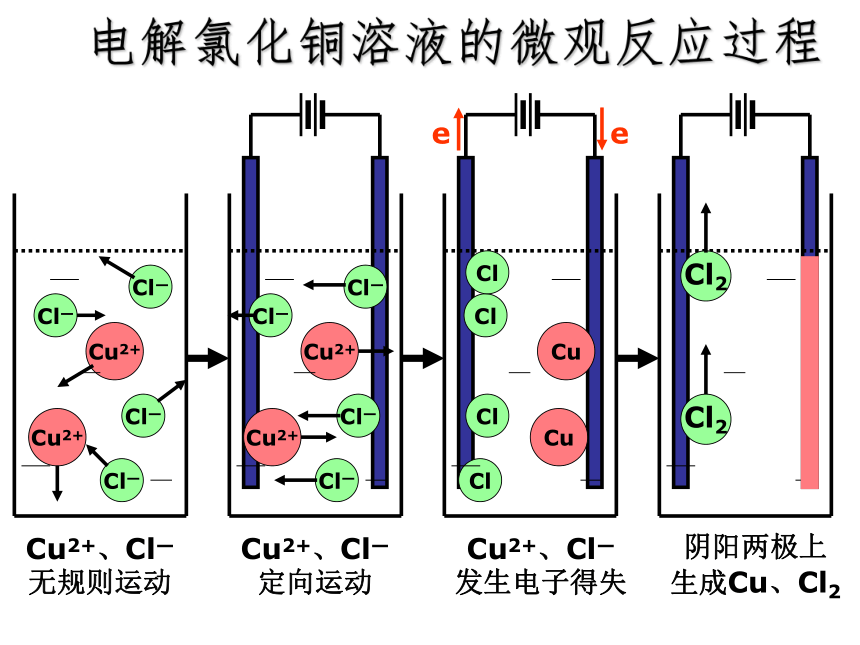
电解氯化铜溶液的微观反应过程
Cl—
Cl—
Cl—
Cl—
Cu2+
Cu2+
Cu2+、Cl—
无规则运动
Cu2+、Cl—
定向运动
Cl—
Cl—
Cl—
Cl—
Cu2+
Cu2+
Cu2+、Cl—
发生电子得失
Cl
Cl
Cl
Cl
Cu
Cu
阴阳两极上
生成Cu、Cl2
Cl2
Cl2
e
e
原理分析:
CuCl2是强电解质且易溶于水,在水溶液中电离生成Cu2+和Cl-。CuCl2=Cu2++2Cl-
通电前,Cu2+和Cl-在水里自由地移动着;通电后,这些自由移动着的离子,在电场作用下,改作定向移动。溶液中带正电的Cu2+向阴极移动,带负电的氯离子向阳极移动。在阴极,铜离子获得电子而还原成铜原子覆盖在阴极上;在阳极,氯离子失去电子而被氧化成氯原子,并两两结合成氯分子,从阳极放出。
阴极:Cu2++2e-=Cu
阳极:Cl--2e-= Cl2↑
电解CuCl2溶液的化学反应方程式:CuCl2=Cu+Cl2↑
问题:你能否根据实验反思给电解下
定义?
实验反思:
电解的条件:
电解的对象:
电解的实质:
外接电源
电解质(溶液或熔融态)
氧化还原反应
阴极—
CuCl2溶液
—阳极
电解:
使直流电通过电解质溶液(或熔融电解质)
而在阴、阳两极引起 氧化还原反应的过程,
叫做电解。
构成电解池的条件:
是电能转变为化学能的装置!
①直流电源;
与电源负极相连的电极为阴极
与电源正极相连的电极为阳极
②阴、阳电极
③电解质溶液或熔融电解质;
电解池:
电能转变为化学能的装置。
C
C
与电源正极相连
阳极
阴极
与电源负极相连
发生氧化反应
阳离子移向
阴离子移向
发生还原反应
电源、电极、电极反应关系
我来总结
电离 电解
条件
电解质————或————的状态下。
电解质电离后受——————的作用。
过程
电解质离解成——————。
阴阳离子的——————,在两
极上——————————
举例
CuCl2==______________
CuCl2==______________
特点
只产生—————————
发生————————生成新物质,————能转化为————能。
联系
电解必须建立在电离的基础上
思考:电解和电离的区别和联系
溶于水
熔融
外加电场
自由移动离子
定向移动
得失电子
Cu2++2Cl-
Cu+Cl2↑
通电
自由移动离子
氧化还原反应
电
化学
装置
原电池
电解池
实例
原理
形成条件
电极名称
电子流向
电流方向
电极反应
能量转化
应用
发生氧化还原反应,从而形成电流
电流通过引起氧化还原反应
两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还原反应
电源、电极(惰性或非惰性)、电解质(水溶液或熔融态)非自发氧化还原反应
由电极本身决定
正极:流入电子 负极:流出电子
由外电源决定
阳极:连电源正极 阴极:连电源负极
(外电路)负极 → 正极
阳极→电源正极→电源负极→阴极
(外电路)正极→负极
阴极→电源负极→电源正极→阳极
负极:Zn - 2e- =Zn2+(氧化反应)
正极:2H+ + 2e- =H2↑(还原原应)
阳极:2 Cl- - 2e- = Cl2 ↑(氧化反应)
阴极: Cu2+ + 2e- = Cu (还原反应)
化学能→ 电能
电能→化学能
设计电池、金属防腐
氯碱工业、电镀、电冶、金属精炼
铜锌原电池
电解氯化铜
思考交流
对比原电池和电解池。
练习
分析下图,哪个是原电池,哪个是电解池。
提高:
请写出电解水的电极反应式。
氢气—
—氧气
水
阴极—
CuCl2溶液
—阳极
阴极:4H++4e-=2H2↑
阳极:4OH--4e-=O2↑+2H2O
问题:
给CuCl2溶液通电时,为什么不是水
电离出的H+和OH-放电生成氢气和氧气
当一个电极存在多种可能放电的离子时,为什么不是一起放电?阳离子和
阴离子是否放电与什么因素有关?
我 会
思 考:
1、阳极:
还原性强的离子先放电
常见阴离子放电顺序:
I- > Br - > Cl-
> OH-
S2- >
常见阳离子放电顺序:
2、阴极:
氧化性强的离子先放电
Ag+>Hg2+> Cu2+>H+
>Fe2+>Zn2+> Al3+>Mg2+>Na+
Fe3+>
我会
分析:
>含氧酸根
练习:以碳棒为电极,电解下列溶液,写出电极反应式
1、 CuCl2 HI
2、 Na2SO4、 H2SO4 、NaOH
3、 NaCl,
4、 AgNO3、
实例 电极反应 浓度 pH 复原
阴极
阳极
氯
气
铜
实例
电极反应
浓度
PH值
复原
CuCl2
CuCl2 Cu+Cl2 ↑
电解
阳极:(Cl- OH-) : 2Cl--2 e- =Cl2 ↑
阴极(Cu2+ H+):Cu2++ 2e-=2Cu
减小
增
大
加适量
CuCl2
晶体
第一组:电解CuCl2
阴极
阳极
碘
氢气
实例
电极反应
浓度
PH值
复原
HI
2HI I2 + H2 ↑
阳极:(I- ,OH-) : 2I--2 e- =I2
阴极( H+):2H++ 2e-= H2↑
减小
增
大
通入
适量
HI
第一组:电解HI溶液
电解
阴极
阳极
氧气
氢
气
阳极(OH- SO42-): 4OH-- 4e- = 2H2O+O2 ↑
实例
电极反应
浓度
PH值
复原
Na2SO4
阴极(H+ Na+) :4H ++ 4e- = 2H2 ↑
变大
不
变
加
H2O
2H2O == 2H2 ↑+O2 ↑
通电
第二组:电解Na2SO4
阴极
阳极
氧气
氢
气
阳极(OH- SO42-): 4OH-- 4e- = 2H2O+O2 ↑
实例
电极反应
浓度
PH值
复原
H2SO4
阴极(H+ ) :4H ++ 4e- = 2H2 ↑
变大
变
小
加
H2O
2H2O == 2H2 ↑+O2 ↑
通电
第二组:电解H2SO4
阴极
阳极
氧气
氢
气
阳极(OH- ): 4OH-- 4e- = 2H2O+O2↑
实例
电极反应
浓度
PH值
复原
NaOH
阴极(H+ Na+) :4H ++ 4e- = 2H2 ↑
变大
变
大
加
H2O
2H2O == 2H2 ↑+O2 ↑
通电
第二组:电解NaOH
第三组:电解NaCl
阴极
阳极
氢
气
氯气
实例
电极反应
浓度
PH值
复原
NaCl
阳极(Cl- OH-): 2Cl-- 2e- = Cl 2 ↑
阴极(Na+ H+):2H ++ 2e- = H2 ↑
2NaCl+2H2O 2NaOH+H2 ↑+Cl2 ↑
减小
增
大
通入适量
HCl
电解
阴极
阳极
氧
气
铜
实例
电极反应
浓度
PH值
复原
CuSO4
2CuSO4+2H2O 2Cu +O2↑+2H2SO4
阴极(Cu2+ H+): 2Cu2++ 4e-=2Cu
减小
加适量
CuO
固体
第四组:电解CuSO4
阳极(SO42- OH-) :4OH-- 4e- = 2H2O+O2 ↑
减
小
电解
二、电解质溶液电解规律(惰性电极)
阳极:S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
Ⅰ
Ⅲ
Ⅱ
Ⅳ
Ⅰ与Ⅲ区:电解本身型 如CuCl2
Ⅰ与Ⅳ区:放氢生碱型 如NaCl
Ⅱ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3
Ⅱ与Ⅳ区:电解水型 如Na2SO4、 H2SO4 、NaOH
阴极:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+
分析电解反应的一般思路:
明确溶液中存在哪些离子
根据阳极氧化、阴极还原分析得出产物
判断阴阳两极附近离子
种类及离子放电顺序
用惰性电极电解下列物质的溶液,
填表并写出电极反应
电解质 溶液中离子 阴极
产物 阳极
产物 电解过程溶液PH值
H2SO4
HCl
NaOH
NaCl
K2SO4
CuCl2
CuSO4
H+ OH- SO42-
H+ OH- Cl-
Na+ H+ OH-
Na+ Cl- H+ OH-
K+ SO42- H+ OH-
Cu2+ Cl- H+ OH-
Cu2+ SO42- H+ OH-
H2
O2
H2
Cl2
H2
O2
H2
Cl2
H2
O2
Cu
Cl2
Cu
O2
减小
增大
增大
增大
不变
增大
减小
1、以Fe为阴极 ,Cu为阳极,电解CuSO4,画出电解池,标出电极名称,写出电极反应。
练习
阴极(Fe)
阳极(Cu)
铜
实例
电极反应
浓度
PH值
CuSO4
阴极(Cu2+ H+): Cu2+ + 2e-=Cu
不变
电解CuSO4
阳极(SO42- OH-) : Cu - 2e- = Cu 2+
不变
阳极现象
电极反应式
阴极现象
电极反应式
石墨
石墨
+
—
CuSO4 溶液
铜
铜
+
—
CuSO4 溶液
4OH-- 4e— = 2H2O+O2↑
2Cu2++ 4e— =2Cu
Cu – 2e- = Cu2+
Cu2+ +2e- =Cu
电极附近有气泡冒出
(电极表面变疏松)电极不断溶解
电极上有红色物质析出
电极上有红色物质析出
为什么阴极现象相同?
为什么阳极现象不同?
活性电极与惰性电极
惰性电极:用Pt、Au、石墨等为材料制作的电极,惰性电极本身不参与电极上的氧化还原反应,只起导电作用。
活性电极:除了惰性电极外,其他电极一般都可称之为活性电极,活性电极作阳极时,电极本身参与氧化还原反应
镀了一层铜
镀了一层铜
②当阳极为金属电极(除铂、金)时,金属电极优先放电。
阳极:
①当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
S2- > I- > Br- > Cl- > OH- > 含氧酸根
阴极:
常见阳离子放电顺序
K+电解池的电解规律:
2、以Cu为阴极,Ag为阳极,电解AgNO3,画出电解池,标出电极,写出电极反应。
练习
阴极(Cu)
阳极(Ag)
银
实例
电极反应
浓度
PH值
AgNO3
阴极(Ag+ H+): Ag+ + e-=Ag
不变
电解AgNO3
阳极(NO3- OH-) : Ag- e- = Ag +
不变
3.(1)右图的装置会出现什么现象?并完成电极反应式和总反应式。
(2) 左边烧杯为_____装置,
右边烧杯为_____装置。
当Zn减轻0.65g时,左边烧
杯的碳棒增重____ g,
右边烧杯的左边碳棒为__极,
产生的气体为___ mol,
右边烧杯的右边碳棒为__极,
在标状下产生的气体为___ mL。
4、(2003广东)用惰性电极实现电解,下列说法正确的是( )
A、电解稀硫酸溶液,实质上是电解水,故溶液p H不变
B、电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C、电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D、电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
D
练习
5、当用铜做电极电解氯化铜溶液时,在阳极的产物是
Cu
Cl2
O2
Cu2+
√
练习
6、符合电解原理的是:①电解是把化学能转变为电能 ②电解质溶液导电是化学变化,金属导电是物理变化 ③不能自发进行的氧化还原反应,通过电解原理可以实现 ④原电池的负极与电解池的阳极发生的都是氧化反应⑤ 电解时电子从电源负极沿导线流入电解池阴极经电解质溶液流到阳极
①②③④;
②③④⑤;
②③⑤;
②③④;
√
练习
7、右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
a为负极、b为正极;
a为阳极、b为阴极;
电解过程中,d电极质量增加;
电解过程中,氯离子浓度不变;
√
氢气
氧气
电解
电解水 :2 H2O ====2 H2 ↑+ O2↑
+
_
第 三 节
电 解 池
1、电解质是指在_____________能够导电的化合物。
2、电离是指电解质在_____________或__________状态下离解成____________的过程。
3、原电池是_____________ 的装置 。
4、构成原电池的条件是
水溶液或熔融状态下
水溶液
熔融
自由移动离子
把化学能转化为电能
两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还原反应
G
Zn
Cu
CuCl2溶液
写出右图原电池的电极反应、电池总反应。
负极:Zn – 2e- = Zn2+
正极: Cu2+ + 2e- = Cu
电池总反应:Zn + CuCl2 = ZnCl2 + Cu
问题:如果把两根石墨棒作电极插入CuCl2 溶液中,这还是原电池装置吗?
探究实验1
甲
实验步骤 如图甲所示,将用导线连接在一起的两根石墨碳棒插入盛有CuCl2溶液的U型管中,观察现象。
实验现象
结论
无 现 象
没有且不能自发发生原电池反应
甲装置不满足构成原电池的条件
分析原因:
超 级 猜 想
CuCl2溶液在导电时会不会发生化学反应?
会
探究实验2
--
如图所示,将两根石墨棒分别跟直流电源的正极和负极连接,浸入盛有CuCl2溶液的烧杯中 ,再接通12V直流电,观察现象。
约3~5min后切断电源。
C
C
Cu
Cl2
阴极
阳极
CuCl2溶液
+
-
电解氯化铜:
一、电解原理
1、电解原理
实验现象:
阴极石墨棒周围CuCl2溶液绿色变深,阳极石墨棒周围CuCl2溶液绿色变浅;阴极石墨棒上逐渐覆盖了一层红色固体,阳极石墨棒上有气泡放出,并可闻到刺激性的气味,同时看到湿润的碘化钾淀粉试纸变为蓝色。
实验结论:
在通直流电的条件下,溶液里的CuCl2发生了分解反应:
CuCl2 = Cu+Cl2↑
Cu生成于阴极的石墨棒上,Cl2生成于阳极的石墨棒上。
实验后的思考:
(1)通电前,氯化铜溶液里主要存在哪些离子?这些离子的运动情况怎样?
(2)通电后,这些离子的运动情况有什么改变?
(3)当离子定向运动到电极表面上时,发生了什么变化?
电解氯化铜溶液的微观反应过程
Cl—
Cl—
Cl—
Cl—
Cu2+
Cu2+
Cu2+、Cl—
无规则运动
Cu2+、Cl—
定向运动
Cl—
Cl—
Cl—
Cl—
Cu2+
Cu2+
Cu2+、Cl—
发生电子得失
Cl
Cl
Cl
Cl
Cu
Cu
阴阳两极上
生成Cu、Cl2
Cl2
Cl2
e
e
原理分析:
CuCl2是强电解质且易溶于水,在水溶液中电离生成Cu2+和Cl-。CuCl2=Cu2++2Cl-
通电前,Cu2+和Cl-在水里自由地移动着;通电后,这些自由移动着的离子,在电场作用下,改作定向移动。溶液中带正电的Cu2+向阴极移动,带负电的氯离子向阳极移动。在阴极,铜离子获得电子而还原成铜原子覆盖在阴极上;在阳极,氯离子失去电子而被氧化成氯原子,并两两结合成氯分子,从阳极放出。
阴极:Cu2++2e-=Cu
阳极:Cl--2e-= Cl2↑
电解CuCl2溶液的化学反应方程式:CuCl2=Cu+Cl2↑
问题:你能否根据实验反思给电解下
定义?
实验反思:
电解的条件:
电解的对象:
电解的实质:
外接电源
电解质(溶液或熔融态)
氧化还原反应
阴极—
CuCl2溶液
—阳极
电解:
使直流电通过电解质溶液(或熔融电解质)
而在阴、阳两极引起 氧化还原反应的过程,
叫做电解。
构成电解池的条件:
是电能转变为化学能的装置!
①直流电源;
与电源负极相连的电极为阴极
与电源正极相连的电极为阳极
②阴、阳电极
③电解质溶液或熔融电解质;
电解池:
电能转变为化学能的装置。
C
C
与电源正极相连
阳极
阴极
与电源负极相连
发生氧化反应
阳离子移向
阴离子移向
发生还原反应
电源、电极、电极反应关系
我来总结
电离 电解
条件
电解质————或————的状态下。
电解质电离后受——————的作用。
过程
电解质离解成——————。
阴阳离子的——————,在两
极上——————————
举例
CuCl2==______________
CuCl2==______________
特点
只产生—————————
发生————————生成新物质,————能转化为————能。
联系
电解必须建立在电离的基础上
思考:电解和电离的区别和联系
溶于水
熔融
外加电场
自由移动离子
定向移动
得失电子
Cu2++2Cl-
Cu+Cl2↑
通电
自由移动离子
氧化还原反应
电
化学
装置
原电池
电解池
实例
原理
形成条件
电极名称
电子流向
电流方向
电极反应
能量转化
应用
发生氧化还原反应,从而形成电流
电流通过引起氧化还原反应
两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还原反应
电源、电极(惰性或非惰性)、电解质(水溶液或熔融态)非自发氧化还原反应
由电极本身决定
正极:流入电子 负极:流出电子
由外电源决定
阳极:连电源正极 阴极:连电源负极
(外电路)负极 → 正极
阳极→电源正极→电源负极→阴极
(外电路)正极→负极
阴极→电源负极→电源正极→阳极
负极:Zn - 2e- =Zn2+(氧化反应)
正极:2H+ + 2e- =H2↑(还原原应)
阳极:2 Cl- - 2e- = Cl2 ↑(氧化反应)
阴极: Cu2+ + 2e- = Cu (还原反应)
化学能→ 电能
电能→化学能
设计电池、金属防腐
氯碱工业、电镀、电冶、金属精炼
铜锌原电池
电解氯化铜
思考交流
对比原电池和电解池。
练习
分析下图,哪个是原电池,哪个是电解池。
提高:
请写出电解水的电极反应式。
氢气—
—氧气
水
阴极—
CuCl2溶液
—阳极
阴极:4H++4e-=2H2↑
阳极:4OH--4e-=O2↑+2H2O
问题:
给CuCl2溶液通电时,为什么不是水
电离出的H+和OH-放电生成氢气和氧气
当一个电极存在多种可能放电的离子时,为什么不是一起放电?阳离子和
阴离子是否放电与什么因素有关?
我 会
思 考:
1、阳极:
还原性强的离子先放电
常见阴离子放电顺序:
I- > Br - > Cl-
> OH-
S2- >
常见阳离子放电顺序:
2、阴极:
氧化性强的离子先放电
Ag+>Hg2+> Cu2+>H+
>Fe2+>Zn2+> Al3+>Mg2+>Na+
Fe3+>
我会
分析:
>含氧酸根
练习:以碳棒为电极,电解下列溶液,写出电极反应式
1、 CuCl2 HI
2、 Na2SO4、 H2SO4 、NaOH
3、 NaCl,
4、 AgNO3、
实例 电极反应 浓度 pH 复原
阴极
阳极
氯
气
铜
实例
电极反应
浓度
PH值
复原
CuCl2
CuCl2 Cu+Cl2 ↑
电解
阳极:(Cl- OH-) : 2Cl--2 e- =Cl2 ↑
阴极(Cu2+ H+):Cu2++ 2e-=2Cu
减小
增
大
加适量
CuCl2
晶体
第一组:电解CuCl2
阴极
阳极
碘
氢气
实例
电极反应
浓度
PH值
复原
HI
2HI I2 + H2 ↑
阳极:(I- ,OH-) : 2I--2 e- =I2
阴极( H+):2H++ 2e-= H2↑
减小
增
大
通入
适量
HI
第一组:电解HI溶液
电解
阴极
阳极
氧气
氢
气
阳极(OH- SO42-): 4OH-- 4e- = 2H2O+O2 ↑
实例
电极反应
浓度
PH值
复原
Na2SO4
阴极(H+ Na+) :4H ++ 4e- = 2H2 ↑
变大
不
变
加
H2O
2H2O == 2H2 ↑+O2 ↑
通电
第二组:电解Na2SO4
阴极
阳极
氧气
氢
气
阳极(OH- SO42-): 4OH-- 4e- = 2H2O+O2 ↑
实例
电极反应
浓度
PH值
复原
H2SO4
阴极(H+ ) :4H ++ 4e- = 2H2 ↑
变大
变
小
加
H2O
2H2O == 2H2 ↑+O2 ↑
通电
第二组:电解H2SO4
阴极
阳极
氧气
氢
气
阳极(OH- ): 4OH-- 4e- = 2H2O+O2↑
实例
电极反应
浓度
PH值
复原
NaOH
阴极(H+ Na+) :4H ++ 4e- = 2H2 ↑
变大
变
大
加
H2O
2H2O == 2H2 ↑+O2 ↑
通电
第二组:电解NaOH
第三组:电解NaCl
阴极
阳极
氢
气
氯气
实例
电极反应
浓度
PH值
复原
NaCl
阳极(Cl- OH-): 2Cl-- 2e- = Cl 2 ↑
阴极(Na+ H+):2H ++ 2e- = H2 ↑
2NaCl+2H2O 2NaOH+H2 ↑+Cl2 ↑
减小
增
大
通入适量
HCl
电解
阴极
阳极
氧
气
铜
实例
电极反应
浓度
PH值
复原
CuSO4
2CuSO4+2H2O 2Cu +O2↑+2H2SO4
阴极(Cu2+ H+): 2Cu2++ 4e-=2Cu
减小
加适量
CuO
固体
第四组:电解CuSO4
阳极(SO42- OH-) :4OH-- 4e- = 2H2O+O2 ↑
减
小
电解
二、电解质溶液电解规律(惰性电极)
阳极:S2- > I- > Br- > Cl- > OH- > 含氧酸根 > F-
Ⅰ
Ⅲ
Ⅱ
Ⅳ
Ⅰ与Ⅲ区:电解本身型 如CuCl2
Ⅰ与Ⅳ区:放氢生碱型 如NaCl
Ⅱ与Ⅲ区:放氧生酸型 如CuSO4、AgNO3
Ⅱ与Ⅳ区:电解水型 如Na2SO4、 H2SO4 、NaOH
阴极:Ag+>Fe3+>Cu2+>H+>Fe2+>Zn2+>Al3+>Mg2+>Na+
分析电解反应的一般思路:
明确溶液中存在哪些离子
根据阳极氧化、阴极还原分析得出产物
判断阴阳两极附近离子
种类及离子放电顺序
用惰性电极电解下列物质的溶液,
填表并写出电极反应
电解质 溶液中离子 阴极
产物 阳极
产物 电解过程溶液PH值
H2SO4
HCl
NaOH
NaCl
K2SO4
CuCl2
CuSO4
H+ OH- SO42-
H+ OH- Cl-
Na+ H+ OH-
Na+ Cl- H+ OH-
K+ SO42- H+ OH-
Cu2+ Cl- H+ OH-
Cu2+ SO42- H+ OH-
H2
O2
H2
Cl2
H2
O2
H2
Cl2
H2
O2
Cu
Cl2
Cu
O2
减小
增大
增大
增大
不变
增大
减小
1、以Fe为阴极 ,Cu为阳极,电解CuSO4,画出电解池,标出电极名称,写出电极反应。
练习
阴极(Fe)
阳极(Cu)
铜
实例
电极反应
浓度
PH值
CuSO4
阴极(Cu2+ H+): Cu2+ + 2e-=Cu
不变
电解CuSO4
阳极(SO42- OH-) : Cu - 2e- = Cu 2+
不变
阳极现象
电极反应式
阴极现象
电极反应式
石墨
石墨
+
—
CuSO4 溶液
铜
铜
+
—
CuSO4 溶液
4OH-- 4e— = 2H2O+O2↑
2Cu2++ 4e— =2Cu
Cu – 2e- = Cu2+
Cu2+ +2e- =Cu
电极附近有气泡冒出
(电极表面变疏松)电极不断溶解
电极上有红色物质析出
电极上有红色物质析出
为什么阴极现象相同?
为什么阳极现象不同?
活性电极与惰性电极
惰性电极:用Pt、Au、石墨等为材料制作的电极,惰性电极本身不参与电极上的氧化还原反应,只起导电作用。
活性电极:除了惰性电极外,其他电极一般都可称之为活性电极,活性电极作阳极时,电极本身参与氧化还原反应
镀了一层铜
镀了一层铜
②当阳极为金属电极(除铂、金)时,金属电极优先放电。
阳极:
①当阳极为惰性电极(石墨、铂、金)时,常见阴离子放电顺序:
S2- > I- > Br- > Cl- > OH- > 含氧酸根
阴极:
常见阳离子放电顺序
K+
2、以Cu为阴极,Ag为阳极,电解AgNO3,画出电解池,标出电极,写出电极反应。
练习
阴极(Cu)
阳极(Ag)
银
实例
电极反应
浓度
PH值
AgNO3
阴极(Ag+ H+): Ag+ + e-=Ag
不变
电解AgNO3
阳极(NO3- OH-) : Ag- e- = Ag +
不变
3.(1)右图的装置会出现什么现象?并完成电极反应式和总反应式。
(2) 左边烧杯为_____装置,
右边烧杯为_____装置。
当Zn减轻0.65g时,左边烧
杯的碳棒增重____ g,
右边烧杯的左边碳棒为__极,
产生的气体为___ mol,
右边烧杯的右边碳棒为__极,
在标状下产生的气体为___ mL。
4、(2003广东)用惰性电极实现电解,下列说法正确的是( )
A、电解稀硫酸溶液,实质上是电解水,故溶液p H不变
B、电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C、电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1:2
D、电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1:1
D
练习
5、当用铜做电极电解氯化铜溶液时,在阳极的产物是
Cu
Cl2
O2
Cu2+
√
练习
6、符合电解原理的是:①电解是把化学能转变为电能 ②电解质溶液导电是化学变化,金属导电是物理变化 ③不能自发进行的氧化还原反应,通过电解原理可以实现 ④原电池的负极与电解池的阳极发生的都是氧化反应⑤ 电解时电子从电源负极沿导线流入电解池阴极经电解质溶液流到阳极
①②③④;
②③④⑤;
②③⑤;
②③④;
√
练习
7、右图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是
a为负极、b为正极;
a为阳极、b为阴极;
电解过程中,d电极质量增加;
电解过程中,氯离子浓度不变;
√
