山东省青岛市4区市2021-2022学年高一上学期期中考试化学试题(Word版含答案)
文档属性
| 名称 | 山东省青岛市4区市2021-2022学年高一上学期期中考试化学试题(Word版含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 520.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-17 00:00:00 | ||
图片预览


文档简介
青岛市4区市2021-2022学年高一上学期期中考试
化学试题
说明:
1.本试卷分为选择题和非选择题两部分,考试时间90分钟,满分100分。
2.选择题答案用2B铅笔涂在答题卡上,非选择题用0.5mm黑色中性笔作答,答案
必须写在答题卡各题目指定区域内的相应位置。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Pt 195
一、选择题:本题共20小题,每小题3分,共60分,每小题只有一个选项符合题意。
1.下列有关说法错误的是( )
A.烧制陶瓷、冶炼金属、酿造酒类都属于化学变化
B.青蒿素的提取使用乙醚,是因为其沸点比乙醇高
C.英国科学家道尔顿提出近代原子学说,为近代化学奠定基础
D.垃圾分类有利于资源的重新利用
2.古诗词是我国传统文化的瑰宝。下列诗词解读错误的是( )
A.“千锤万凿出深山,烈火焚烧若等闲”,涉及反应为分解反应
B.“错把陈醋当成墨,写尽半生纸上酸”,陈醋中的醋酸是电解质
C.“绳锯木断,水滴石穿”,该过程中一定不包含化学变化
D.“朝坛雾卷,曙岭烟沉”,雾有丁达尔现象是因为胶体粒子对光有散射作用
3.将一小块钠投入到盛有硫酸铜溶液的烧杯中,不可能观察到的现象是( )
A.钠熔成小球并浮在液面上四处游动
B.有气体生成,并发出“嵫嵫”声音
C.溶液底部有紫红色物质生成
D.溶液变浑浊,有蓝色沉淀生成
4.下列有关实验室安全说法错误的是( )
A.金属钠与皮肤接触会腐蚀皮肤,不可用手直接拿金属钠
B.二氧化碳不支持燃烧,金属钠着火可用二氧化碳灭火器扑灭
C.氯气有毒,有关氯气性质实验要在通风条件下进行
D.少量浓硫酸不慎溅到皮肤上,应立即用大量水冲洗
5.下列有关实验操作错误的是( )
A.用镊子取出钠块,用滤纸吸干表面的煤油,用小刀切下绿豆粒大小的钠进行实验
B.钠燃烧时,在上方罩一个干燥的小烧杯,可观察到烧杯内壁有淡黄色物质
C.闻气味时,稍打开集气瓶玻璃片,用手轻轻地扇动瓶口,使极少量气体飘进鼻孔
D.配制稀硫酸时,将浓硫酸用玻璃棒引流入容量瓶,待冷却至室温,加水至刻度线
6.下列有关钠及其化合物说法正确的是( )
A.自然界中存在单质钠
B.观察广口瓶中煤油底部的钠,表面为银白色
C.可作为呼吸面具或潜水艇中氧气的来源
D.等质量的和固体分别与足量稀硫酸反应,产生的量相等
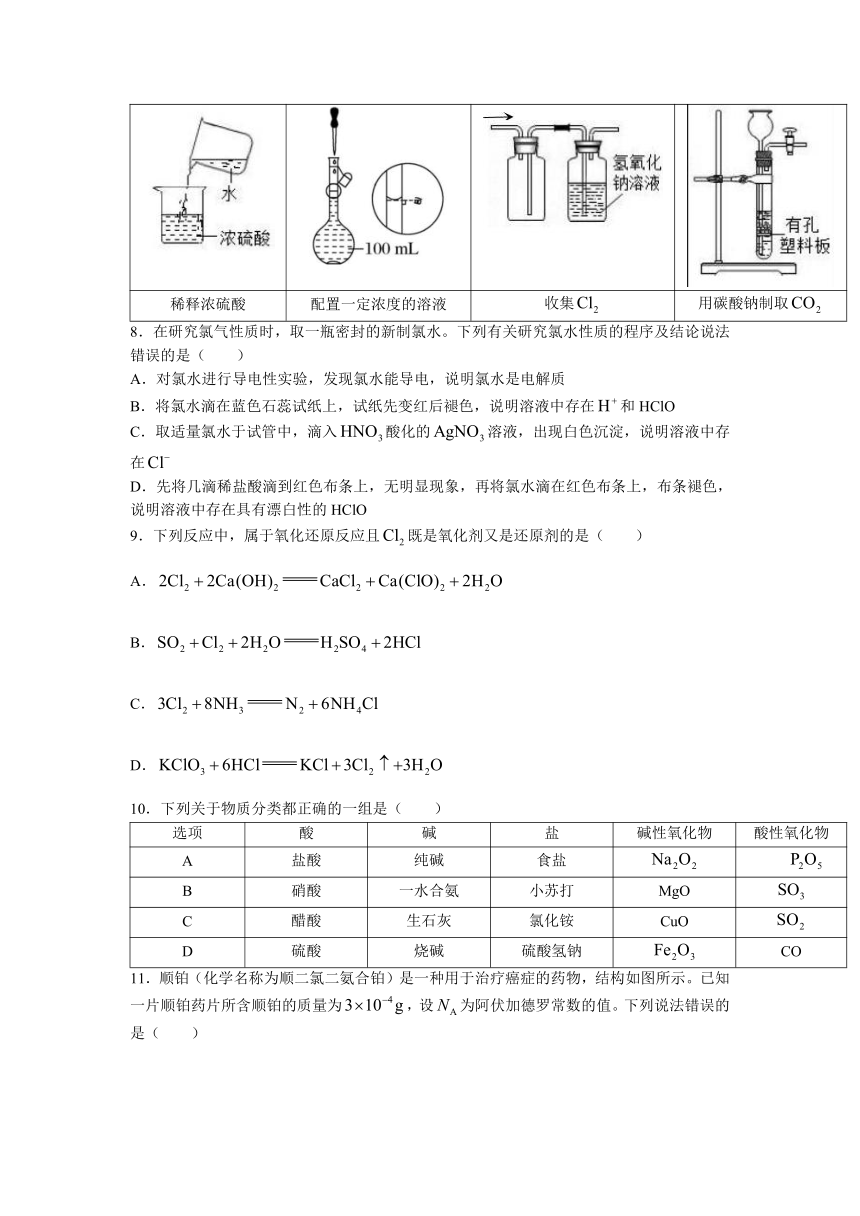
7.下列实验操作或装置正确且能达到实验目的的是( )
A B C D
稀释浓硫酸 配置一定浓度的溶液 收集 用碳酸钠制取
8.在研究氯气性质时,取一瓶密封的新制氯水。下列有关研究氯水性质的程序及结论说法错误的是( )
A.对氯水进行导电性实验,发现氯水能导电,说明氯水是电解质
B.将氯水滴在蓝色石蕊试纸上,试纸先变红后褪色,说明溶液中存在和HClO
C.取适量氯水于试管中,滴入酸化的溶液,出现白色沉淀,说明溶液中存在
D.先将几滴稀盐酸滴到红色布条上,无明显现象,再将氯水滴在红色布条上,布条褪色,说明溶液中存在具有漂白性的HClO
9.下列反应中,属于氧化还原反应且既是氧化剂又是还原剂的是( )
A.
B.
C.
D.
10.下列关于物质分类都正确的一组是( )
选项 酸 碱 盐 碱性氧化物 酸性氧化物
A 盐酸 纯碱 食盐
B 硝酸 一水合氨 小苏打 MgO
C 醋酸 生石灰 氯化铵 CuO
D 硫酸 烧碱 硫酸氢钠 CO
11.顺铂(化学名称为顺二氯二氨合铂)是一种用于治疗癌症的药物,结构如图所示。已知一片顺铂药片所含顺铂的质量为,设为阿伏加德罗常数的值。下列说法错误的是( )
A.顺铂化学式为
B.顺铂的摩尔质量为
C.一片顺铂药片中顺铂所含H原子的数目为
D.相同条件下,等体积的HCl和所含的原子个数之比为1:2
12.逻辑推理是化学学习中常用的一种思维方式,以下推理中正确的是( )
A.单质都是由一种元素组成的,只含一种元素的物质一定是纯净物
B.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
C.酸都能电离出氢离子,能电离出氢离子的化合物一定是酸
D.酸性氧化物与碱反应生成盐和水,与碱反应生成盐和水的物质一定是酸性氧化物
13.离子方程式可以表达溶液中的反应。下列离子方程式错误的是( )
A.将绿豆粒大小的钠投入水中:
B.醋酸除去水垢中的碳酸钙:
C.84消毒液与洁厕灵混用:
D.溶液与少量澄清石灰水:
14.是一种高效水处理剂,实验室可通过以下反应制得:
。下列关于该反应说法正确的是( )
A.氧化剂是,发生氧化反应
B.被氧化的元素是碳
C.还原剂和还原产物的物质的量之比为1:1
D.当上述反应中消耗了时,转移的电子数约为
15.粗食盐中含有、、等杂质,实验室要除去食盐中的杂质,精制NaCl固体。下列操作不需要的是( )
A. B. C. D.
16.若表示阿伏加德罗常数的值。下列说法正确的是( )
A.与水完全反应时转移电子数为
B.相同条件下,He和的混合气体与等体积的所含原子数相等
C.0.1 mol铁与充分反应,转移的电子数为
D.溶液中含有个NaCl分子
17.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明溶液中:、、、
B.加入锌粉产生的溶液中:、、、
C.酸性溶液中:、、、
D.使酚酞试剂显红色的溶液中:、、、
18.向溶液中滴入几滴酚酞溶液,将电导率传感器插入溶液中,然后匀速加入硫酸溶液,电导率与时间图像如图。下列说法错误的是( )
A.溶液由红色逐渐变为无色
B.a到b段电导率降低的原因是和浓度降低
C.电导率最低点的离子方程式为
D.b到c段溶液中和浓度增大,导电能力增强
19.常温常压下,将和装入密闭容器中,设为阿伏加德罗常数的值。下列说法正确的是( )
A.分子数目为
B.和氧原子数目比为2:3
C.混合气体的体积为22.4L
D.和所含质子数目比为5:4
20.下列实验操作、现象及所得结论均正确的是( )
选项 实验操作和现象 结论
A 向溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 溶液中一定含
B 向NaOH溶液中逐滴滴加饱和溶液,有红褐色物质生成 得到氢氧化铁胶体
C 将点燃的伸入到盛的集气瓶中,产生淡蓝色火焰,瓶口有白雾 能在中燃烧
D 向溶液中滴加酸性溶液,紫色褪去 具有还原性
二、根据题意填空、简答:共4道大题,40分,答案填写在答题卡上。
21.(9 分)现需要的稀盐酸,用实验室提供的浓盐酸进行配制,浓盐酸试剂瓶标签如图所示。回答下列问题:
盐酸 分子式:HCl 相对分子质量:36.5 密度: 质量分数:36.5%
(1)该浓盐酸的物质的量浓度为______。量取______mL。上述浓盐酸进行配制,应选用下列量筒中的________(填标号)。
a.10mL b.15mL c.25mL d.0mL
(2)配制操作步骤可分解为以下几步:
A.用量筒量取所需体积的浓盐酸,将其沿玻璃棒缓缓注入烧杯中,再向烧杯中加入少量蒸馏水,用玻璃棒慢慢搅动
B.将已恢复至室温的稀盐酸小心地用玻璃棒引流入250mL容量瓶
C.用约30mL蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液都注入容量瓶中
D.继续往容量瓶中加蒸馏水,至液面接近刻度线1~2cm
E.……
F.盖紧瓶塞,反复倾倒振荡,摇匀溶液
G.将配制好的稀盐酸倒入试剂瓶,贴上标签
步骤E为__________________________________________________________________。
(3)操作C的目的是__________________________________________________________。
(4)配制上述溶液时,下列操作会导致所配溶液的浓度偏高的是______(填标号)。
a.量筒量取浓盐酸读数时俯视
b.未等恢复至室温就转移
c.向容量瓶转移时,不慎将少量溶液洒到容量瓶外面
d.定容后加水过量,又从容量瓶中取出部分溶液,使液面降至刻度线
(5)某同学用所配制的稀盐酸滴到5.3g碳酸钠固体中,待固体全部反应,需该盐酸体积为______mL。
22.(10分)实验室用如下装置制取氯气,并进行性质实验。回答下列问题:
(1)仪器a的名称为_________,写出A中反应的化学方程式________________________。
(2)C中的试剂为_______________。
(3)能证明氯气无漂白性的现象是_____________________________________________。
(4)F处观察到棉花团变蓝色,说明氯气具有_______性(填“氧化”或“还原”)。
(5)写出G处尾气吸收的离子方程式____________________________。
(6)实验室还可用固体与浓盐酸常温下反应制备氯气:
。由此可判知氧化性比 ______(填“强”或“弱”),若有参加反应,则被氧化的HCl的物质的量为_______。
23.(10分)化学实验室某次实验产生的废液中可能含有大量的、、、、、等。设计实验进行鉴别,步骤如下:
①加入NaOH溶液产生蓝色沉淀;
②向①所得的溶液中滴加足量溶液,有白色沉淀生成;
③过滤,然后向所得白色沉淀中加入过量稀硝酸,沉淀无变化。
由此判断:
(1)该废液中确定存在的离子有__________________________。
(2)步骤①发生反应的离子方程式为__________________________。
(3)某兴趣小组要除去废液中确定的离子,并回收其中的金属,最后得到NaCl溶液。设计实验方案如下:
①操作1为_______,固体2为________,试剂d为________。
②溶液2所含溶质为________________________________________(填化学式)。
③写出加入试剂a的离子方程式_________________________________________。
24.(11分)某化学课外兴趣小组探究过氧化钠与水的反应,探究过程如下:
(1)实验1:向包有过氧化钠粉末的脱脂棉上滴水,脱脂棉燃烧起来。
请分析脱脂棉燃烧的原因________________________________________。
(2)实验2:取一支试管,向其中加入少量过氧化钠固体,然后加入少量蒸馏水,有气泡冒出,充分振荡后再滴入酚酞试液,溶液先变红后褪色。
提出问题:溶液为什么先变红,过了一会,红色又褪去了呢?
猜想:甲同学认为是氢氧化钠溶液与空气中的二氧化碳反应的缘故,该反应的离子方程式为________________
___________________。乙同学认为甲同学的猜想不正确,理由是碳酸钠溶液显碱性,也能使酚酞试液变红色。
查阅资料:
i.可以破坏酚酞的结构,使酚酞在碱性溶液中不能再显红色;
ii.NaOH溶液浓度过高,酚酞不变色或变色后迅速褪色。
设计实验方案:
①取少量褪色后的溶液于试管中,加入固体,若有气泡冒出,用_______检验该气体,则证明该反应过程中生成了_______(填化学式)使溶液褪色。
②另取少量褪色后的溶液于试管中,加入蒸馏水稀释,若溶液变红,则证明溶液褪色原因可能为__________________________。
(3)为进一步探究过氧化钠与水反应的实质,运用pH传感器、温度传感器、氧气传感器等仪器进行实验探究,得到如下图像。
根据图像,得出结论:过氧化钠与水反应过程的方程式为_____________________、_____________________。
参考答案
选择题:
1.B 2.C 3.C 4.B 5.D 6.C 7.B 8.A 9.A 10.B
11.C 12.B 13.B 14.B 15.C 16.A 17.C 18.C 19.B 20.D
非选择题:
21.(9分)
(1)11.9 (2分) 10.5(1分) b (1分)
(2)改用胶头滴管向容量瓶中逐滴滴入蒸馏水,至溶液凹液面最低点与刻度线相平 (2分)
(3)保证溶质全部转入容量瓶 (1分)
(4)b (1分)
(5)200(1分)
22.(10分)
(1)分液漏斗 (1分) (2分)
(2)浓硫酸 (1分)
(3)D中红色布条无明显变化,E中布条褪色 (1分)
(4)氧化 (1分)
(5)(2分)
(6)强 (1分) 5mol(1分)
23.(10分)
(1)、(2分)
(2) (2分)
(3)①过滤 (1分) 铜(或Cu)(1分) (1分)
②(1分)
③(2分)
24.(11分)
(1)反应产生氧气和放出热量 (2分)
(2)(2分)
①带火星的木条 (1分) (1分)
②生成的氢氧化钠溶液可能太浓(1分)
(3)(2分) (2分)
化学试题
说明:
1.本试卷分为选择题和非选择题两部分,考试时间90分钟,满分100分。
2.选择题答案用2B铅笔涂在答题卡上,非选择题用0.5mm黑色中性笔作答,答案
必须写在答题卡各题目指定区域内的相应位置。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 K 39 Pt 195
一、选择题:本题共20小题,每小题3分,共60分,每小题只有一个选项符合题意。
1.下列有关说法错误的是( )
A.烧制陶瓷、冶炼金属、酿造酒类都属于化学变化
B.青蒿素的提取使用乙醚,是因为其沸点比乙醇高
C.英国科学家道尔顿提出近代原子学说,为近代化学奠定基础
D.垃圾分类有利于资源的重新利用
2.古诗词是我国传统文化的瑰宝。下列诗词解读错误的是( )
A.“千锤万凿出深山,烈火焚烧若等闲”,涉及反应为分解反应
B.“错把陈醋当成墨,写尽半生纸上酸”,陈醋中的醋酸是电解质
C.“绳锯木断,水滴石穿”,该过程中一定不包含化学变化
D.“朝坛雾卷,曙岭烟沉”,雾有丁达尔现象是因为胶体粒子对光有散射作用
3.将一小块钠投入到盛有硫酸铜溶液的烧杯中,不可能观察到的现象是( )
A.钠熔成小球并浮在液面上四处游动
B.有气体生成,并发出“嵫嵫”声音
C.溶液底部有紫红色物质生成
D.溶液变浑浊,有蓝色沉淀生成
4.下列有关实验室安全说法错误的是( )
A.金属钠与皮肤接触会腐蚀皮肤,不可用手直接拿金属钠
B.二氧化碳不支持燃烧,金属钠着火可用二氧化碳灭火器扑灭
C.氯气有毒,有关氯气性质实验要在通风条件下进行
D.少量浓硫酸不慎溅到皮肤上,应立即用大量水冲洗
5.下列有关实验操作错误的是( )
A.用镊子取出钠块,用滤纸吸干表面的煤油,用小刀切下绿豆粒大小的钠进行实验
B.钠燃烧时,在上方罩一个干燥的小烧杯,可观察到烧杯内壁有淡黄色物质
C.闻气味时,稍打开集气瓶玻璃片,用手轻轻地扇动瓶口,使极少量气体飘进鼻孔
D.配制稀硫酸时,将浓硫酸用玻璃棒引流入容量瓶,待冷却至室温,加水至刻度线
6.下列有关钠及其化合物说法正确的是( )
A.自然界中存在单质钠
B.观察广口瓶中煤油底部的钠,表面为银白色
C.可作为呼吸面具或潜水艇中氧气的来源
D.等质量的和固体分别与足量稀硫酸反应,产生的量相等
7.下列实验操作或装置正确且能达到实验目的的是( )
A B C D
稀释浓硫酸 配置一定浓度的溶液 收集 用碳酸钠制取
8.在研究氯气性质时,取一瓶密封的新制氯水。下列有关研究氯水性质的程序及结论说法错误的是( )
A.对氯水进行导电性实验,发现氯水能导电,说明氯水是电解质
B.将氯水滴在蓝色石蕊试纸上,试纸先变红后褪色,说明溶液中存在和HClO
C.取适量氯水于试管中,滴入酸化的溶液,出现白色沉淀,说明溶液中存在
D.先将几滴稀盐酸滴到红色布条上,无明显现象,再将氯水滴在红色布条上,布条褪色,说明溶液中存在具有漂白性的HClO
9.下列反应中,属于氧化还原反应且既是氧化剂又是还原剂的是( )
A.
B.
C.
D.
10.下列关于物质分类都正确的一组是( )
选项 酸 碱 盐 碱性氧化物 酸性氧化物
A 盐酸 纯碱 食盐
B 硝酸 一水合氨 小苏打 MgO
C 醋酸 生石灰 氯化铵 CuO
D 硫酸 烧碱 硫酸氢钠 CO
11.顺铂(化学名称为顺二氯二氨合铂)是一种用于治疗癌症的药物,结构如图所示。已知一片顺铂药片所含顺铂的质量为,设为阿伏加德罗常数的值。下列说法错误的是( )
A.顺铂化学式为
B.顺铂的摩尔质量为
C.一片顺铂药片中顺铂所含H原子的数目为
D.相同条件下,等体积的HCl和所含的原子个数之比为1:2
12.逻辑推理是化学学习中常用的一种思维方式,以下推理中正确的是( )
A.单质都是由一种元素组成的,只含一种元素的物质一定是纯净物
B.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
C.酸都能电离出氢离子,能电离出氢离子的化合物一定是酸
D.酸性氧化物与碱反应生成盐和水,与碱反应生成盐和水的物质一定是酸性氧化物
13.离子方程式可以表达溶液中的反应。下列离子方程式错误的是( )
A.将绿豆粒大小的钠投入水中:
B.醋酸除去水垢中的碳酸钙:
C.84消毒液与洁厕灵混用:
D.溶液与少量澄清石灰水:
14.是一种高效水处理剂,实验室可通过以下反应制得:
。下列关于该反应说法正确的是( )
A.氧化剂是,发生氧化反应
B.被氧化的元素是碳
C.还原剂和还原产物的物质的量之比为1:1
D.当上述反应中消耗了时,转移的电子数约为
15.粗食盐中含有、、等杂质,实验室要除去食盐中的杂质,精制NaCl固体。下列操作不需要的是( )
A. B. C. D.
16.若表示阿伏加德罗常数的值。下列说法正确的是( )
A.与水完全反应时转移电子数为
B.相同条件下,He和的混合气体与等体积的所含原子数相等
C.0.1 mol铁与充分反应,转移的电子数为
D.溶液中含有个NaCl分子
17.常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明溶液中:、、、
B.加入锌粉产生的溶液中:、、、
C.酸性溶液中:、、、
D.使酚酞试剂显红色的溶液中:、、、
18.向溶液中滴入几滴酚酞溶液,将电导率传感器插入溶液中,然后匀速加入硫酸溶液,电导率与时间图像如图。下列说法错误的是( )
A.溶液由红色逐渐变为无色
B.a到b段电导率降低的原因是和浓度降低
C.电导率最低点的离子方程式为
D.b到c段溶液中和浓度增大,导电能力增强
19.常温常压下,将和装入密闭容器中,设为阿伏加德罗常数的值。下列说法正确的是( )
A.分子数目为
B.和氧原子数目比为2:3
C.混合气体的体积为22.4L
D.和所含质子数目比为5:4
20.下列实验操作、现象及所得结论均正确的是( )
选项 实验操作和现象 结论
A 向溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 溶液中一定含
B 向NaOH溶液中逐滴滴加饱和溶液,有红褐色物质生成 得到氢氧化铁胶体
C 将点燃的伸入到盛的集气瓶中,产生淡蓝色火焰,瓶口有白雾 能在中燃烧
D 向溶液中滴加酸性溶液,紫色褪去 具有还原性
二、根据题意填空、简答:共4道大题,40分,答案填写在答题卡上。
21.(9 分)现需要的稀盐酸,用实验室提供的浓盐酸进行配制,浓盐酸试剂瓶标签如图所示。回答下列问题:
盐酸 分子式:HCl 相对分子质量:36.5 密度: 质量分数:36.5%
(1)该浓盐酸的物质的量浓度为______。量取______mL。上述浓盐酸进行配制,应选用下列量筒中的________(填标号)。
a.10mL b.15mL c.25mL d.0mL
(2)配制操作步骤可分解为以下几步:
A.用量筒量取所需体积的浓盐酸,将其沿玻璃棒缓缓注入烧杯中,再向烧杯中加入少量蒸馏水,用玻璃棒慢慢搅动
B.将已恢复至室温的稀盐酸小心地用玻璃棒引流入250mL容量瓶
C.用约30mL蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液都注入容量瓶中
D.继续往容量瓶中加蒸馏水,至液面接近刻度线1~2cm
E.……
F.盖紧瓶塞,反复倾倒振荡,摇匀溶液
G.将配制好的稀盐酸倒入试剂瓶,贴上标签
步骤E为__________________________________________________________________。
(3)操作C的目的是__________________________________________________________。
(4)配制上述溶液时,下列操作会导致所配溶液的浓度偏高的是______(填标号)。
a.量筒量取浓盐酸读数时俯视
b.未等恢复至室温就转移
c.向容量瓶转移时,不慎将少量溶液洒到容量瓶外面
d.定容后加水过量,又从容量瓶中取出部分溶液,使液面降至刻度线
(5)某同学用所配制的稀盐酸滴到5.3g碳酸钠固体中,待固体全部反应,需该盐酸体积为______mL。
22.(10分)实验室用如下装置制取氯气,并进行性质实验。回答下列问题:
(1)仪器a的名称为_________,写出A中反应的化学方程式________________________。
(2)C中的试剂为_______________。
(3)能证明氯气无漂白性的现象是_____________________________________________。
(4)F处观察到棉花团变蓝色,说明氯气具有_______性(填“氧化”或“还原”)。
(5)写出G处尾气吸收的离子方程式____________________________。
(6)实验室还可用固体与浓盐酸常温下反应制备氯气:
。由此可判知氧化性比 ______(填“强”或“弱”),若有参加反应,则被氧化的HCl的物质的量为_______。
23.(10分)化学实验室某次实验产生的废液中可能含有大量的、、、、、等。设计实验进行鉴别,步骤如下:
①加入NaOH溶液产生蓝色沉淀;
②向①所得的溶液中滴加足量溶液,有白色沉淀生成;
③过滤,然后向所得白色沉淀中加入过量稀硝酸,沉淀无变化。
由此判断:
(1)该废液中确定存在的离子有__________________________。
(2)步骤①发生反应的离子方程式为__________________________。
(3)某兴趣小组要除去废液中确定的离子,并回收其中的金属,最后得到NaCl溶液。设计实验方案如下:
①操作1为_______,固体2为________,试剂d为________。
②溶液2所含溶质为________________________________________(填化学式)。
③写出加入试剂a的离子方程式_________________________________________。
24.(11分)某化学课外兴趣小组探究过氧化钠与水的反应,探究过程如下:
(1)实验1:向包有过氧化钠粉末的脱脂棉上滴水,脱脂棉燃烧起来。
请分析脱脂棉燃烧的原因________________________________________。
(2)实验2:取一支试管,向其中加入少量过氧化钠固体,然后加入少量蒸馏水,有气泡冒出,充分振荡后再滴入酚酞试液,溶液先变红后褪色。
提出问题:溶液为什么先变红,过了一会,红色又褪去了呢?
猜想:甲同学认为是氢氧化钠溶液与空气中的二氧化碳反应的缘故,该反应的离子方程式为________________
___________________。乙同学认为甲同学的猜想不正确,理由是碳酸钠溶液显碱性,也能使酚酞试液变红色。
查阅资料:
i.可以破坏酚酞的结构,使酚酞在碱性溶液中不能再显红色;
ii.NaOH溶液浓度过高,酚酞不变色或变色后迅速褪色。
设计实验方案:
①取少量褪色后的溶液于试管中,加入固体,若有气泡冒出,用_______检验该气体,则证明该反应过程中生成了_______(填化学式)使溶液褪色。
②另取少量褪色后的溶液于试管中,加入蒸馏水稀释,若溶液变红,则证明溶液褪色原因可能为__________________________。
(3)为进一步探究过氧化钠与水反应的实质,运用pH传感器、温度传感器、氧气传感器等仪器进行实验探究,得到如下图像。
根据图像,得出结论:过氧化钠与水反应过程的方程式为_____________________、_____________________。
参考答案
选择题:
1.B 2.C 3.C 4.B 5.D 6.C 7.B 8.A 9.A 10.B
11.C 12.B 13.B 14.B 15.C 16.A 17.C 18.C 19.B 20.D
非选择题:
21.(9分)
(1)11.9 (2分) 10.5(1分) b (1分)
(2)改用胶头滴管向容量瓶中逐滴滴入蒸馏水,至溶液凹液面最低点与刻度线相平 (2分)
(3)保证溶质全部转入容量瓶 (1分)
(4)b (1分)
(5)200(1分)
22.(10分)
(1)分液漏斗 (1分) (2分)
(2)浓硫酸 (1分)
(3)D中红色布条无明显变化,E中布条褪色 (1分)
(4)氧化 (1分)
(5)(2分)
(6)强 (1分) 5mol(1分)
23.(10分)
(1)、(2分)
(2) (2分)
(3)①过滤 (1分) 铜(或Cu)(1分) (1分)
②(1分)
③(2分)
24.(11分)
(1)反应产生氧气和放出热量 (2分)
(2)(2分)
①带火星的木条 (1分) (1分)
②生成的氢氧化钠溶液可能太浓(1分)
(3)(2分) (2分)
同课章节目录
