物质的量浓度
图片预览





文档简介
(共17张PPT)
第一章 第二节
1、定义:单位体积溶液中所含溶质B的物质的量
2、符号:C(B)
3、单位:mol/L 或 mol·L-1
4、计算公式:
C(B)=
n(B)
V
一、物质的量浓度 C(B)
例1、将40gNaOH溶解在1L水中,所得的溶液中溶质的物质的量浓度是否为1mol·L-1,V是指溶液体积,还是指溶剂(水)的体积?
例2、下列关于0.2mol/LBa(NO3)2溶液正确的说法是()
A.2L溶液中含有Ba+离子0.2mol
B.2L溶液中含有NO3-离子0.8mol
C.0.5L溶液中Ba2+离子的物质的量浓度为0.2mol/L
D.0.5L溶液中NO3-离子的物质的量浓度为0.2mol/L
B、C
二、物质的量浓度溶液的配制
例1: 怎样配制 1mol/L 的NaCl溶液100mL?
1、实验步骤
2、实验仪器
3、误差分析
(一)、步骤
计算:NaCl物质的量=1mol/L×0.1L=0.1mol m=5.85g
称量: 用托盘天平称出5.9gNaCl
溶解:在烧杯中用适量的蒸馏水(大约40毫升) 使之完全溶解(注意:应冷却,不可在容量瓶中溶解)
转移:将溶液转移入100mL容量瓶(用玻璃棒引流)
洗涤:将烧杯和玻璃棒洗涤2-3次,一并转移到容量瓶中
定容:加水到接近刻度2~3厘米时,改用胶头滴管加水到刻度.
摇匀:装入试剂瓶,贴标签
1、计算2、称量3、溶解4、转移5、洗涤6、定容7、摇匀
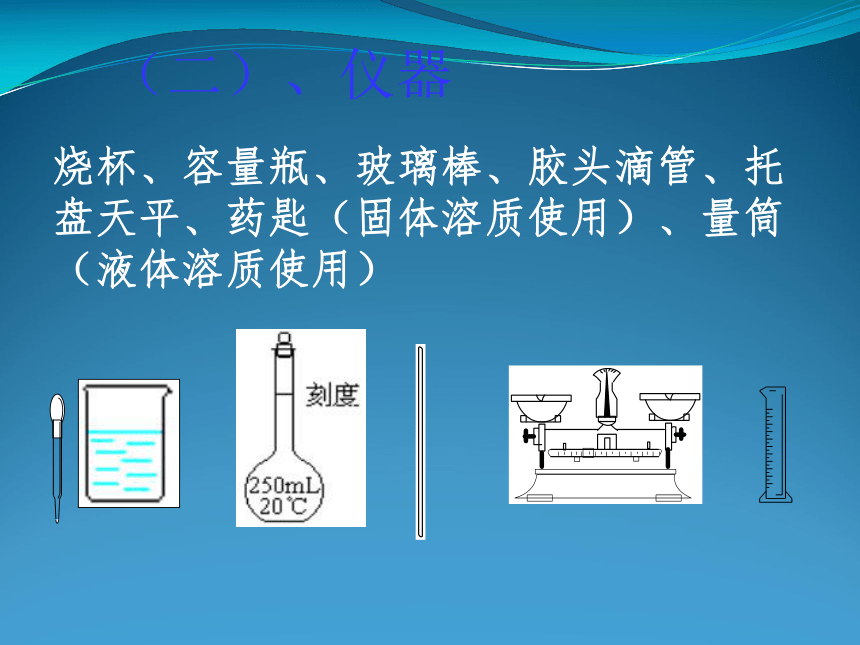
(二)、仪器
烧杯、容量瓶、玻璃棒、胶头滴管、托盘天平、药匙(固体溶质使用)、量筒(液体溶质使用)
配制一定物质的量浓度的溶液(以配制100ml , 1mol/L NaCl溶液为例)
步骤 仪器 与操作有关的问题
计算
称量
溶解 1. 为什么称量NaCl不是5.85g而是5.9g?
托盘天平
药匙 2. 如何称取一定质量的物质?
若是称取固体NaOH应如何称取?
烧杯
玻璃棒
3. 能否采用将5.9g NaCl溶解于100mL水中来制得?
4. 为何要用适量蒸馏水使NaCl溶解?
5. 怎样才能加速固体物质的溶解?
转移
洗涤
定容
摇匀 容量瓶
玻璃棒 6. 怎样选用容量瓶?
7. 为何要用蒸馏水将烧杯和玻璃棒洗涤 2~3次,并将洗涤液一并转移到容量瓶中?
胶头
滴管 8. 为什么加水至液面接近刻度线2~3cm处,改用胶头滴管加水?
9. 定容时,如何观察液面?
10. 加水超过刻度线,应怎样处理?
试剂瓶
(贴标签) 11. 反复摇匀、竖直容量瓶时出现液面低于刻度线,能否再补加水?
1、溶质物质的量的不确定性
2、溶液体积的不确定性
C(B)=
n(B)
V
根据上述公式推断实验过程中,误差来源于哪些方面 哪些操作可能引起溶液浓度的误差?
三、误差分析
可能影响溶液浓度的操作
固体药品的称量是否准确;
将溶液向容量瓶中转移时,溶液洒了;
未洗涤烧杯和玻璃棒;
定容时水加多了或加少了;
容量瓶中含有少量的水;
往容量瓶中加水时有少量加到瓶外;
定容时未平视刻度线;
俯视
仰视
俯视或仰视
俯视刻度线,
读数偏大,浓度偏大;
仰视刻度线,
读数偏小,浓度偏小
加水加少了
加水加多了
有一瓶18.4mol/L的硫酸溶液1L,现往里加水加到10L,请问,此溶液中H2SO4总的物质的量有没有变化?物质的量浓度有没有变化?如果有请计算出来。
n(H2SO4)浓=n (H2SO4)稀
C浓×V浓 = C稀×V稀
18.4mol/L×1L=C稀×10L
C稀=1.84mol/L
本质:稀释浓溶液时,溶液的体积要发生变化,但溶质的量(质量或物质的量)均不变
公式:C浓×V浓 = C稀×V稀
二、溶液的稀释
方法 分离的物质 应用举例
过滤 从液体中分离不溶的固体物质 除去粗盐中泥沙
蒸发 使溶液中的溶剂挥发出去,得到溶质 加热食盐水得到晶体
蒸馏 分离沸点不同的液体混合物 自来水制蒸馏水
萃取 用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来 CCl4从碘水中萃取碘
一、混合物的分离和提纯
1、离子检验SO42- 、Cl-、CO32-
2、分液:分离互不相溶的两种液体的方法
萃取剂的选择:(1)、 (2)、 (3)、
n
÷NA
×NA
×M
÷M
×22.4
(标况)
÷22.4
(标况)
N
m
V
(气体)
C
÷V
×V
二、N,n,m,V,C 之间的相互转化
三、阿伏加德罗定律:同T同P,同V同N
四、配制一定物质的量浓度的溶液
(1)步骤(2)仪器(3)误差分析
若溶质为固体或液体其仪器有什么区别?
称量:称时固体时用天平,量时液体用量筒。其余仪器一致。
欲配制1 mol/L的氢氧化钠溶液250mL,完成下列步骤:
①用天平称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。
10.0
烧杯
少量
冷却
玻璃棒
250
随堂检测一
③用少量蒸馏水冲洗 次,将冲洗液移入____ 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
④向容量瓶内加水至刻度线 时,改 用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度 ,应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入_____中并贴好标签。
随堂检测一
低
2~3厘米
胶头滴管
偏低
重新配制
摇匀
试剂瓶
2-3
容量瓶
例2、在标准状况下,350体积氨气溶于1体积水,得到0.92g / cm3的氨水,求此氨水的物质的量浓度(已知溶质为NH3)
14.13mol/L
第一章 第二节
1、定义:单位体积溶液中所含溶质B的物质的量
2、符号:C(B)
3、单位:mol/L 或 mol·L-1
4、计算公式:
C(B)=
n(B)
V
一、物质的量浓度 C(B)
例1、将40gNaOH溶解在1L水中,所得的溶液中溶质的物质的量浓度是否为1mol·L-1,V是指溶液体积,还是指溶剂(水)的体积?
例2、下列关于0.2mol/LBa(NO3)2溶液正确的说法是()
A.2L溶液中含有Ba+离子0.2mol
B.2L溶液中含有NO3-离子0.8mol
C.0.5L溶液中Ba2+离子的物质的量浓度为0.2mol/L
D.0.5L溶液中NO3-离子的物质的量浓度为0.2mol/L
B、C
二、物质的量浓度溶液的配制
例1: 怎样配制 1mol/L 的NaCl溶液100mL?
1、实验步骤
2、实验仪器
3、误差分析
(一)、步骤
计算:NaCl物质的量=1mol/L×0.1L=0.1mol m=5.85g
称量: 用托盘天平称出5.9gNaCl
溶解:在烧杯中用适量的蒸馏水(大约40毫升) 使之完全溶解(注意:应冷却,不可在容量瓶中溶解)
转移:将溶液转移入100mL容量瓶(用玻璃棒引流)
洗涤:将烧杯和玻璃棒洗涤2-3次,一并转移到容量瓶中
定容:加水到接近刻度2~3厘米时,改用胶头滴管加水到刻度.
摇匀:装入试剂瓶,贴标签
1、计算2、称量3、溶解4、转移5、洗涤6、定容7、摇匀
(二)、仪器
烧杯、容量瓶、玻璃棒、胶头滴管、托盘天平、药匙(固体溶质使用)、量筒(液体溶质使用)
配制一定物质的量浓度的溶液(以配制100ml , 1mol/L NaCl溶液为例)
步骤 仪器 与操作有关的问题
计算
称量
溶解 1. 为什么称量NaCl不是5.85g而是5.9g?
托盘天平
药匙 2. 如何称取一定质量的物质?
若是称取固体NaOH应如何称取?
烧杯
玻璃棒
3. 能否采用将5.9g NaCl溶解于100mL水中来制得?
4. 为何要用适量蒸馏水使NaCl溶解?
5. 怎样才能加速固体物质的溶解?
转移
洗涤
定容
摇匀 容量瓶
玻璃棒 6. 怎样选用容量瓶?
7. 为何要用蒸馏水将烧杯和玻璃棒洗涤 2~3次,并将洗涤液一并转移到容量瓶中?
胶头
滴管 8. 为什么加水至液面接近刻度线2~3cm处,改用胶头滴管加水?
9. 定容时,如何观察液面?
10. 加水超过刻度线,应怎样处理?
试剂瓶
(贴标签) 11. 反复摇匀、竖直容量瓶时出现液面低于刻度线,能否再补加水?
1、溶质物质的量的不确定性
2、溶液体积的不确定性
C(B)=
n(B)
V
根据上述公式推断实验过程中,误差来源于哪些方面 哪些操作可能引起溶液浓度的误差?
三、误差分析
可能影响溶液浓度的操作
固体药品的称量是否准确;
将溶液向容量瓶中转移时,溶液洒了;
未洗涤烧杯和玻璃棒;
定容时水加多了或加少了;
容量瓶中含有少量的水;
往容量瓶中加水时有少量加到瓶外;
定容时未平视刻度线;
俯视
仰视
俯视或仰视
俯视刻度线,
读数偏大,浓度偏大;
仰视刻度线,
读数偏小,浓度偏小
加水加少了
加水加多了
有一瓶18.4mol/L的硫酸溶液1L,现往里加水加到10L,请问,此溶液中H2SO4总的物质的量有没有变化?物质的量浓度有没有变化?如果有请计算出来。
n(H2SO4)浓=n (H2SO4)稀
C浓×V浓 = C稀×V稀
18.4mol/L×1L=C稀×10L
C稀=1.84mol/L
本质:稀释浓溶液时,溶液的体积要发生变化,但溶质的量(质量或物质的量)均不变
公式:C浓×V浓 = C稀×V稀
二、溶液的稀释
方法 分离的物质 应用举例
过滤 从液体中分离不溶的固体物质 除去粗盐中泥沙
蒸发 使溶液中的溶剂挥发出去,得到溶质 加热食盐水得到晶体
蒸馏 分离沸点不同的液体混合物 自来水制蒸馏水
萃取 用一种溶剂把溶质从它与另一种溶剂所组成的溶液中提取出来 CCl4从碘水中萃取碘
一、混合物的分离和提纯
1、离子检验SO42- 、Cl-、CO32-
2、分液:分离互不相溶的两种液体的方法
萃取剂的选择:(1)、 (2)、 (3)、
n
÷NA
×NA
×M
÷M
×22.4
(标况)
÷22.4
(标况)
N
m
V
(气体)
C
÷V
×V
二、N,n,m,V,C 之间的相互转化
三、阿伏加德罗定律:同T同P,同V同N
四、配制一定物质的量浓度的溶液
(1)步骤(2)仪器(3)误差分析
若溶质为固体或液体其仪器有什么区别?
称量:称时固体时用天平,量时液体用量筒。其余仪器一致。
欲配制1 mol/L的氢氧化钠溶液250mL,完成下列步骤:
①用天平称取氢氧化钠固体 克。
②将称好的氢氧化钠固体放入 中 加 蒸馏水将其溶解,待 后将溶液沿 移入 mL的容量瓶中。
10.0
烧杯
少量
冷却
玻璃棒
250
随堂检测一
③用少量蒸馏水冲洗 次,将冲洗液移入____ 中,在操作过程中不能损失点滴液体,否则会使溶液的浓度偏 (高或低)。
④向容量瓶内加水至刻度线 时,改 用 小心地加水至溶液凹液面与刻度线相切,若加水超过刻度线,会造成溶液浓度 ,应该 。
⑤最后盖好瓶盖, ,将配好的溶液移入_____中并贴好标签。
随堂检测一
低
2~3厘米
胶头滴管
偏低
重新配制
摇匀
试剂瓶
2-3
容量瓶
例2、在标准状况下,350体积氨气溶于1体积水,得到0.92g / cm3的氨水,求此氨水的物质的量浓度(已知溶质为NH3)
14.13mol/L
