2021-2022学年高一上学期化学人教版(2019)必修第一册第四章《物质结构元素周期律》测试题
文档属性
| 名称 | 2021-2022学年高一上学期化学人教版(2019)必修第一册第四章《物质结构元素周期律》测试题 |  | |
| 格式 | docx | ||
| 文件大小 | 231.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-18 14:24:47 | ||
图片预览



文档简介
第四章《物质结构元素周期律》测试题
一、单选题(共15题)
1.2019年,科学家合成了世界上第一个完全由碳原子构成的环状分子——,与互为同素异形体的是
A. B. C.石墨 D.
2.某元素原子的核外电子中,L层电子一定比K层电子
A.数目少 B.数目多 C.能量低 D.能量高
3.下列微粒半径比较正确的是
A. B. C. D.
4.甲醛(CH2O)是家庭装修后造成室内污染的主要有害气体。下面关于甲醛组成和构成的说法中正确的是
A.甲醛是由碳和水两种物质组成
B.甲醛是由碳、氢、氧三种元素组成
C.一个甲醛分子是由一个碳原子、一个氢分子和—个氧原子构成
D.甲醛是由—个碳元素、两个氢元素和—个氧元素组成
5.某恒星内部发生的一种核反应为X+HeY+H,X、Y为短周期元素,X的周期序数是其族序数的3倍。下列说法正确的是
A.Y的质量数为24 B.氦气中含有非极性键
C.简单离子半径大小关系:X>Y D.X、Y的氯化物水溶液均呈中性
6.第三周期元素X、Y、Z、W的最高价氧化物分别溶于水得溶液,0.010mol/L的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是
A.非金属性: B.简单离子半径:
C.气态氢化物的稳定性: D.含氧酸的酸性:
7.下列各对物质中,互为同位素的是
①、 ②、 ③、 ④金刚石、石墨 ⑤、 ⑥、。
A.①②③ B.③④⑤ C.②③ D.④⑤⑥
8.下列物质在生活中的应用与氧化还原反应无关的是
A.用明矾处理污水
B.还原Fe粉用作食品脱氧剂
C.FeSO4补血剂与维生素C配合使用效果更佳
D.用84消毒液杀灭细菌
9.短周期元素、、、的原子序数依次增大,、、原子的最外层电子数之和为11,与同族,最外层电子数等于次外层电子数,的单质晶体是应用最广泛的半导体材料。下列叙述错误的是
A.非金属性:
B.简单氢化物的沸点:
C.化合物中含有共价键
D.的单质可与的氧化物发生置换反应
10.短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述错误的是
A.化合物M中W不都满足8电子稳定结构
B.Y单质的熔点高于X单质
C.W的简单氢化物稳定性比Y的简单氢化物稳定性高
D.W、X、Z简单离子半径最小的是X
11.镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如图所示。下列判断不合理的是
A.Al、Ga的价层电子数相同
B.向GaCl3溶液中逐滴加入足量氨水,先生成沉淀,后沉淀溶解
C.金属镓可与NaOH溶液反应生成NaGaO2和氢气
D.酸性:Al(OH)312.设NA为阿伏加德罗常数的值。下列说法正确的是
A.0.1mol熔融KHSO4中含有的阳离子数目为0.2NA
B.常温常压下,32g2H2O中所含质子数为10NA
C.16g由和组成的混合物中氧原子的物质的量为0.5mol
D.标准状况下,中含有的共用电子对数目为2NA
13.下列化学用语或图示表达正确的是
A.次氯酸的结构式: B.异戊烷的空间充填模型:
C.乙醇的分子式: D.火碱的化学式:
14.硼有两种天然同位素B、B,硼元素的近似相对原子质量为10.8,则对B的质量分数的判断正确的是
A.20% B.略大于20% C.略小于20% D.80%1L
15.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同的电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A.简单离子半径:WC.气态氢化物的热稳定性:WZ
二、填空题(共8题)
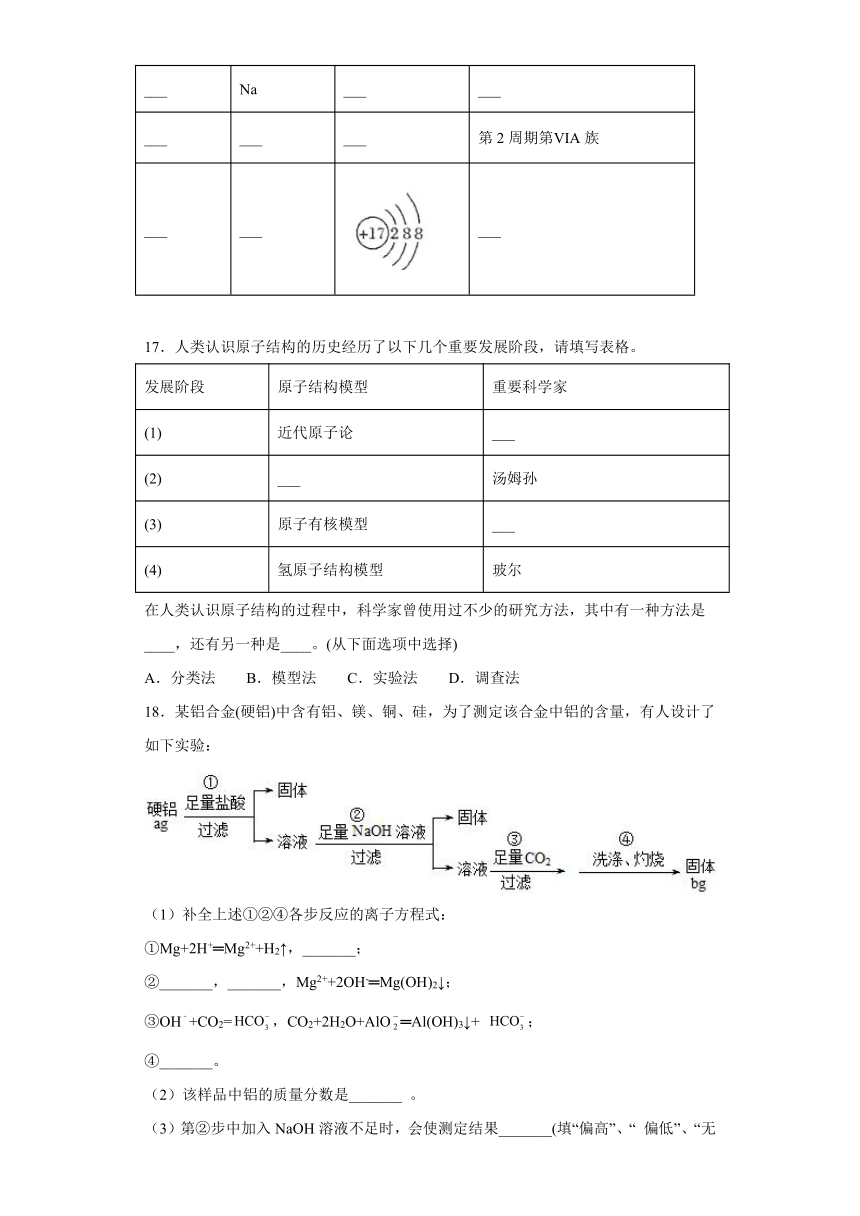
16.根据原子结构和元素周期表的关系补充完整下列表格。
原子序数 微粒符号 结构示意图 元素在周期表中的位置
2 ___ ___ ___
___ Na ___ ___
___ ___ ___ 第2周期第ⅥA族
___ ___ ___
17.人类认识原子结构的历史经历了以下几个重要发展阶段,请填写表格。
发展阶段 原子结构模型 重要科学家
(1) 近代原子论 ___
(2) ___ 汤姆孙
(3) 原子有核模型 ___
(4) 氢原子结构模型 玻尔
在人类认识原子结构的过程中,科学家曾使用过不少的研究方法,其中有一种方法是____,还有另一种是____。(从下面选项中选择)
A.分类法 B.模型法 C.实验法 D.调查法
18.某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:
(1)补全上述①②④各步反应的离子方程式:
①Mg+2H+═Mg2++H2↑,_______;
②_______,_______,Mg2++2OH-═Mg(OH)2↓;
③OH﹣+CO2=,CO2+2H2O+AlO═Al(OH)3↓+ ;
④_______。
(2)该样品中铝的质量分数是_______ 。
(3)第②步中加入NaOH溶液不足时,会使测定结果_______(填“偏高”、“ 偏低”、“无影响”,下同);第④步中的沉淀没有用蒸馏水洗涤时,会使测定结果_______;第④步对沉淀灼烧不充分时,会使测定结果_______。
19.下表为元素周期表的一部分,请参照① ⑥在表中的位置,回答下列问题。
族 周期 ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ① ②
3 ③ ④ ⑤ ⑥
(1)元素①的原子结构示意图为___________
(2)元素②、③形成离子的半径___________>___________(用离子符号填空)。
(3)元素⑤、⑥形成的气态氢化物稳定性___________>___________(用化学式填空)。
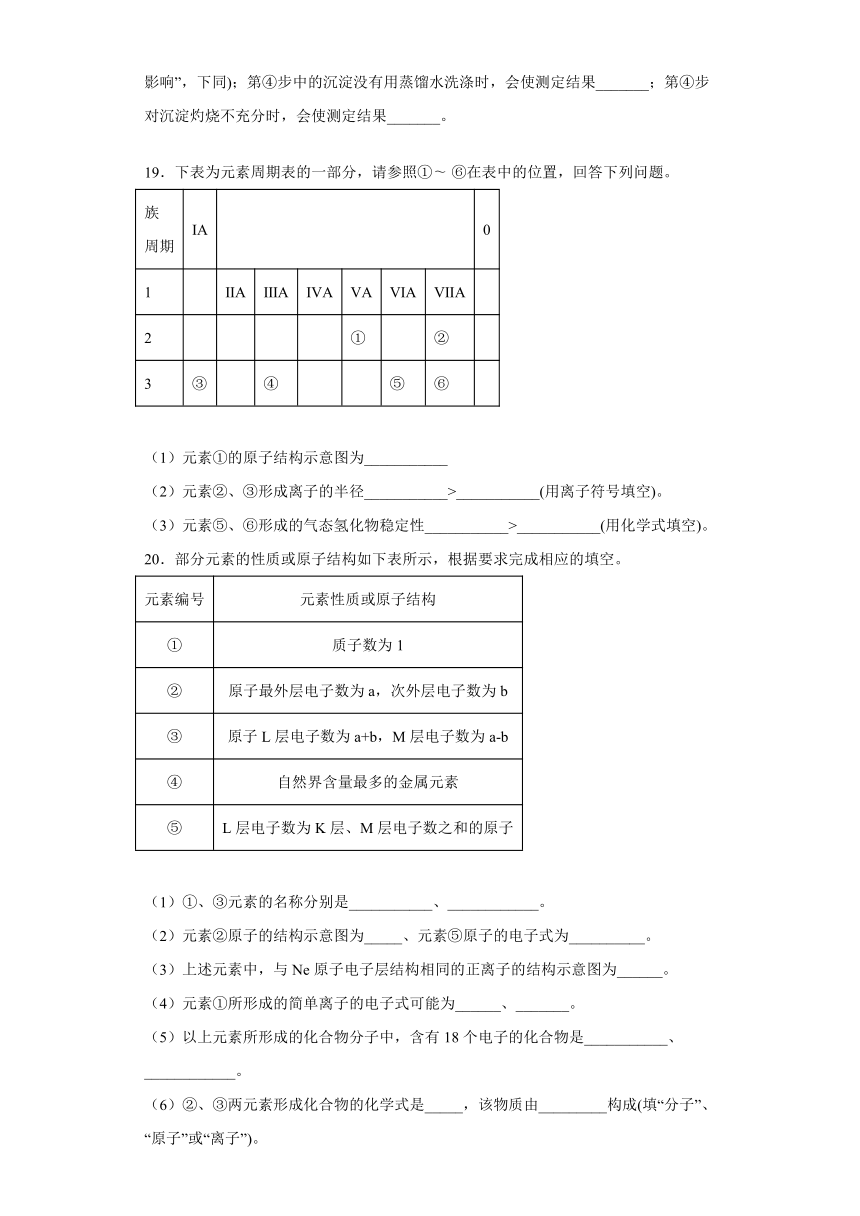
20.部分元素的性质或原子结构如下表所示,根据要求完成相应的填空。
元素编号 元素性质或原子结构
① 质子数为1
② 原子最外层电子数为a,次外层电子数为b
③ 原子L层电子数为a+b,M层电子数为a-b
④ 自然界含量最多的金属元素
⑤ L层电子数为K层、M层电子数之和的原子
(1)①、③元素的名称分别是___________、____________。
(2)元素②原子的结构示意图为_____、元素⑤原子的电子式为__________。
(3)上述元素中,与Ne原子电子层结构相同的正离子的结构示意图为______。
(4)元素①所形成的简单离子的电子式可能为______、_______。
(5)以上元素所形成的化合物分子中,含有18个电子的化合物是___________、____________。
(6)②、③两元素形成化合物的化学式是_____,该物质由_________构成(填“分子”、“原子”或“离子”)。
21.已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键,试推断:
(1)由以上元素中两两形成的化合物:
①溶于水显碱性的气态氢化物的结构式为___________
②含有非极性共价键的离子化合物的电子式为___________
(2)由X、Y、Z所形成的常见离子化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为___________
(3)Y、Z、W对应的离子半径由大到小的顺序为___________(用离子符号表示)。
22.将NaOH,MgCl2,AlCl3三种固体组成的混合物溶于足量水, 产生1.16g白色沉淀, 再向所得浊液中逐渐加入1.00 mol/L的盐酸, 加入盐酸的体积与生成沉淀的关系如下图:
请回答:
①A点溶液中溶质有___________(填化学式);
②写出加入盐酸体积由10.0mL到30.0mL发生反应的离子方程式________________;
③原混合物中MgCl2质量是_________, AlCl3物质的量是________, NaOH质量是______。
④C点消耗盐酸的体积为___________mL。
23.利用下列装置可进行物质或元素性质的探究实验。
I.验证氯、碳、硅元素的非金属性强弱
(1)已知圆底烧瓶B中装有Na2CO3固体,试管C中装有Na2SiO3溶液,装置连接顺序为A→B→C,则A中所装试剂的化学式是___________。
(2)仪器A的名称是___________。
(3)C装置中发生反应的离子方程式是___________。
(4)通过以上实验说明氯、碳、硅的非金属性依次减弱,其判断依据是___________。
II.通过置换反应验证氯、硫的非金属性强弱,设计装置连接顺序为A→B→C→D。
(1)C试管中盛装的溶液不能选择___________(填正确答案标号)。
a.硫化钠溶液 b.亚硫酸钠溶液 c.氢硫酸
(2)圆底烧瓶B中产生气体的化学方程式为___________。
(3)证明氯的非金属性比硫强的实验现象是___________。
(4)D装置的作用是___________。
参考答案
1.C 2.D 3.A 4.B 5.C 6.B 7.C 8.A 9.C 10.A 11.B 12.D 13.D 14.C 15.B
16.He 第1周期零族 11 第3周期第ⅠA族 8 O 17 Cl- 第3周期ⅦA族
17.道尔顿 葡萄干面包原子模型 卢瑟福 B C
18.
(1) 2Al+6H+═2Al3++3H2↑ H++OH-=H2O Al3++4OH-═AlO+2H2O 2A1(OH)3Al2O3+3H2O
(2)×100%
(3) 偏低 偏高 偏高
19.(1)
(2) F- Na+
(3) HCl H2S
20.(1) 氢 硅
(2)
(3)
(4) H+ [H:]-
(5) SiH4 H2S
(6) SiO2 原子
21.(1)
(2)+OH﹣NH3↑+H2O
(3)N3->O2->Na+
22.NaOH, NaAlO2 AlO2- +H+ +H2O ==Al(OH)3 1.9g 0.02mol 5.2g 130
23.HClO4 分液漏斗 或 元素的非金属性越强,最高价氧化物对应水化物的酸性越强 b C中溶液变浑浊或有淡黄色沉淀产生 吸收多余的氯气,防止空气污染
一、单选题(共15题)
1.2019年,科学家合成了世界上第一个完全由碳原子构成的环状分子——,与互为同素异形体的是
A. B. C.石墨 D.
2.某元素原子的核外电子中,L层电子一定比K层电子
A.数目少 B.数目多 C.能量低 D.能量高
3.下列微粒半径比较正确的是
A. B. C. D.
4.甲醛(CH2O)是家庭装修后造成室内污染的主要有害气体。下面关于甲醛组成和构成的说法中正确的是
A.甲醛是由碳和水两种物质组成
B.甲醛是由碳、氢、氧三种元素组成
C.一个甲醛分子是由一个碳原子、一个氢分子和—个氧原子构成
D.甲醛是由—个碳元素、两个氢元素和—个氧元素组成
5.某恒星内部发生的一种核反应为X+HeY+H,X、Y为短周期元素,X的周期序数是其族序数的3倍。下列说法正确的是
A.Y的质量数为24 B.氦气中含有非极性键
C.简单离子半径大小关系:X>Y D.X、Y的氯化物水溶液均呈中性
6.第三周期元素X、Y、Z、W的最高价氧化物分别溶于水得溶液,0.010mol/L的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是
A.非金属性: B.简单离子半径:
C.气态氢化物的稳定性: D.含氧酸的酸性:
7.下列各对物质中,互为同位素的是
①、 ②、 ③、 ④金刚石、石墨 ⑤、 ⑥、。
A.①②③ B.③④⑤ C.②③ D.④⑤⑥
8.下列物质在生活中的应用与氧化还原反应无关的是
A.用明矾处理污水
B.还原Fe粉用作食品脱氧剂
C.FeSO4补血剂与维生素C配合使用效果更佳
D.用84消毒液杀灭细菌
9.短周期元素、、、的原子序数依次增大,、、原子的最外层电子数之和为11,与同族,最外层电子数等于次外层电子数,的单质晶体是应用最广泛的半导体材料。下列叙述错误的是
A.非金属性:
B.简单氢化物的沸点:
C.化合物中含有共价键
D.的单质可与的氧化物发生置换反应
10.短周期主族元素W、X、Y、Z的原子序数依次增大,X的原子半径是所有短周期主族元素中最大的,W的核外电子数与X、Z的最外层电子数之和相等,Y的原子序数是Z的最外层电子数的2倍,由W、X、Y三种元素形成的化合物M的结构如图所示。下列叙述错误的是
A.化合物M中W不都满足8电子稳定结构
B.Y单质的熔点高于X单质
C.W的简单氢化物稳定性比Y的简单氢化物稳定性高
D.W、X、Z简单离子半径最小的是X
11.镓(Ga)与铝同主族,曾被称为“类铝”,其氧化物和氢氧化物均为两性化合物。工业制备镓的流程如图所示。下列判断不合理的是
A.Al、Ga的价层电子数相同
B.向GaCl3溶液中逐滴加入足量氨水,先生成沉淀,后沉淀溶解
C.金属镓可与NaOH溶液反应生成NaGaO2和氢气
D.酸性:Al(OH)3
A.0.1mol熔融KHSO4中含有的阳离子数目为0.2NA
B.常温常压下,32g2H2O中所含质子数为10NA
C.16g由和组成的混合物中氧原子的物质的量为0.5mol
D.标准状况下,中含有的共用电子对数目为2NA
13.下列化学用语或图示表达正确的是
A.次氯酸的结构式: B.异戊烷的空间充填模型:
C.乙醇的分子式: D.火碱的化学式:
14.硼有两种天然同位素B、B,硼元素的近似相对原子质量为10.8,则对B的质量分数的判断正确的是
A.20% B.略大于20% C.略小于20% D.80%1L
15.四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同的电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A.简单离子半径:W
二、填空题(共8题)
16.根据原子结构和元素周期表的关系补充完整下列表格。
原子序数 微粒符号 结构示意图 元素在周期表中的位置
2 ___ ___ ___
___ Na ___ ___
___ ___ ___ 第2周期第ⅥA族
___ ___ ___
17.人类认识原子结构的历史经历了以下几个重要发展阶段,请填写表格。
发展阶段 原子结构模型 重要科学家
(1) 近代原子论 ___
(2) ___ 汤姆孙
(3) 原子有核模型 ___
(4) 氢原子结构模型 玻尔
在人类认识原子结构的过程中,科学家曾使用过不少的研究方法,其中有一种方法是____,还有另一种是____。(从下面选项中选择)
A.分类法 B.模型法 C.实验法 D.调查法
18.某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验:
(1)补全上述①②④各步反应的离子方程式:
①Mg+2H+═Mg2++H2↑,_______;
②_______,_______,Mg2++2OH-═Mg(OH)2↓;
③OH﹣+CO2=,CO2+2H2O+AlO═Al(OH)3↓+ ;
④_______。
(2)该样品中铝的质量分数是_______ 。
(3)第②步中加入NaOH溶液不足时,会使测定结果_______(填“偏高”、“ 偏低”、“无影响”,下同);第④步中的沉淀没有用蒸馏水洗涤时,会使测定结果_______;第④步对沉淀灼烧不充分时,会使测定结果_______。
19.下表为元素周期表的一部分,请参照① ⑥在表中的位置,回答下列问题。
族 周期 ⅠA 0
1 ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
2 ① ②
3 ③ ④ ⑤ ⑥
(1)元素①的原子结构示意图为___________
(2)元素②、③形成离子的半径___________>___________(用离子符号填空)。
(3)元素⑤、⑥形成的气态氢化物稳定性___________>___________(用化学式填空)。
20.部分元素的性质或原子结构如下表所示,根据要求完成相应的填空。
元素编号 元素性质或原子结构
① 质子数为1
② 原子最外层电子数为a,次外层电子数为b
③ 原子L层电子数为a+b,M层电子数为a-b
④ 自然界含量最多的金属元素
⑤ L层电子数为K层、M层电子数之和的原子
(1)①、③元素的名称分别是___________、____________。
(2)元素②原子的结构示意图为_____、元素⑤原子的电子式为__________。
(3)上述元素中,与Ne原子电子层结构相同的正离子的结构示意图为______。
(4)元素①所形成的简单离子的电子式可能为______、_______。
(5)以上元素所形成的化合物分子中,含有18个电子的化合物是___________、____________。
(6)②、③两元素形成化合物的化学式是_____,该物质由_________构成(填“分子”、“原子”或“离子”)。
21.已知X、Y、Z、W四种元素分别是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键,试推断:
(1)由以上元素中两两形成的化合物:
①溶于水显碱性的气态氢化物的结构式为___________
②含有非极性共价键的离子化合物的电子式为___________
(2)由X、Y、Z所形成的常见离子化合物与W的最高价氧化物对应的水化物的浓溶液加热时反应的离子方程式为___________
(3)Y、Z、W对应的离子半径由大到小的顺序为___________(用离子符号表示)。
22.将NaOH,MgCl2,AlCl3三种固体组成的混合物溶于足量水, 产生1.16g白色沉淀, 再向所得浊液中逐渐加入1.00 mol/L的盐酸, 加入盐酸的体积与生成沉淀的关系如下图:
请回答:
①A点溶液中溶质有___________(填化学式);
②写出加入盐酸体积由10.0mL到30.0mL发生反应的离子方程式________________;
③原混合物中MgCl2质量是_________, AlCl3物质的量是________, NaOH质量是______。
④C点消耗盐酸的体积为___________mL。
23.利用下列装置可进行物质或元素性质的探究实验。
I.验证氯、碳、硅元素的非金属性强弱
(1)已知圆底烧瓶B中装有Na2CO3固体,试管C中装有Na2SiO3溶液,装置连接顺序为A→B→C,则A中所装试剂的化学式是___________。
(2)仪器A的名称是___________。
(3)C装置中发生反应的离子方程式是___________。
(4)通过以上实验说明氯、碳、硅的非金属性依次减弱,其判断依据是___________。
II.通过置换反应验证氯、硫的非金属性强弱,设计装置连接顺序为A→B→C→D。
(1)C试管中盛装的溶液不能选择___________(填正确答案标号)。
a.硫化钠溶液 b.亚硫酸钠溶液 c.氢硫酸
(2)圆底烧瓶B中产生气体的化学方程式为___________。
(3)证明氯的非金属性比硫强的实验现象是___________。
(4)D装置的作用是___________。
参考答案
1.C 2.D 3.A 4.B 5.C 6.B 7.C 8.A 9.C 10.A 11.B 12.D 13.D 14.C 15.B
16.He 第1周期零族 11 第3周期第ⅠA族 8 O 17 Cl- 第3周期ⅦA族
17.道尔顿 葡萄干面包原子模型 卢瑟福 B C
18.
(1) 2Al+6H+═2Al3++3H2↑ H++OH-=H2O Al3++4OH-═AlO+2H2O 2A1(OH)3Al2O3+3H2O
(2)×100%
(3) 偏低 偏高 偏高
19.(1)
(2) F- Na+
(3) HCl H2S
20.(1) 氢 硅
(2)
(3)
(4) H+ [H:]-
(5) SiH4 H2S
(6) SiO2 原子
21.(1)
(2)+OH﹣NH3↑+H2O
(3)N3->O2->Na+
22.NaOH, NaAlO2 AlO2- +H+ +H2O ==Al(OH)3 1.9g 0.02mol 5.2g 130
23.HClO4 分液漏斗 或 元素的非金属性越强,最高价氧化物对应水化物的酸性越强 b C中溶液变浑浊或有淡黄色沉淀产生 吸收多余的氯气,防止空气污染
