新疆维吾尔自治区呼图壁县第一高级中学2021-2022学年高二上学期期中考试化学试卷(Word版含答案)
文档属性
| 名称 | 新疆维吾尔自治区呼图壁县第一高级中学2021-2022学年高二上学期期中考试化学试卷(Word版含答案) |  | |
| 格式 | doc | ||
| 文件大小 | 630.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-18 14:30:52 | ||
图片预览


文档简介
呼图壁县第一高级中学2021-2022学年高二上学期期中考试
化学
分 值:100分 时 间:70分钟
1.选择题(每小题只有一个正确选项,16×3=48分)
1.下列能量的转化过程中,由化学能转化为电能的是
A B C D
太阳能照明 干电池工作 风力发电 天然气燃烧
A.A B.B C.C D.D
2.能源是人类生活和社会发展的基础。化学反应中,能量的测定和利用是关乎可持续发展的重要课题。下列相关叙述正确的是 ( )
A.已知氢气和氯气在混合光照时发生爆炸,而氢气在氯气中点燃能安静燃烧,说明在同温同压下,H2(g)+Cl2(g)=== 2HCl(g)的反应条件不同,ΔH不同
B.物质发生化学反应的反应热仅指反应放出的热量
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.热化学方程式C(s)+H2O(g)=CO(g)+H2(g) H=+131.3kJ mol-1表示1 mol碳和1 mol水反应生成一氧化碳和氢气,并吸收131.3 kJ热量
3.如图所示,有关化学反应和能量变化的说法正确的是
A.铝热反应属于氧化还原反应,故能量变化不符合该图
B.Ba(OH)2·8H2O晶体和NH4Cl晶体反应能量变化如图所示
C.符合该能量变化的化学反应均可用于设计成原电池
D.反应物总键能小于产物总键能的反应符合该图的能量变化
4.已知Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0,则下列关于该反应的叙述不正确的是( )
A.该反应中旧化学键断裂需要吸收能量,新化学键形成需要放出能量,所以总能量不变
B.上述热化学方程式中的ΔH的值与实验测定中反应物的用量无关
C.该反应的化学能可以转化为电能
D.反应物的总能量高于生成物的总能量
5.下列有关说法正确的是
A.已知HI(g) 1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol
HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
B.甲烷燃烧热的数值为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g) = CO2(g)+2H2O(g) △H=﹣890.3kJ·mol-1
C.已知2C(s)+2O2(g) = 2CO2(g) ΔH1,2C(s)+O2(g) = 2CO(g) ΔH2,则ΔH1<ΔH2
D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:
NaOH(aq)+CH3COOH(aq) =CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ/mol
6.下列关于中和反应反应热测定实验的说法不正确的是
A.简易量热计的隔热层是为了减少实验过程中的热量损失
B.向盛装酸的量热计内筒中加碱时要小心缓慢
C.使用玻璃搅拌器既可以搅拌又避免损坏温度计
D.测酸液温度后的温度计要用水清洗擦干后再测碱液的温度
7.如图所示是298 K时,A2与B2反应过程中能量变化的曲线图,下列叙述正确的是
A.每生成2 mol AB吸收bkJ热量
B.该反应的热化学方程式为
A2(g)+B2(g)=2AB(g) H= + (a-b) kJ mol-1
C.加入催化剂,反应的活化能和反应热都改变
D.断裂1 mol A-A和1 mol B-B键,放出a kJ能量
8.下列有关电池的说法不正确的是 ( )
A.原电池是将化学能转化为电能的装置 B.化学电源的反应基础是氧化还原反应
C.手机上用的锂离子电池属于二次电池 D.电池无法使用时可随意丢弃
9.在原电池和电解池的电极上所发生反应的类型相同的是( )
A.原电池的正极和电解池阳极 B.电解池阳极和电解池阴极
C.原电池负极和电解池阳极 D.原电池的正极和原电池负极
10.图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
A.铜棒的质量 B.c(Zn2+)
C.c(H+) D.c(SO)
11.镉镍可充电电池的充、放电反应按下式进行:
Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2,由此判断错误的是( )
A.放电时,Cd作负极 B.放电时,负极反应为Cd+2OH--2e-===Cd(OH)2
C.充电时,正极上发生氧化反应 D.充电时,电池中的阴离子往电池负极移动
12.利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( )
A.氯碱工业中,X电极上反应式是4OH--4e-===2H2O+O2↑
B.电解精炼铜时,Z溶液中的Cu2+浓度不变
C.在铁片上镀铜时,Y是纯铜
D.制取金属镁时,Z是熔融的氯化镁
13.用惰性电极电解(电解质足量)下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来完全一样的是( )
A.CuCl2(CuO) B.NaCl(HCl)
C.KNO3(KOH) D.CuSO4[Cu(OH)2]
14. 关于下列装置说法正确的是( )
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电流由Zn流向Fe,装置中有Fe2+生成
15.在一定条件下,将3molA和1molB两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)=xC(g)+2D(g)。2 min时测得生成0.8 mol D、0.4 mol C。下列判断不正确的是( )
A.x=1 B.2 min时,A的浓度为0.9mol·L-1
C.2 min内A的反应速率为0.3 mol·L-1·min-1 D.B的转化率为60%
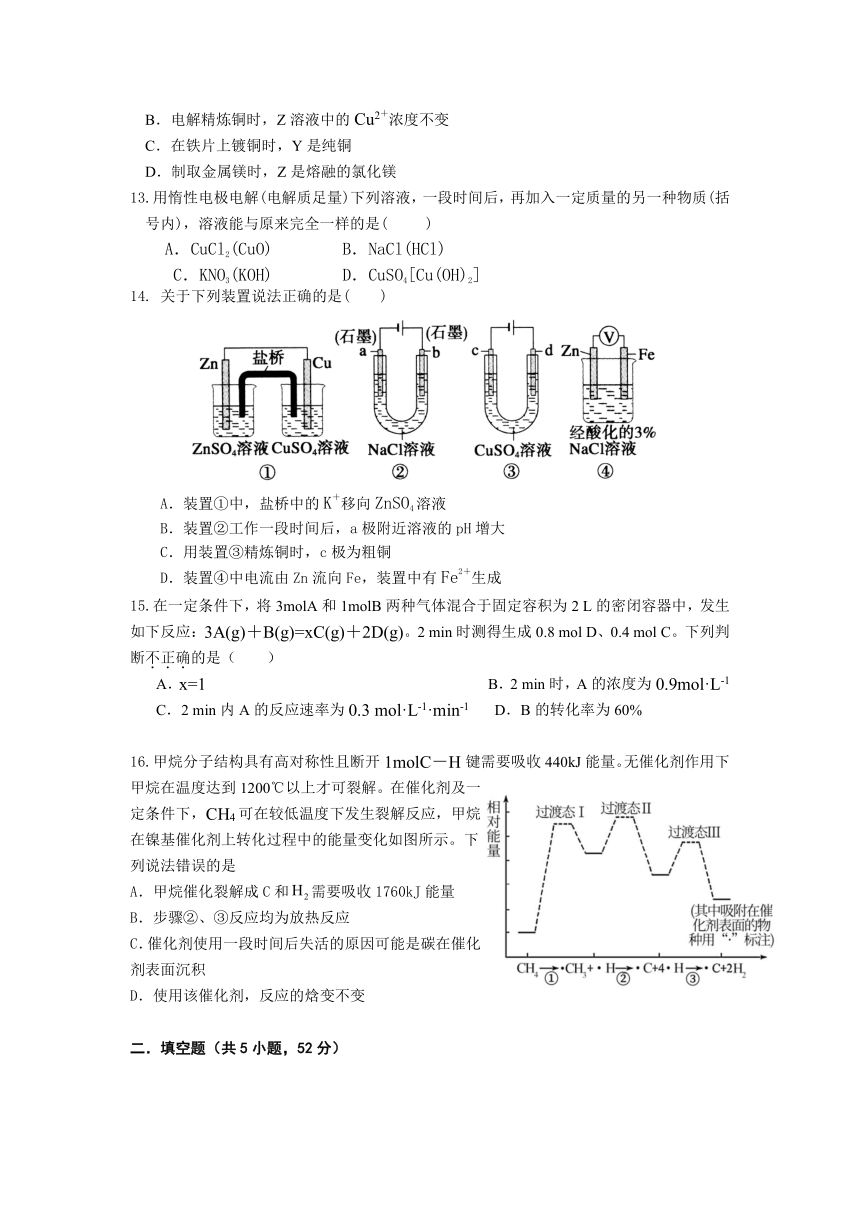
16.甲烷分子结构具有高对称性且断开1molC-H键需要吸收440kJ能量。无催化剂作用下甲烷在温度达到1200℃以上才可裂解。在催化剂及一定条件下,CH4可在较低温度下发生裂解反应,甲烷在镍基催化剂上转化过程中的能量变化如图所示。下列说法错误的是
A.甲烷催化裂解成C和需要吸收1760kJ能量
B.步骤②、③反应均为放热反应
C.催化剂使用一段时间后失活的原因可能是碳在催化剂表面沉积
D.使用该催化剂,反应的焓变不变
2.填空题(共5小题,52分)
17.(12分)如图1是反应A(g)+3B(g) 2C(g) ΔH=-akJ·mol-1在反应过程中的能量变化关系图,回答下列问题。
(1)由示意图知,反应物的总能量________(填“>”、“<”或“=”)生成物的总能量,此反应中反应物的总键能________________(填“>”、“<”或“=”)生成物的总键能。
(2)a=________________(用EC和EC,表示)。
(3)加入催化剂对该反应的ΔH 影响(填“有”或“无”)。
(4)已知:
2CH3OH(l)+2O2(g) 2CO(g)+4H2O(g)ΔH1=-a kJ·mol-1;
2CO(g)+O2(g) 2CO2(g) ΔH2=-b kJ·mol-1;
H2O(g) H2O(l) ΔH3=-c kJ· mol-1。
则表示CH3OH(l)燃烧热的热化学方程式为: 。
(5)工业上用H2(g)和Cl2(g)反应制HCl(g),各键能为H—H:436 kJ/mol,
Cl—Cl:243 kJ/mol,H—Cl:431 kJ/mol。该反应的热化学方程式是 。
(6)298 K时,0.5 mol C2H4(g)完全燃烧生成二氧化碳和液态水,放出705.5 kJ的热量。请写出表示C2H4(g)燃烧热的热化学方程式: 。
18.(10分)铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸,工作(放电)时该电池的总反应为Pb+PbO2+2H2SO4 2PbSO4+2H2O。试根据上述信息判断:
(1)铅蓄电池充电时和电源负极相连的材料是 。
(2)工作时,正极反应为 。
(3)工作时,电解质溶液的pH (填“增大”“减小”或“不变”)。
(4)工作时,电解质溶液中阴离子移向 极。
(5)电流从 (填化学式,下同)极流向 极。
19.(12分)某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
(1)通入氢气的电极为________(填“正极”或“负极”),负极的电极反应式为_______________。
(2)石墨电极为________(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,________(填“铁极”或“石墨极”)区的溶液先变红。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。精铜电极上的电极反应式为___________
20.(8分)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:
正极____________________________________________,
负极______________________________________________。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用甲图所示的方案,其中焊接在闸门上的固体材料R可以采用________。
A 铜 B 钠 C 锌 D 石墨
(3)乙图所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的________极。
21.(10分)(1)有机物M经过太阳光光照可转化成N,转化过程如下:
则M、N相比,较稳定的是________________。
(2)已知CH3OH(l)的燃烧热为726.5kJ·mol-1,CH3OH(l) + 3/2O2(g) ═ CO2(g) + 2H2O(g) △H=-a kJ·mol-1,则a_________726.5(填“>”、“<”或“=”)。
(3)下表是部分化学键的键能数据:
化学键 P-P P-O O=O P=O
键能/(kJ mol 1) a b c x
已知,白磷在空气中燃烧生产P4O10,白磷的燃烧热为d kJ mol 1,白磷(P4)、P4O10结构如右图所示,则上表中x=__________________。
(4)己知,氨的分解反应:的活化,合成氨有关化学键的键能如下表:
化学键 N—H
436 946 391
则合成氨反应:N2(g)+3H2(g)2NH3的活化能Ea=_______________。
(5)用O2将HCl转化为Cl2,可提高效益,减少污染。传统上该转化通过如下图所示的催化循环实现。
其中,反应①为2HCl(g) +CuO(s)H2O(g)+CuCl2(s) ΔH1,反应②生成1molCl2的反应热为ΔH2,则总反应的热化学方程式为_______________________________________
(反应热用ΔH1和ΔH2表示)
化学
分 值:100分 时 间:70分钟
1.选择题(每小题只有一个正确选项,16×3=48分)
1.下列能量的转化过程中,由化学能转化为电能的是
A B C D
太阳能照明 干电池工作 风力发电 天然气燃烧
A.A B.B C.C D.D
2.能源是人类生活和社会发展的基础。化学反应中,能量的测定和利用是关乎可持续发展的重要课题。下列相关叙述正确的是 ( )
A.已知氢气和氯气在混合光照时发生爆炸,而氢气在氯气中点燃能安静燃烧,说明在同温同压下,H2(g)+Cl2(g)=== 2HCl(g)的反应条件不同,ΔH不同
B.物质发生化学反应的反应热仅指反应放出的热量
C.应用盖斯定律,可计算某些难以直接测量的反应焓变
D.热化学方程式C(s)+H2O(g)=CO(g)+H2(g) H=+131.3kJ mol-1表示1 mol碳和1 mol水反应生成一氧化碳和氢气,并吸收131.3 kJ热量
3.如图所示,有关化学反应和能量变化的说法正确的是
A.铝热反应属于氧化还原反应,故能量变化不符合该图
B.Ba(OH)2·8H2O晶体和NH4Cl晶体反应能量变化如图所示
C.符合该能量变化的化学反应均可用于设计成原电池
D.反应物总键能小于产物总键能的反应符合该图的能量变化
4.已知Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH<0,则下列关于该反应的叙述不正确的是( )
A.该反应中旧化学键断裂需要吸收能量,新化学键形成需要放出能量,所以总能量不变
B.上述热化学方程式中的ΔH的值与实验测定中反应物的用量无关
C.该反应的化学能可以转化为电能
D.反应物的总能量高于生成物的总能量
5.下列有关说法正确的是
A.已知HI(g) 1/2H2(g)+1/2I2(s) ΔH=-26.5 kJ·mol-1,由此可知1 mol
HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
B.甲烷燃烧热的数值为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g) = CO2(g)+2H2O(g) △H=﹣890.3kJ·mol-1
C.已知2C(s)+2O2(g) = 2CO2(g) ΔH1,2C(s)+O2(g) = 2CO(g) ΔH2,则ΔH1<ΔH2
D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:
NaOH(aq)+CH3COOH(aq) =CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ/mol
6.下列关于中和反应反应热测定实验的说法不正确的是
A.简易量热计的隔热层是为了减少实验过程中的热量损失
B.向盛装酸的量热计内筒中加碱时要小心缓慢
C.使用玻璃搅拌器既可以搅拌又避免损坏温度计
D.测酸液温度后的温度计要用水清洗擦干后再测碱液的温度
7.如图所示是298 K时,A2与B2反应过程中能量变化的曲线图,下列叙述正确的是
A.每生成2 mol AB吸收bkJ热量
B.该反应的热化学方程式为
A2(g)+B2(g)=2AB(g) H= + (a-b) kJ mol-1
C.加入催化剂,反应的活化能和反应热都改变
D.断裂1 mol A-A和1 mol B-B键,放出a kJ能量
8.下列有关电池的说法不正确的是 ( )
A.原电池是将化学能转化为电能的装置 B.化学电源的反应基础是氧化还原反应
C.手机上用的锂离子电池属于二次电池 D.电池无法使用时可随意丢弃
9.在原电池和电解池的电极上所发生反应的类型相同的是( )
A.原电池的正极和电解池阳极 B.电解池阳极和电解池阴极
C.原电池负极和电解池阳极 D.原电池的正极和原电池负极
10.图1是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
A.铜棒的质量 B.c(Zn2+)
C.c(H+) D.c(SO)
11.镉镍可充电电池的充、放电反应按下式进行:
Cd+2NiO(OH)+2H2O Cd(OH)2+2Ni(OH)2,由此判断错误的是( )
A.放电时,Cd作负极 B.放电时,负极反应为Cd+2OH--2e-===Cd(OH)2
C.充电时,正极上发生氧化反应 D.充电时,电池中的阴离子往电池负极移动
12.利用如图所示装置模拟电解原理在工业生产上的应用。下列说法正确的是( )
A.氯碱工业中,X电极上反应式是4OH--4e-===2H2O+O2↑
B.电解精炼铜时,Z溶液中的Cu2+浓度不变
C.在铁片上镀铜时,Y是纯铜
D.制取金属镁时,Z是熔融的氯化镁
13.用惰性电极电解(电解质足量)下列溶液,一段时间后,再加入一定质量的另一种物质(括号内),溶液能与原来完全一样的是( )
A.CuCl2(CuO) B.NaCl(HCl)
C.KNO3(KOH) D.CuSO4[Cu(OH)2]
14. 关于下列装置说法正确的是( )
A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电流由Zn流向Fe,装置中有Fe2+生成
15.在一定条件下,将3molA和1molB两种气体混合于固定容积为2 L的密闭容器中,发生如下反应:3A(g)+B(g)=xC(g)+2D(g)。2 min时测得生成0.8 mol D、0.4 mol C。下列判断不正确的是( )
A.x=1 B.2 min时,A的浓度为0.9mol·L-1
C.2 min内A的反应速率为0.3 mol·L-1·min-1 D.B的转化率为60%
16.甲烷分子结构具有高对称性且断开1molC-H键需要吸收440kJ能量。无催化剂作用下甲烷在温度达到1200℃以上才可裂解。在催化剂及一定条件下,CH4可在较低温度下发生裂解反应,甲烷在镍基催化剂上转化过程中的能量变化如图所示。下列说法错误的是
A.甲烷催化裂解成C和需要吸收1760kJ能量
B.步骤②、③反应均为放热反应
C.催化剂使用一段时间后失活的原因可能是碳在催化剂表面沉积
D.使用该催化剂,反应的焓变不变
2.填空题(共5小题,52分)
17.(12分)如图1是反应A(g)+3B(g) 2C(g) ΔH=-akJ·mol-1在反应过程中的能量变化关系图,回答下列问题。
(1)由示意图知,反应物的总能量________(填“>”、“<”或“=”)生成物的总能量,此反应中反应物的总键能________________(填“>”、“<”或“=”)生成物的总键能。
(2)a=________________(用EC和EC,表示)。
(3)加入催化剂对该反应的ΔH 影响(填“有”或“无”)。
(4)已知:
2CH3OH(l)+2O2(g) 2CO(g)+4H2O(g)ΔH1=-a kJ·mol-1;
2CO(g)+O2(g) 2CO2(g) ΔH2=-b kJ·mol-1;
H2O(g) H2O(l) ΔH3=-c kJ· mol-1。
则表示CH3OH(l)燃烧热的热化学方程式为: 。
(5)工业上用H2(g)和Cl2(g)反应制HCl(g),各键能为H—H:436 kJ/mol,
Cl—Cl:243 kJ/mol,H—Cl:431 kJ/mol。该反应的热化学方程式是 。
(6)298 K时,0.5 mol C2H4(g)完全燃烧生成二氧化碳和液态水,放出705.5 kJ的热量。请写出表示C2H4(g)燃烧热的热化学方程式: 。
18.(10分)铅蓄电池是化学电源,其电极材料分别是Pb和PbO2,电解质溶液为稀硫酸,工作(放电)时该电池的总反应为Pb+PbO2+2H2SO4 2PbSO4+2H2O。试根据上述信息判断:
(1)铅蓄电池充电时和电源负极相连的材料是 。
(2)工作时,正极反应为 。
(3)工作时,电解质溶液的pH (填“增大”“减小”或“不变”)。
(4)工作时,电解质溶液中阴离子移向 极。
(5)电流从 (填化学式,下同)极流向 极。
19.(12分)某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
根据要求回答相关问题:
(1)通入氢气的电极为________(填“正极”或“负极”),负极的电极反应式为_______________。
(2)石墨电极为________(填“阳极”或“阴极”),反应一段时间后,在乙装置中滴入酚酞溶液,________(填“铁极”或“石墨极”)区的溶液先变红。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将________(填“增大”“减小”或“不变”)。精铜电极上的电极反应式为___________
20.(8分)钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的四分之一。
(1)钢铁腐蚀主要是吸氧腐蚀,该腐蚀过程中的电极反应式为:
正极____________________________________________,
负极______________________________________________。
(2)为了降低某水库的铁闸门被腐蚀的速率,可以采用甲图所示的方案,其中焊接在闸门上的固体材料R可以采用________。
A 铜 B 钠 C 锌 D 石墨
(3)乙图所示的方案也可以降低铁闸门的腐蚀速率,其中铁闸门应该连接在直流电源的________极。
21.(10分)(1)有机物M经过太阳光光照可转化成N,转化过程如下:
则M、N相比,较稳定的是________________。
(2)已知CH3OH(l)的燃烧热为726.5kJ·mol-1,CH3OH(l) + 3/2O2(g) ═ CO2(g) + 2H2O(g) △H=-a kJ·mol-1,则a_________726.5(填“>”、“<”或“=”)。
(3)下表是部分化学键的键能数据:
化学键 P-P P-O O=O P=O
键能/(kJ mol 1) a b c x
已知,白磷在空气中燃烧生产P4O10,白磷的燃烧热为d kJ mol 1,白磷(P4)、P4O10结构如右图所示,则上表中x=__________________。
(4)己知,氨的分解反应:的活化,合成氨有关化学键的键能如下表:
化学键 N—H
436 946 391
则合成氨反应:N2(g)+3H2(g)2NH3的活化能Ea=_______________。
(5)用O2将HCl转化为Cl2,可提高效益,减少污染。传统上该转化通过如下图所示的催化循环实现。
其中,反应①为2HCl(g) +CuO(s)H2O(g)+CuCl2(s) ΔH1,反应②生成1molCl2的反应热为ΔH2,则总反应的热化学方程式为_______________________________________
(反应热用ΔH1和ΔH2表示)
同课章节目录
