安徽省卓越县中联盟2021-2022学年高二上学期期中联考化学试题(Word版含解析)
文档属性
| 名称 | 安徽省卓越县中联盟2021-2022学年高二上学期期中联考化学试题(Word版含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-11-18 14:40:17 | ||
图片预览




文档简介
安徽省卓越县中联盟2021-2022学年高二上学期期中联考
化学试题
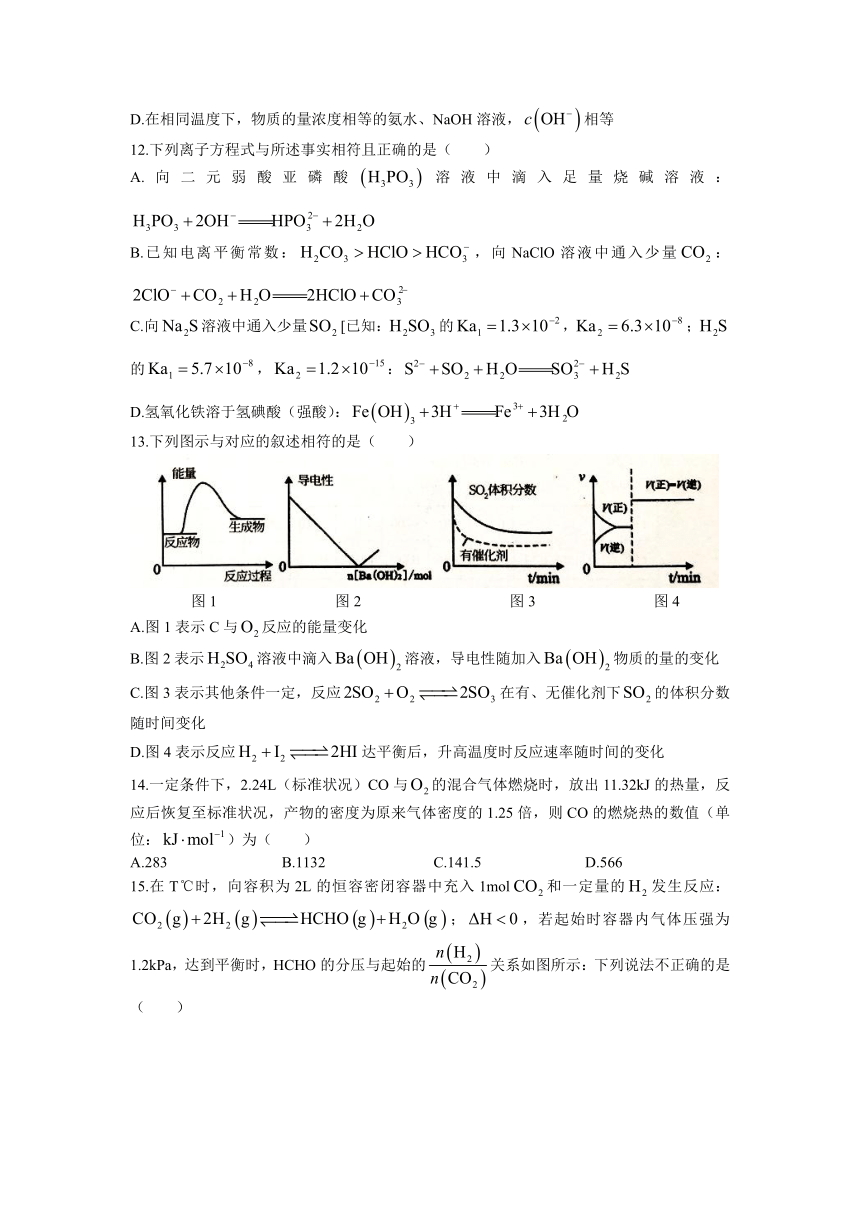
满分:100分 时间:90分钟
第Ⅰ卷(选择题)
一、单选题(本小题包括16小题,每小题3分,共48分)
1.下列属于强电解质的是( )
A.CaO B. C. D.
2.在反应中,表示该反应速率最快的是( )
A. B.
C. D.
3.工业上利用与反应制取,下列措施不能加快该反应的反应速率的是( )
A.升高温度 B.缩小体积,增大压强
C.使用催化剂 D.将及时分离
4.下列对化学平衡移动理解错误的是( )
A.化学反应速率改变,平衡一定发生移动
B.化学平衡发生移动,化学反应速率一定改变
C.若外界条件改变引起平衡中,则平衡正向移动
D.化学平衡移动会导致反应物或生成物的含量发生变化
5.NO与CO是燃油汽车尾气中的两种有害气体,常温常压下它们之间的反应:
;,反应速率较小。有关该反应的说法正确的是( )
A.K很大,NO与CO在排入大气之前就已反应完全
B.增大压强,平衡将向右移动,
C.升高温度,既增大反应速率又增大K
D.选用适宜催化剂可达到尾气排放标准
6.我国某科研团队研究了一种利用半导体光催化还原氮气制备氨气的方法,该方法因具有高效、清洁的优点而引起极大关注,其过程示意图如图所示。下列说法错误的是( )
A.该过程LDH为催化剂
B.该过程表明,氮气和氢气反应合成氨,
C.该过程中总反应的化学方程式为
D.工业上可采用低温精馏法从空气中分离回收
7.下列说法正确的是( )
A.,其他条件不变,缩小反应容器体积,正逆反应速率不变
B.若压强不再随时间变化能说明反应已达平衡,则A、C不能同时是气体
C.,碳的质量不再改变说明反应已达平衡
D.1mol和3mol反应达到平衡时转化率为10%,放出的热量为;在相同温度和压强下,2mol分解为和的转化率为10%时,吸收的热量为,不等于
8.在测定中和热的实验中,下列说法正确的是( )
A.使用玻璃搅拌器是为了加大反应速率减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.用50mL的NaOH溶液与的盐酸反应,测得的中和热数值偏大
D.在测定中和热实验中需要使用的仪器有:天平、量简、烧杯、温度计、玻璃棒
9一定温度下:在的四氯化碳溶液(100mL)中发生分解反应:。在不同时刻测量放出的体积,换算成,浓度如下表:
t/s 0 600 1200 1710 2220 2820
1.40 0.96 0.66 0.48 0.35 0.24 0.12
下列说法正确的是( )
A.600~1200s,生成的平均速率为
B.反应2220s时,放出的体积为11.8L(标准状况)
C.反应达到平衡时,
D.推测上表中的x为3930
10.下列说法正确的是( )
A.在常温下可自发进行,则该反应的
B.一定条件下反应达到平衡时,
C.向溶液中加入少量水,溶液中比值减小
D.与足量的水反应生成,转移电子数目为0.8
11.下列说法正确的是( )
A.在合成氨工业中,移走可增大正反应速率,提高原料转化率
B.恒温下进行的反应达平衡时,缩小容器体积再达平衡时,气体的
颜色比第一次平衡时的深,的体积分数比原平衡大
C.常温下,)不能自发进行,则其
D.在相同温度下,物质的量浓度相等的氨水、NaOH溶液,相等
12.下列离子方程式与所述事实相符且正确的是( )
A.向二元弱酸亚磷酸溶液中滴入足量烧碱溶液:
B.已知电离平衡常数:,向NaClO溶液中通入少量:
C.向溶液中通入少量[已知:的,;的,:
D.氢氧化铁溶于氢碘酸(强酸):
13.下列图示与对应的叙述相符的是( )
图1 图2 图3 图4
A.图1表示C与反应的能量变化
B.图2表示溶液中滴入溶液,导电性随加入物质的量的变化
C.图3表示其他条件一定,反应在有、无催化剂下的体积分数随时间变化
D.图4表示反应达平衡后,升高温度时反应速率随时间的变化
14.一定条件下,2.24L(标准状况)CO与的混合气体燃烧时,放出11.32kJ的热量,反应后恢复至标准状况,产物的密度为原来气体密度的1.25倍,则CO的燃烧热的数值(单位:)为( )
A.283 B.1132 C.141.5 D.566
15.在T℃时,向容积为2L的恒容密闭容器中充入1mol和一定量的发生反应:;,若起始时容器内气体压强为1.2kPa,达到平衡时,HCHO的分压与起始的关系如图所示:下列说法不正确的是( )
A.b点的化学平衡常数
B.容器内的体积分数保持不变,说明达到平衡状态
C.若5min到达c点,则
D.c点时,再加入和,使二者分压均增大0.05kPa,转化率增大
16.有相同体积pH均为3的醋酸和盐酸,下列说法正确的是( )
A.稀释10倍后,两者的pH变化醋酸等于盐酸
B.中和相同浓度的氢氧化钠溶液,消耗氢氧化钠的物质的量盐酸大于醋酸
C.加入一定量的锌粉,产生气体的体积相同,则醋酸一定过量
D.加入足量的锌粉,产生氢气的速率随时间的变化如图
第Ⅱ卷(非选择题)
二、填空题(本大题包括4小题,共52分)
17.(共12分)回答下列问题
Ⅰ.(每空1分)一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。
(1)a、b、c三点溶液的pH大小关系:______。
(2)a、b、C三点的电离程度大小关系:______。
(3)a.b、c三点溶液用NaOH溶液中和,消耗NaOH溶液体积大小关系:______。
Ⅱ.(每空1分)锌粉与稀硫酸反应产生氢气的体积时间关系如下图所示,选择正确的选项填空。
A. B. C. D.
(4)将等质量的两份锌粉a、b分别加入过量的稀硫酸中,同时向a中加入少量的溶液,产生的体积V(L)与时间t(min)的关系是______。
(5)将过量的两份锌粉a、b分别加入定量的稀硫酸,同时向a中加入少量的溶液,产生的体积V(L)与时间t(min)的关系是______。
(6)将(5)中的溶液改成溶液,其他条件不变,则图像是______。
Ⅲ.(每空2分)工业废水中常含有一定量的和,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种,其中一种是还原沉淀法,该法的工艺流程为:
其中第①步存在平衡:
(1)向平衡体系滴加少量浓,则溶液显______色。
(2)能说明第①步反应达平衡状态的是______。
a.和的浓度相同 b.
c.溶液的颜色不变
(3)第②步中,还原1mol离子,需要______mol的。
18.(每空2分,共12分)向某恒容密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下发生如下反应:,各物质的浓度随时间变化如图所示[t0~t1阶段的c(B)变化未画出]。
(1)若t1=15s,用A的浓度变化表示阶段的平均反应速率为,t1时A的转化率为______。
(2)由图可知t0时,加入B的物质的量为______mol,若在t1时,将容器体积变为1L,则此时c(A)=______mol/L
(3)若在相同体积的容器中,加入0.14molB和0.3molC,在相同的条件下发生反应,达平衡后A的物质的量浓度为______mol/L。
(4)若在同条件,同体积容器中加入a molA、0.08molB和0.18molC,平衡后A的物质的量浓度与(3)相同,则a=______。
19.(除标注外每空2分,共17分)砷(As)是第四周期ⅤA族元素,可以形成、、、等化合物,有着广泛的用途。回答下列问题:
(1)工业上常将含砷废渣(主要成分为)制成浆状,通入氧化,生成和单质硫。写出发生反应的化学方程式______。
(2)已知:
则反应的______;
(3)298K时,将、和20mLNaOH溶液混合,发生反应:。溶液中与反应时间(t)的关系如图所示。
①下列不可判断反应达到平衡的是______(填标号);
a.溶液的pH不再变化 b.
C.不再变化 d.
②时______时(填“>” “<”或“=”);
③(3分)若平衡时溶液的,则该反应的化学平衡常数K=______。(用含x、y的式子表示);
(3)和水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题图-1和题图-2所示:
图-1 图-2
①(3分)以酚酞为指示剂(变色范围pH8.0~10.0),将NaOH溶液逐滴加入到溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为______;
②(3分)第一步电离方程式的电离常数为,则______;
20.(除标注外每空2分,共11分)2019年国际非政府组织“全球碳计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋缓。的综合利用是解决温室问题的有效途径。
(1)甲烷化反应是由法国化学家PaulSabatier提出的。催化氢化制甲烷的研究过程如图所示:
①上述过程中,产生反应的化学方程式为______。
②HCOOH是转化为的中间体:
当镍粉用量增加10倍后,甲酸的产量迅速减少。当增加镍粉用量时,镍催化氢化制甲烷的两步发应中反应速率增加较大的一步是______(填“Ⅰ”或“Ⅱ”)。
(2)经催化加氢可以生成低碳烃,主要有两个竞争反应:
反应Ⅰ:
反应Ⅱ:
在1L恒容密闭容器中充入1mol和4mol,测得平衡时有关物质的物质的量随温度变化如图(1)所示。
图(1) 图(2)
T1℃时,的转化率为______。T1℃时,反应Ⅰ的平衡常数K=______。
(3)(3分)已知催化加氢合成乙醇的反应原理为 。m代表起始时的投料比,即。m=3时,该反应达到平衡状态后,恒压条件下改变温度,各物质的物质的量分数与温度的关系如图(2)。温度时,反应达到平衡时物质d的分压p(d)=______Mpa。
安徽省卓越县中联盟2021—2022学年度第一学期
高二年级期中联考化学试题解析
一、单选题(每题3分,共16小题)
题号 1 2 3 4 5 6 7 8
答案 A A D A D B C A
题号 9 10 11 12 13 14 15 16
答案 D C C A B A C C
1.【答案】A
A.CaO是离子化合物,在熔融状态下能够发生电离而导电,属于电解质,是强电解质,A符合题意;
B.是单质,不是化合物,因此不属于电解质,也不属于非电解质,B不符合题意;
C.是共价化合物,在水溶液中能够电离产生自由移动的离子而导电,属于电解质;由于只能部分电离,存在电离平衡,因此属于弱电解质,C不符合题意;
D.是化合物,由于只能微弱的电离产生自由移动的离子,因此属于弱电解质,D不符合题意;
2.【答案】A
反应速率大小的比较,要统一单位,化成同一物质表达的速率后,比较数值大小即可;反应速率之比等于化学计量数之比。
A.;
B.,用A物质表达的速率是;
C.,用A物质表达的速率是;
D.,用A物质表达的速率是;
最大值是2.0,故选A。
3.【答案】D
A.升高温度加快反应速率,A不符合题意;
B.增大压强,缩小体积,增大反应物浓度,加快反应速率,B不符合题意;.
C.使用催化剂加快反应速率,C不符合题意;
D.将及时分离,平衡正向移动,各物质浓度降低,反应速率下降,D符合题意;
4.【答案】A
A.化学反应速率改变时,若正、逆反应速率改变的倍数相等,则化学平衡不发生移动,A错误;
B.化学反应若正、逆速率相等,则处于平衡状态,若化学平衡发生移动,化学反应速.率一定发生改变,B正确;
C.可逆反应进行的最终状态是达到平衡状态,此时。若外界条件改变引起平衡中,则化学平衡会向正反应方向移动,使减小,增大,最终,而达到新的平衡状态,C正确;
D.若化学平衡正向移动,则反应物浓度减小,生成物浓度增大;若化学平衡逆向移动,则反应物浓度增大,生成物浓度减小,当最终达到平衡时,导致反应物或生成物的含量发生变化,D正确;
5.D
A.平衡常数很大,表示该反应所能进行的程度大,由于NO与CO反应速率较小,在排入大气之前没有反应完全,故A错误;
B.平衡常数只与温度有关,增大压强,K不变,故B错误;
C.正反应放热,升高温度,速率加快,平衡逆向移动,K减小,故C错误;
D.选用适宜催化剂可加快反应速率,使尾气得到净化,达到尾气排放标准,故D正确;
6.B
A.利用半导体光催化还原氮气制备氨气,根据过程示意图可知,LDH为该反应的催化剂,A正确;
B.该过程不能表明氮气和氢气反应合成氨的反应能量变化,B错误;
C.根据题意和过程示意图可知总反应的化学方程式为:,C正确;
D.工业上把液态空气采用低温精馏法从空气中分离回收,D正确;
7.C
A.该可逆,反应的反应前后气体计量数不发生变化,当缩小反应容器体积,相当于加压,正逆反应速率同等程度增加,A项错误;
B.即使A,C物质均为气体,反应前后气体体积也会发生变化,当压强不随时间变化时,仍能说明反应达到平衡,B项错误;
C.在建立平衡前,碳的质量不断改变,达到平衡时,质量不变,因而碳的质量不再改变说明反应已达平衡,C项正确;
D.易知 ,合成氨气实际参与反应,因而,分解氨气时实际消耗的,,则,D项错误。
8.【答案】A
A.玻璃搅拌器起搅拌作用,能加快反应速率,减小实验误差,A正确;
B.温度计水银球保持在溶液内部即可,不能接触烧杯底部接触烧杯底部,否则可能把水银球撞碎,B错误;
C.中和热是强酸和强碱在稀溶液中反应生成1mol水时放出的热量,与酸碱的用量无关,所以用50mL 0.55mol/L的NaOH溶液与60mL 0.50mol/L的盐酸反应,测得中和热不变,C错误;
D.中和热测定用不到天平,且使用的是玻璃搅拌器,D错误。
9.D
A.600~1200s,的变化量为,在此时间段内
的变化量为其2倍,即,因此,生成的平均速率为,A说法不正确;
B.由表中数据可知,反应2220s时,的变化量为,其物质的量的变化量为,的变化量是其,即0.0525mol,因此,放出的在标准状况下的体积为,B说法不正确;
C.反应达到平衡时,正反应速率等于逆反应速率,用不同物质表示该反应的速率时,其数值之比等于化学计量数之比,,C说法不正确;
D.分析表中数据可知,该反应经过1110s(600-1710,1710-2820)后的浓度会变为原来的,因此,的浓度由变为时,可以推测上表中的x为,D说法正确。
10.C
A.反应的,在常温下可自发进行,需要,A错误;
B.一定条件下反应达到平衡时,正逆反应速率相等,即,B错误;
C.向溶液中加入少量水,促进电离,变大,C正确;D.,每生成,转移电子数目为,故生成,转移电子数目为0.4,D错误。
11.C
A、移走,逆反应速率减小,正反应速率大于逆反应速率,平衡正向移动,可以提高原料转化率,故A错误;
B、反应是气体体积减小的反应,达到平衡后缩小容器体积,增大了压强,平衡正向移动,增大压强,体积迅速减小,平衡移动程度不如体积减小带来的改变大,所以混合气体颜色加深,的体积分数比原平衡小,故B错误;
C、如果时该反应不能自发进行,该反应的熵变,且该反应不能自发进行,所以其,故C正确;
D、氨水是弱碱,c(OH)小于NaOH溶液的,故D错误。
正确答案选C。
12.A
A.是二元弱酸,说明1个最多电离出2个,消耗2个NaOH,故最终反应生成,A正确。
B.已知电离平衡常数:,向NaClO溶液中通入少量:,B项错误;
C.溶液中通时,会发生硫元素的归中反应生成S沉淀,C错误;
D.氢氧化铁溶于氢碘酸(强酸):,D错误。
13.B
A.C与反应为放热反应,与图不相符,A错误;
B.导电性随滴入溶液先减小到0后增大,与图相符,B正确;
C.催化剂只改变反应速率,平衡不移动,故转化率不变,与图不相符,C错误;
D.升高温度,平衡发生移动,正、递速率变化不相等,图象中正、逆速率增大相同的倍数,图象与实际不相符,D错误。
14.【答案】A
CO和反应后气体密度变为原气体密度的1.25倍,根据质量守恒可知,反应后的气体体积为反应前的气体体积的,为,物质的量为0.08mol;根据一氧化碳与氧气的反应方程式可知,气体的减少量为氧气的量,因此反应的氧气为0.02mol,则燃烧的CO为0.04mol,0.04mol的CO完全燃烧产生11.32kJ热量,则CO的燃烧热为:,则一氧化碳的燃烧热为283kJ/mol,答案选A。
15.C
,投入,;在恒容容器内,反应前混合气的n(总)=3mol,则反应后;根据化学反应列三段式得:
开始/mol 1 2
变化/mol 0.6 1.2 0.6 0.6
平衡/mol 0.4 0.8 0.6 0.6
【详解】
0.24x0.24
A.b点和c点温度相同,平衡常数相同,故,A正确;
B.在2L容器内的体积分数保持不变,各物质的浓度保持不变,反应达到平衡状态,B正确;
C.,C错误;
D.再加入(g)和,使二者分压均增大0.05kPa,则,化学平衡向右移动,故的转化率增大,D正确。
16.C
【详解】
A.相同体积pH均为3的醋酸和盐酸,初始时氢离子浓度相同,醋酸为弱酸,加水稀释促进醋酸的电离,将pH均为3的盐酸和醋酸溶液分别稀释10倍后,醋酸溶液的pH变化小,故A错误;
B.盐酸是强酸不存在电离平衡,醋酸是弱酸,溶液中存在电离平衡,相同体积pH均为3的醋酸和盐酸两种溶液总氢离子浓度相同,醋酸的浓度大于盐酸,加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积醋酸大于盐酸,故B错误;
C.相同体积pH均为3的醋酸和盐酸溶液的氢离子物质的量相等,加入-定量的锌粉,醋酸溶液中存在电离平衡,反应后醋酸又电离出氢离子,则产生气体的体积相同,两种溶液中消耗的氢离子物质的量相等,锌完全消耗说明醋酸过量,故C正确;
D.相同体积pH均为3的醋酸和盐酸溶液中氢离子浓度相同,加入足量的锌粉,反应开始时反应速率相等,醋酸溶液中存在电离平衡,反应后醋酸又电离出氢离子,因此产生的氢气的速率大于盐酸,反应后期强酸的反应速率下降得快,最终生成氢气的体积小,故D错误;
二、填空题(本大题共四题,52分)
17、(共12分)
Ⅰ.(每空1分)(1)c>a>b(2)c>b>a(3)a=b=c
Ⅱ.(每空1分)(4)A(5)B(6)C
Ⅲ.(每空2分)橙 c 6
18.(每空2分,共12分)
0.006 60% 0.04 0.12 0.06 0.18
【详解】
(1)若,用A的浓度变化表示阶段的平均反应速率为,时A的转化率为,故答案为:0.006;60%;
(2)由图可知时,A的起始物质的量浓度可知容器的体积为2L,又知时容器中B的物质的量为,而此过程中生成的B为:0.06mol,故加入B的物质的量为,若在t时,将容器体积变为1L,则此时,故答案为:0.04;0.12;
(3)结合(2)的分析,由可知反应若在相同体积的容器中,加入0.14molB和0.3molC,此时的各物质的起始量与题干图示一样,故在相同的条件下发生反应,达到的平衡与原平衡为等效平衡,故达到平衡后A的物质的量浓度与原平衡相等,故为0.06mol/L,故答案为:0.06;
(4)若在同条件,同体积容器中加入a molA、0.08molB和0.18molC,平衡后A的物质的量浓度与(3)相同,即两者平衡为等效平衡,故有:
起始量mol a 0.08 0.18
转化量mol 0.12 0.04 0.08
平衡量mol a+0.12 0.04 0.10
则有a+0.12=0.30,故a=0.18,故答案为:0.18。
19.(共17分)
(1)(2分)(2)(2分)
(3)bd(2分,漏选得一分) >(2分) (3分)
(4)(3分) 2.2(3分)
【详解】
(1)原已知可知得到,化合价总共升高10价,利用得失电子守恒配平得:,再考虑质量守恒,反应前少了6O、12H,
略
20.(共11分)
(1)(2分,条件未写扣一分) Ⅱ(2分)
(2)60%(2分) 0.045(2分)
(3)2.5a(3分)
【详解】
(1)①由图知,在300℃时铁与水蒸气反应产生,化学方程式为。
②当镍粉用量增加10倍后,甲酸的产量迅速减少,说明甲酸的消耗速率大于其生成速率,因此说明反应Ⅱ的速率要比反应Ⅰ的速率增加得快,当增加镍粉用量时,镍催化氢化制甲烷的两步发应中反应速率增加较大的一步是Ⅱ。
(2)反应Ⅰ:,反应Ⅱ:,当在1L恒容密闭容器中充入和,由图知,时,反应Ⅰ分别生成0.2mol甲烷、反应Ⅱ生成0.2mol乙烯,则
转化量(mol) 0.2 0.8 0.2 0.4
转化量(mol) 0.4 1.2 0.2 0.8
则时,的转化率。
平衡时,,
,
,
,
反应Ⅰ的平衡常数;
(3)对反应:,正反应为放热反应,温度升高,反应逆向进行,所以产物的物质的量是逐渐减少的,反应物的物质的量增大,由图可知,曲线a代表的物质为,b表示,c为,d为;温度时,m=3时,设,,列三段式如下:
起始(mol) 3 9 0 0
转化(mol) 2x 6x x 3x
平衡(mol) 3-2x 9-6x x 3x
,3-2x=x,解得x=1mol,则乙醇所占的物质的量分数为,反应达到平衡时物质d的分压
化学试题
满分:100分 时间:90分钟
第Ⅰ卷(选择题)
一、单选题(本小题包括16小题,每小题3分,共48分)
1.下列属于强电解质的是( )
A.CaO B. C. D.
2.在反应中,表示该反应速率最快的是( )
A. B.
C. D.
3.工业上利用与反应制取,下列措施不能加快该反应的反应速率的是( )
A.升高温度 B.缩小体积,增大压强
C.使用催化剂 D.将及时分离
4.下列对化学平衡移动理解错误的是( )
A.化学反应速率改变,平衡一定发生移动
B.化学平衡发生移动,化学反应速率一定改变
C.若外界条件改变引起平衡中,则平衡正向移动
D.化学平衡移动会导致反应物或生成物的含量发生变化
5.NO与CO是燃油汽车尾气中的两种有害气体,常温常压下它们之间的反应:
;,反应速率较小。有关该反应的说法正确的是( )
A.K很大,NO与CO在排入大气之前就已反应完全
B.增大压强,平衡将向右移动,
C.升高温度,既增大反应速率又增大K
D.选用适宜催化剂可达到尾气排放标准
6.我国某科研团队研究了一种利用半导体光催化还原氮气制备氨气的方法,该方法因具有高效、清洁的优点而引起极大关注,其过程示意图如图所示。下列说法错误的是( )
A.该过程LDH为催化剂
B.该过程表明,氮气和氢气反应合成氨,
C.该过程中总反应的化学方程式为
D.工业上可采用低温精馏法从空气中分离回收
7.下列说法正确的是( )
A.,其他条件不变,缩小反应容器体积,正逆反应速率不变
B.若压强不再随时间变化能说明反应已达平衡,则A、C不能同时是气体
C.,碳的质量不再改变说明反应已达平衡
D.1mol和3mol反应达到平衡时转化率为10%,放出的热量为;在相同温度和压强下,2mol分解为和的转化率为10%时,吸收的热量为,不等于
8.在测定中和热的实验中,下列说法正确的是( )
A.使用玻璃搅拌器是为了加大反应速率减小实验误差
B.为了准确测定反应混合溶液的温度,实验中温度计水银球应与小烧杯底部接触
C.用50mL的NaOH溶液与的盐酸反应,测得的中和热数值偏大
D.在测定中和热实验中需要使用的仪器有:天平、量简、烧杯、温度计、玻璃棒
9一定温度下:在的四氯化碳溶液(100mL)中发生分解反应:。在不同时刻测量放出的体积,换算成,浓度如下表:
t/s 0 600 1200 1710 2220 2820
1.40 0.96 0.66 0.48 0.35 0.24 0.12
下列说法正确的是( )
A.600~1200s,生成的平均速率为
B.反应2220s时,放出的体积为11.8L(标准状况)
C.反应达到平衡时,
D.推测上表中的x为3930
10.下列说法正确的是( )
A.在常温下可自发进行,则该反应的
B.一定条件下反应达到平衡时,
C.向溶液中加入少量水,溶液中比值减小
D.与足量的水反应生成,转移电子数目为0.8
11.下列说法正确的是( )
A.在合成氨工业中,移走可增大正反应速率,提高原料转化率
B.恒温下进行的反应达平衡时,缩小容器体积再达平衡时,气体的
颜色比第一次平衡时的深,的体积分数比原平衡大
C.常温下,)不能自发进行,则其
D.在相同温度下,物质的量浓度相等的氨水、NaOH溶液,相等
12.下列离子方程式与所述事实相符且正确的是( )
A.向二元弱酸亚磷酸溶液中滴入足量烧碱溶液:
B.已知电离平衡常数:,向NaClO溶液中通入少量:
C.向溶液中通入少量[已知:的,;的,:
D.氢氧化铁溶于氢碘酸(强酸):
13.下列图示与对应的叙述相符的是( )
图1 图2 图3 图4
A.图1表示C与反应的能量变化
B.图2表示溶液中滴入溶液,导电性随加入物质的量的变化
C.图3表示其他条件一定,反应在有、无催化剂下的体积分数随时间变化
D.图4表示反应达平衡后,升高温度时反应速率随时间的变化
14.一定条件下,2.24L(标准状况)CO与的混合气体燃烧时,放出11.32kJ的热量,反应后恢复至标准状况,产物的密度为原来气体密度的1.25倍,则CO的燃烧热的数值(单位:)为( )
A.283 B.1132 C.141.5 D.566
15.在T℃时,向容积为2L的恒容密闭容器中充入1mol和一定量的发生反应:;,若起始时容器内气体压强为1.2kPa,达到平衡时,HCHO的分压与起始的关系如图所示:下列说法不正确的是( )
A.b点的化学平衡常数
B.容器内的体积分数保持不变,说明达到平衡状态
C.若5min到达c点,则
D.c点时,再加入和,使二者分压均增大0.05kPa,转化率增大
16.有相同体积pH均为3的醋酸和盐酸,下列说法正确的是( )
A.稀释10倍后,两者的pH变化醋酸等于盐酸
B.中和相同浓度的氢氧化钠溶液,消耗氢氧化钠的物质的量盐酸大于醋酸
C.加入一定量的锌粉,产生气体的体积相同,则醋酸一定过量
D.加入足量的锌粉,产生氢气的速率随时间的变化如图
第Ⅱ卷(非选择题)
二、填空题(本大题包括4小题,共52分)
17.(共12分)回答下列问题
Ⅰ.(每空1分)一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。
(1)a、b、c三点溶液的pH大小关系:______。
(2)a、b、C三点的电离程度大小关系:______。
(3)a.b、c三点溶液用NaOH溶液中和,消耗NaOH溶液体积大小关系:______。
Ⅱ.(每空1分)锌粉与稀硫酸反应产生氢气的体积时间关系如下图所示,选择正确的选项填空。
A. B. C. D.
(4)将等质量的两份锌粉a、b分别加入过量的稀硫酸中,同时向a中加入少量的溶液,产生的体积V(L)与时间t(min)的关系是______。
(5)将过量的两份锌粉a、b分别加入定量的稀硫酸,同时向a中加入少量的溶液,产生的体积V(L)与时间t(min)的关系是______。
(6)将(5)中的溶液改成溶液,其他条件不变,则图像是______。
Ⅲ.(每空2分)工业废水中常含有一定量的和,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种,其中一种是还原沉淀法,该法的工艺流程为:
其中第①步存在平衡:
(1)向平衡体系滴加少量浓,则溶液显______色。
(2)能说明第①步反应达平衡状态的是______。
a.和的浓度相同 b.
c.溶液的颜色不变
(3)第②步中,还原1mol离子,需要______mol的。
18.(每空2分,共12分)向某恒容密闭容器中加入0.3molA、0.1molC和一定量的B三种气体,一定条件下发生如下反应:,各物质的浓度随时间变化如图所示[t0~t1阶段的c(B)变化未画出]。
(1)若t1=15s,用A的浓度变化表示阶段的平均反应速率为,t1时A的转化率为______。
(2)由图可知t0时,加入B的物质的量为______mol,若在t1时,将容器体积变为1L,则此时c(A)=______mol/L
(3)若在相同体积的容器中,加入0.14molB和0.3molC,在相同的条件下发生反应,达平衡后A的物质的量浓度为______mol/L。
(4)若在同条件,同体积容器中加入a molA、0.08molB和0.18molC,平衡后A的物质的量浓度与(3)相同,则a=______。
19.(除标注外每空2分,共17分)砷(As)是第四周期ⅤA族元素,可以形成、、、等化合物,有着广泛的用途。回答下列问题:
(1)工业上常将含砷废渣(主要成分为)制成浆状,通入氧化,生成和单质硫。写出发生反应的化学方程式______。
(2)已知:
则反应的______;
(3)298K时,将、和20mLNaOH溶液混合,发生反应:。溶液中与反应时间(t)的关系如图所示。
①下列不可判断反应达到平衡的是______(填标号);
a.溶液的pH不再变化 b.
C.不再变化 d.
②时______时(填“>” “<”或“=”);
③(3分)若平衡时溶液的,则该反应的化学平衡常数K=______。(用含x、y的式子表示);
(3)和水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题图-1和题图-2所示:
图-1 图-2
①(3分)以酚酞为指示剂(变色范围pH8.0~10.0),将NaOH溶液逐滴加入到溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为______;
②(3分)第一步电离方程式的电离常数为,则______;
20.(除标注外每空2分,共11分)2019年国际非政府组织“全球碳计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋缓。的综合利用是解决温室问题的有效途径。
(1)甲烷化反应是由法国化学家PaulSabatier提出的。催化氢化制甲烷的研究过程如图所示:
①上述过程中,产生反应的化学方程式为______。
②HCOOH是转化为的中间体:
当镍粉用量增加10倍后,甲酸的产量迅速减少。当增加镍粉用量时,镍催化氢化制甲烷的两步发应中反应速率增加较大的一步是______(填“Ⅰ”或“Ⅱ”)。
(2)经催化加氢可以生成低碳烃,主要有两个竞争反应:
反应Ⅰ:
反应Ⅱ:
在1L恒容密闭容器中充入1mol和4mol,测得平衡时有关物质的物质的量随温度变化如图(1)所示。
图(1) 图(2)
T1℃时,的转化率为______。T1℃时,反应Ⅰ的平衡常数K=______。
(3)(3分)已知催化加氢合成乙醇的反应原理为 。m代表起始时的投料比,即。m=3时,该反应达到平衡状态后,恒压条件下改变温度,各物质的物质的量分数与温度的关系如图(2)。温度时,反应达到平衡时物质d的分压p(d)=______Mpa。
安徽省卓越县中联盟2021—2022学年度第一学期
高二年级期中联考化学试题解析
一、单选题(每题3分,共16小题)
题号 1 2 3 4 5 6 7 8
答案 A A D A D B C A
题号 9 10 11 12 13 14 15 16
答案 D C C A B A C C
1.【答案】A
A.CaO是离子化合物,在熔融状态下能够发生电离而导电,属于电解质,是强电解质,A符合题意;
B.是单质,不是化合物,因此不属于电解质,也不属于非电解质,B不符合题意;
C.是共价化合物,在水溶液中能够电离产生自由移动的离子而导电,属于电解质;由于只能部分电离,存在电离平衡,因此属于弱电解质,C不符合题意;
D.是化合物,由于只能微弱的电离产生自由移动的离子,因此属于弱电解质,D不符合题意;
2.【答案】A
反应速率大小的比较,要统一单位,化成同一物质表达的速率后,比较数值大小即可;反应速率之比等于化学计量数之比。
A.;
B.,用A物质表达的速率是;
C.,用A物质表达的速率是;
D.,用A物质表达的速率是;
最大值是2.0,故选A。
3.【答案】D
A.升高温度加快反应速率,A不符合题意;
B.增大压强,缩小体积,增大反应物浓度,加快反应速率,B不符合题意;.
C.使用催化剂加快反应速率,C不符合题意;
D.将及时分离,平衡正向移动,各物质浓度降低,反应速率下降,D符合题意;
4.【答案】A
A.化学反应速率改变时,若正、逆反应速率改变的倍数相等,则化学平衡不发生移动,A错误;
B.化学反应若正、逆速率相等,则处于平衡状态,若化学平衡发生移动,化学反应速.率一定发生改变,B正确;
C.可逆反应进行的最终状态是达到平衡状态,此时。若外界条件改变引起平衡中,则化学平衡会向正反应方向移动,使减小,增大,最终,而达到新的平衡状态,C正确;
D.若化学平衡正向移动,则反应物浓度减小,生成物浓度增大;若化学平衡逆向移动,则反应物浓度增大,生成物浓度减小,当最终达到平衡时,导致反应物或生成物的含量发生变化,D正确;
5.D
A.平衡常数很大,表示该反应所能进行的程度大,由于NO与CO反应速率较小,在排入大气之前没有反应完全,故A错误;
B.平衡常数只与温度有关,增大压强,K不变,故B错误;
C.正反应放热,升高温度,速率加快,平衡逆向移动,K减小,故C错误;
D.选用适宜催化剂可加快反应速率,使尾气得到净化,达到尾气排放标准,故D正确;
6.B
A.利用半导体光催化还原氮气制备氨气,根据过程示意图可知,LDH为该反应的催化剂,A正确;
B.该过程不能表明氮气和氢气反应合成氨的反应能量变化,B错误;
C.根据题意和过程示意图可知总反应的化学方程式为:,C正确;
D.工业上把液态空气采用低温精馏法从空气中分离回收,D正确;
7.C
A.该可逆,反应的反应前后气体计量数不发生变化,当缩小反应容器体积,相当于加压,正逆反应速率同等程度增加,A项错误;
B.即使A,C物质均为气体,反应前后气体体积也会发生变化,当压强不随时间变化时,仍能说明反应达到平衡,B项错误;
C.在建立平衡前,碳的质量不断改变,达到平衡时,质量不变,因而碳的质量不再改变说明反应已达平衡,C项正确;
D.易知 ,合成氨气实际参与反应,因而,分解氨气时实际消耗的,,则,D项错误。
8.【答案】A
A.玻璃搅拌器起搅拌作用,能加快反应速率,减小实验误差,A正确;
B.温度计水银球保持在溶液内部即可,不能接触烧杯底部接触烧杯底部,否则可能把水银球撞碎,B错误;
C.中和热是强酸和强碱在稀溶液中反应生成1mol水时放出的热量,与酸碱的用量无关,所以用50mL 0.55mol/L的NaOH溶液与60mL 0.50mol/L的盐酸反应,测得中和热不变,C错误;
D.中和热测定用不到天平,且使用的是玻璃搅拌器,D错误。
9.D
A.600~1200s,的变化量为,在此时间段内
的变化量为其2倍,即,因此,生成的平均速率为,A说法不正确;
B.由表中数据可知,反应2220s时,的变化量为,其物质的量的变化量为,的变化量是其,即0.0525mol,因此,放出的在标准状况下的体积为,B说法不正确;
C.反应达到平衡时,正反应速率等于逆反应速率,用不同物质表示该反应的速率时,其数值之比等于化学计量数之比,,C说法不正确;
D.分析表中数据可知,该反应经过1110s(600-1710,1710-2820)后的浓度会变为原来的,因此,的浓度由变为时,可以推测上表中的x为,D说法正确。
10.C
A.反应的,在常温下可自发进行,需要,A错误;
B.一定条件下反应达到平衡时,正逆反应速率相等,即,B错误;
C.向溶液中加入少量水,促进电离,变大,C正确;D.,每生成,转移电子数目为,故生成,转移电子数目为0.4,D错误。
11.C
A、移走,逆反应速率减小,正反应速率大于逆反应速率,平衡正向移动,可以提高原料转化率,故A错误;
B、反应是气体体积减小的反应,达到平衡后缩小容器体积,增大了压强,平衡正向移动,增大压强,体积迅速减小,平衡移动程度不如体积减小带来的改变大,所以混合气体颜色加深,的体积分数比原平衡小,故B错误;
C、如果时该反应不能自发进行,该反应的熵变,且该反应不能自发进行,所以其,故C正确;
D、氨水是弱碱,c(OH)小于NaOH溶液的,故D错误。
正确答案选C。
12.A
A.是二元弱酸,说明1个最多电离出2个,消耗2个NaOH,故最终反应生成,A正确。
B.已知电离平衡常数:,向NaClO溶液中通入少量:,B项错误;
C.溶液中通时,会发生硫元素的归中反应生成S沉淀,C错误;
D.氢氧化铁溶于氢碘酸(强酸):,D错误。
13.B
A.C与反应为放热反应,与图不相符,A错误;
B.导电性随滴入溶液先减小到0后增大,与图相符,B正确;
C.催化剂只改变反应速率,平衡不移动,故转化率不变,与图不相符,C错误;
D.升高温度,平衡发生移动,正、递速率变化不相等,图象中正、逆速率增大相同的倍数,图象与实际不相符,D错误。
14.【答案】A
CO和反应后气体密度变为原气体密度的1.25倍,根据质量守恒可知,反应后的气体体积为反应前的气体体积的,为,物质的量为0.08mol;根据一氧化碳与氧气的反应方程式可知,气体的减少量为氧气的量,因此反应的氧气为0.02mol,则燃烧的CO为0.04mol,0.04mol的CO完全燃烧产生11.32kJ热量,则CO的燃烧热为:,则一氧化碳的燃烧热为283kJ/mol,答案选A。
15.C
,投入,;在恒容容器内,反应前混合气的n(总)=3mol,则反应后;根据化学反应列三段式得:
开始/mol 1 2
变化/mol 0.6 1.2 0.6 0.6
平衡/mol 0.4 0.8 0.6 0.6
【详解】
0.24x0.24
A.b点和c点温度相同,平衡常数相同,故,A正确;
B.在2L容器内的体积分数保持不变,各物质的浓度保持不变,反应达到平衡状态,B正确;
C.,C错误;
D.再加入(g)和,使二者分压均增大0.05kPa,则,化学平衡向右移动,故的转化率增大,D正确。
16.C
【详解】
A.相同体积pH均为3的醋酸和盐酸,初始时氢离子浓度相同,醋酸为弱酸,加水稀释促进醋酸的电离,将pH均为3的盐酸和醋酸溶液分别稀释10倍后,醋酸溶液的pH变化小,故A错误;
B.盐酸是强酸不存在电离平衡,醋酸是弱酸,溶液中存在电离平衡,相同体积pH均为3的醋酸和盐酸两种溶液总氢离子浓度相同,醋酸的浓度大于盐酸,加等浓度的NaOH溶液至恰好中和,所需NaOH溶液的体积醋酸大于盐酸,故B错误;
C.相同体积pH均为3的醋酸和盐酸溶液的氢离子物质的量相等,加入-定量的锌粉,醋酸溶液中存在电离平衡,反应后醋酸又电离出氢离子,则产生气体的体积相同,两种溶液中消耗的氢离子物质的量相等,锌完全消耗说明醋酸过量,故C正确;
D.相同体积pH均为3的醋酸和盐酸溶液中氢离子浓度相同,加入足量的锌粉,反应开始时反应速率相等,醋酸溶液中存在电离平衡,反应后醋酸又电离出氢离子,因此产生的氢气的速率大于盐酸,反应后期强酸的反应速率下降得快,最终生成氢气的体积小,故D错误;
二、填空题(本大题共四题,52分)
17、(共12分)
Ⅰ.(每空1分)(1)c>a>b(2)c>b>a(3)a=b=c
Ⅱ.(每空1分)(4)A(5)B(6)C
Ⅲ.(每空2分)橙 c 6
18.(每空2分,共12分)
0.006 60% 0.04 0.12 0.06 0.18
【详解】
(1)若,用A的浓度变化表示阶段的平均反应速率为,时A的转化率为,故答案为:0.006;60%;
(2)由图可知时,A的起始物质的量浓度可知容器的体积为2L,又知时容器中B的物质的量为,而此过程中生成的B为:0.06mol,故加入B的物质的量为,若在t时,将容器体积变为1L,则此时,故答案为:0.04;0.12;
(3)结合(2)的分析,由可知反应若在相同体积的容器中,加入0.14molB和0.3molC,此时的各物质的起始量与题干图示一样,故在相同的条件下发生反应,达到的平衡与原平衡为等效平衡,故达到平衡后A的物质的量浓度与原平衡相等,故为0.06mol/L,故答案为:0.06;
(4)若在同条件,同体积容器中加入a molA、0.08molB和0.18molC,平衡后A的物质的量浓度与(3)相同,即两者平衡为等效平衡,故有:
起始量mol a 0.08 0.18
转化量mol 0.12 0.04 0.08
平衡量mol a+0.12 0.04 0.10
则有a+0.12=0.30,故a=0.18,故答案为:0.18。
19.(共17分)
(1)(2分)(2)(2分)
(3)bd(2分,漏选得一分) >(2分) (3分)
(4)(3分) 2.2(3分)
【详解】
(1)原已知可知得到,化合价总共升高10价,利用得失电子守恒配平得:,再考虑质量守恒,反应前少了6O、12H,
略
20.(共11分)
(1)(2分,条件未写扣一分) Ⅱ(2分)
(2)60%(2分) 0.045(2分)
(3)2.5a(3分)
【详解】
(1)①由图知,在300℃时铁与水蒸气反应产生,化学方程式为。
②当镍粉用量增加10倍后,甲酸的产量迅速减少,说明甲酸的消耗速率大于其生成速率,因此说明反应Ⅱ的速率要比反应Ⅰ的速率增加得快,当增加镍粉用量时,镍催化氢化制甲烷的两步发应中反应速率增加较大的一步是Ⅱ。
(2)反应Ⅰ:,反应Ⅱ:,当在1L恒容密闭容器中充入和,由图知,时,反应Ⅰ分别生成0.2mol甲烷、反应Ⅱ生成0.2mol乙烯,则
转化量(mol) 0.2 0.8 0.2 0.4
转化量(mol) 0.4 1.2 0.2 0.8
则时,的转化率。
平衡时,,
,
,
,
反应Ⅰ的平衡常数;
(3)对反应:,正反应为放热反应,温度升高,反应逆向进行,所以产物的物质的量是逐渐减少的,反应物的物质的量增大,由图可知,曲线a代表的物质为,b表示,c为,d为;温度时,m=3时,设,,列三段式如下:
起始(mol) 3 9 0 0
转化(mol) 2x 6x x 3x
平衡(mol) 3-2x 9-6x x 3x
,3-2x=x,解得x=1mol,则乙醇所占的物质的量分数为,反应达到平衡时物质d的分压
同课章节目录
