化学能与热能
图片预览







文档简介
(共24张PPT)
第二章 化学反应与能量
第一节 化学能与热能
在生活中,我们利用煤、天然气等燃料燃烧放出的热能来做饭做菜
那么这些热能是从哪里来的?
在实验室里,加热高锰酸钾制取氧气
在工业上,高温煅烧石灰石制取生石灰
这两个反应的加热和高温提供的能量有什么作用?
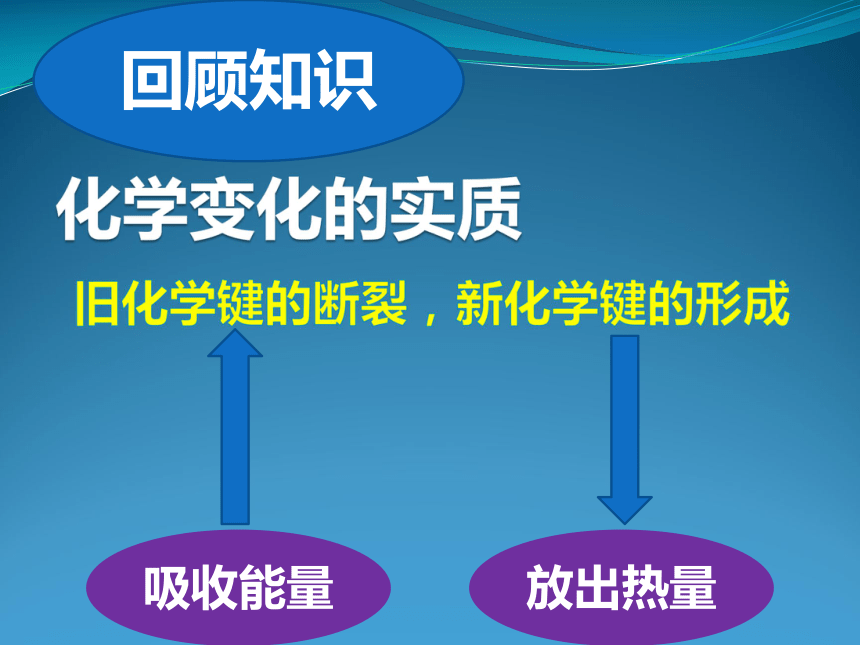
化学变化的实质
旧化学键的断裂,新化学键的形成
回顾知识
吸收能量
放出热量
探讨一
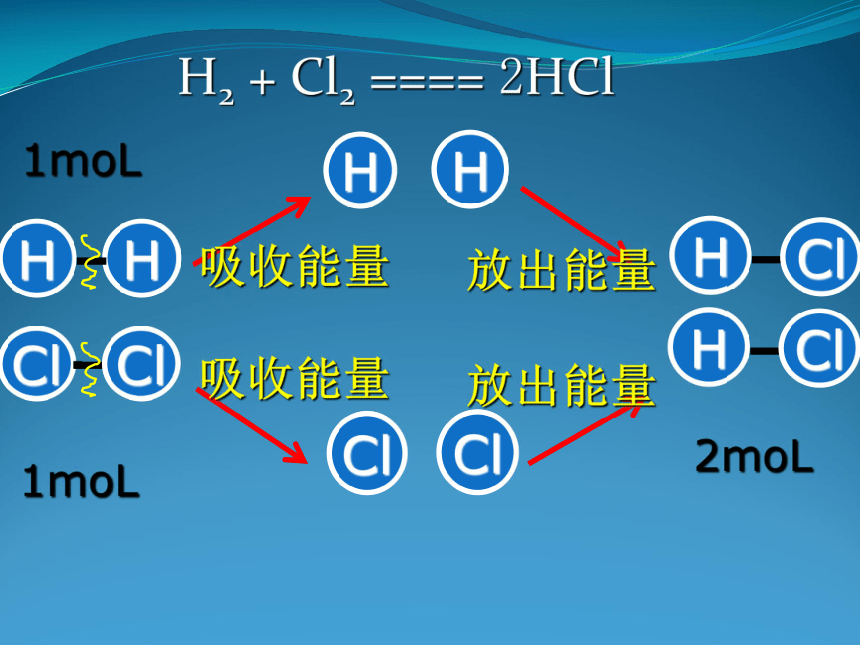
化学键的变化与化学反应中能量变化的关系
H2与Cl2反应
H2 + Cl2 ==== 2HCl
H
H
Cl
Cl
1moL
1moL
H
Cl
H
Cl
2moL
吸收能量
吸收能量
放出能量
放出能量
Cl
Cl
H
H
探讨二
怎么判断一个化学反应是吸收能量还是放出能量吗?
从化学键的角度来分析(微观)
旧化学键断 裂
新化学键生成
吸收能量E1
释放 能量E2
反应物
生成物
化学反应
当E1>E2 吸收能量(E1-E2)
当E2>E1 释放能量(E2-E1)
一.物质具有的能量越低,其分子越稳定
则化学键断裂时,吸收的能量越多;化学键形成时放出的能量越多
二.物质具有的能量越高,其分子越不稳定
则化学键断裂时,吸收的能量越少;化学键形成时放出的能量越少
反应物总能量
生成物总能量
放出热量
>
从物质总能量角度来分析(宏观)
生成物总能量
反应物总能量
<
吸收热量
探讨三
什么是放热反应和吸热反应?如何判断?
化学反应
放热反应:有热量放出的化学反应
吸热反应:吸收热量的化学反应
两大基本定律
质量守恒定律:自然界的物质可以发生相互转化,但是总质量保持不变。
能量守恒定律:一种形式的能量可以转化为另一种形式的能量,转化的途径和能量形式可以不同,但是体系包含的能量不变。
实验一 铝片与盐酸反应
实验现象 结论
1.铝片上有气泡冒出
2.试管底部发热
反应放出热量
2Al+6HCl=2AlCl3+3H2
放热反应
实验二 Ba(OH)2· 8H2O与NH4Cl的反应
实验现象 结论
1.有刺激性气味产生
2.烧杯底部很冷
3.玻璃片粘到烧杯底部
反应吸收热量
Ba(OH)2· 8H2O + 2NH4Cl=BaCl2 +2NH3 +10H2O
吸热反应
常见的吸热反应与放热反应
放热反应
①所有燃烧、爆炸反应
②酸碱中 和 反 应
③活泼金属与水或酸的反应
④大部分化合反应
(但CO2+C===2CO是吸热反应)
⑤物质的缓慢氧化
高温
①大多数分解反应(H2O2分解放热)
②强碱与铵盐
(如NH4Cl与Ba(OH)2·8H2O)
③需持续不断加热才能进行的反应
(如C + CO 2、H 2 + CuO 、C +H 2O)
吸热反应
补充知识《成才之路》43页 反应条件与能量变化
(1)加热的反应一定是吸热反应
(2)不需要加热的反应一定是放热反应
(3)一个反应是吸热还是放热与反应条 件没有直接联系,与反应物及生成物的总能量的相对大小有关
实验三 酸碱中和反应
实验现象 结论
反应温度升高
反应放热
NaOH+HCl=NaCl +H2O
实验小结:中和反应放热
探讨四 什么是中和热?
1.概念:稀溶液中,酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热。
2.标准:稀溶液、生成1molH2O放出的热量
3.数值:57.3KJ/mol 强酸强碱 可溶性盐
小结
问题一.化学反应中能量变化的主要原因
化学键的断裂与形成
问题二.怎样判断反应是放出能量还是吸收能量
反应物总能量与生成物总能量的相对大小
化学键断裂的吸收的能量和形成释放的能量相对大小
问题三 什么是放热反应和吸热反应?如何判断?
问题四 什么是中和热?
下课咯。。。
第二章 化学反应与能量
第一节 化学能与热能
在生活中,我们利用煤、天然气等燃料燃烧放出的热能来做饭做菜
那么这些热能是从哪里来的?
在实验室里,加热高锰酸钾制取氧气
在工业上,高温煅烧石灰石制取生石灰
这两个反应的加热和高温提供的能量有什么作用?
化学变化的实质
旧化学键的断裂,新化学键的形成
回顾知识
吸收能量
放出热量
探讨一
化学键的变化与化学反应中能量变化的关系
H2与Cl2反应
H2 + Cl2 ==== 2HCl
H
H
Cl
Cl
1moL
1moL
H
Cl
H
Cl
2moL
吸收能量
吸收能量
放出能量
放出能量
Cl
Cl
H
H
探讨二
怎么判断一个化学反应是吸收能量还是放出能量吗?
从化学键的角度来分析(微观)
旧化学键断 裂
新化学键生成
吸收能量E1
释放 能量E2
反应物
生成物
化学反应
当E1>E2 吸收能量(E1-E2)
当E2>E1 释放能量(E2-E1)
一.物质具有的能量越低,其分子越稳定
则化学键断裂时,吸收的能量越多;化学键形成时放出的能量越多
二.物质具有的能量越高,其分子越不稳定
则化学键断裂时,吸收的能量越少;化学键形成时放出的能量越少
反应物总能量
生成物总能量
放出热量
>
从物质总能量角度来分析(宏观)
生成物总能量
反应物总能量
<
吸收热量
探讨三
什么是放热反应和吸热反应?如何判断?
化学反应
放热反应:有热量放出的化学反应
吸热反应:吸收热量的化学反应
两大基本定律
质量守恒定律:自然界的物质可以发生相互转化,但是总质量保持不变。
能量守恒定律:一种形式的能量可以转化为另一种形式的能量,转化的途径和能量形式可以不同,但是体系包含的能量不变。
实验一 铝片与盐酸反应
实验现象 结论
1.铝片上有气泡冒出
2.试管底部发热
反应放出热量
2Al+6HCl=2AlCl3+3H2
放热反应
实验二 Ba(OH)2· 8H2O与NH4Cl的反应
实验现象 结论
1.有刺激性气味产生
2.烧杯底部很冷
3.玻璃片粘到烧杯底部
反应吸收热量
Ba(OH)2· 8H2O + 2NH4Cl=BaCl2 +2NH3 +10H2O
吸热反应
常见的吸热反应与放热反应
放热反应
①所有燃烧、爆炸反应
②酸碱中 和 反 应
③活泼金属与水或酸的反应
④大部分化合反应
(但CO2+C===2CO是吸热反应)
⑤物质的缓慢氧化
高温
①大多数分解反应(H2O2分解放热)
②强碱与铵盐
(如NH4Cl与Ba(OH)2·8H2O)
③需持续不断加热才能进行的反应
(如C + CO 2、H 2 + CuO 、C +H 2O)
吸热反应
补充知识《成才之路》43页 反应条件与能量变化
(1)加热的反应一定是吸热反应
(2)不需要加热的反应一定是放热反应
(3)一个反应是吸热还是放热与反应条 件没有直接联系,与反应物及生成物的总能量的相对大小有关
实验三 酸碱中和反应
实验现象 结论
反应温度升高
反应放热
NaOH+HCl=NaCl +H2O
实验小结:中和反应放热
探讨四 什么是中和热?
1.概念:稀溶液中,酸与碱发生中和反应生成1molH2O时所释放的热量称为中和热。
2.标准:稀溶液、生成1molH2O放出的热量
3.数值:57.3KJ/mol 强酸强碱 可溶性盐
小结
问题一.化学反应中能量变化的主要原因
化学键的断裂与形成
问题二.怎样判断反应是放出能量还是吸收能量
反应物总能量与生成物总能量的相对大小
化学键断裂的吸收的能量和形成释放的能量相对大小
问题三 什么是放热反应和吸热反应?如何判断?
问题四 什么是中和热?
下课咯。。。
